头状四照花抗疟活性成分研究
2018-04-21张盼盼肖朝江
张盼盼,肖朝江,刘 健,邱 琳,沈 怡,董 相,姜 北
(大理大学药物研究所,云南大理 671000)
头状四照花[Dendrobenthamia capitata(Wall.)Hutch.]系山茱萸科(Cornaceae)四照花属(Dendro⁃benthamia)植物,主要分布于我国云南、贵州、四川、西藏、广西等西南地区〔1〕。该植物为常绿乔木,稀灌木,高3~15 m,稀达20 m;叶对生;头状花序球形,花萼管状;果序扁球形,直径1.5~2.4 cm,成熟时紫红色;花期5~6月;果期9~10月。头状四照花又名野荔枝、山荔枝和鸡嗉子等,全株均能药用〔2〕。头状四照花的叶主治食积、小儿疳积、虫积腹痛、肝炎、腹水、水火烫伤、外伤出血和疮疡;根用于湿热痢疾和泄泻;果实也可用于治疗食积气胀、小儿疳积、肝炎、蛔虫病、烧烫伤和外伤出血等〔2〕。
本课题组前期研究结果显示该植物提取物具有一定的β-羟高铁血红素形成抑制活性。为此本研究采用HPLC、柱层析等手段进行活性成分追踪,结果从头状四照花枝叶中追踪得到3个活性强于粗提物的化合物,以及1个非活性化合物,分别鉴定为儿茶素(1)、槲皮素(2)、异槲皮苷(3)和2α-羟基乌索酸(4)。见图1。
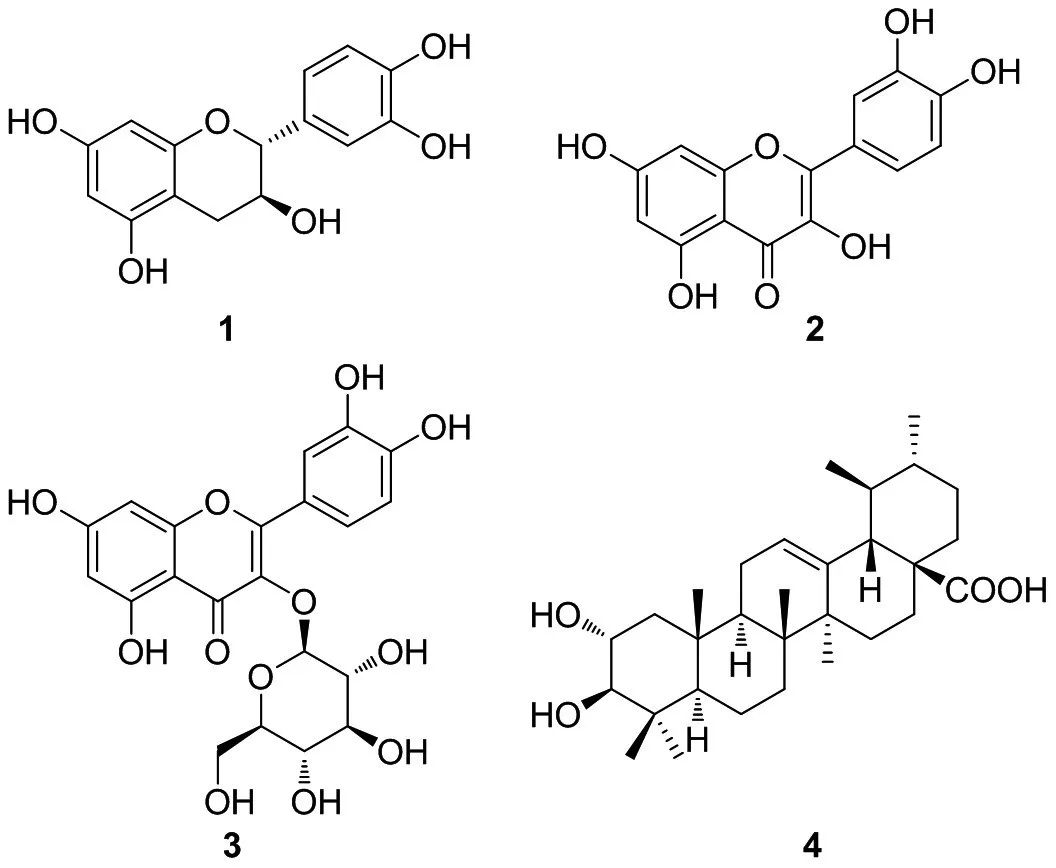
图1 化合物1~4的结构
1 仪器与材料
Agilent 1100高效液相色谱仪(美国安捷伦科技有限公司);色谱柱(Phenomenex 125 C18250 mm×4.6 mm;5 μm);AL-204电子天平[梅特勒-托利(上海)有限公司];MCO-18AIC CO2培养箱(日本三洋公司);BioTek Synergy HT酶标仪(美国BioTek仪器公司);Bruker AvanceⅢ-400核磁共振仪(德国布鲁克公司),四甲基硅烷(TMS)为内标;柱层析硅胶和薄层层析硅胶板GF254(青岛海洋化工厂)。
氯化铁血红素、磷酸氯喹、HEPES(4-羟乙基哌嗪乙磺酸,美国Sigma公司);DMSO[二甲基亚砜,利安隆博华(天津)医药化学有限公司];吡啶、冰醋酸(上海申博化工有限公司);三水合乙酸钠(天津市盛奥化学试剂有限公司);高效液相色谱纯甲醇、乙腈[赛默飞世尔科技(中国)有限公司];超纯水[(自制)艾柯DZG-303A]。
本实验所用头状四照花[Dendrobenthamia capi⁃tata(Wall.)Hutch.]枝叶于2015年5月采自云南省大理市漾濞县,由大理大学药学与化学学院生药学教研室张德全博士鉴定,植物标本(20150507-6-A)存放于大理大学药物研究所姜北教授研究组。
2 实验方法
2.1 提取分离头状四照花枝叶8.5 kg,分别用95%乙醇和70%乙醇各冷浸提取2次,减压浓缩所得总浸膏(1.4 kg)用水分散后依次用乙酸乙酯、正丁醇分配数次,得相应萃取物。乙酸乙酯萃取物(430 g)经200~300目硅胶柱色谱,氯仿-丙酮混合溶剂(1:0至0:1)梯度洗脱,得到7个组分(A~G)。C组分经反复反相RP18柱色谱(甲醇-水)得化合物2(17.1 mg)。D组分经ODS(甲醇-水0:1~1:0)和凝胶反复柱层析(Sephadex LH-20,氯仿-甲醇1:1)依次得化合物1(26.2 mg)、3(375.3 mg)和4(13.5 mg)。
2.2 β-羟高铁血红素形成抑制实验精密称取上述粗提物、粗分段和单体化合物,配成系列浓度溶液备用。将50 μL不同浓度的供试样品加入于96孔板中,平行设3个复孔。随后每孔依次加入50 μL氯高铁血红素储备液(1.0 mmol∕L,溶解于DMSO中)和80 μL醋酸盐缓冲液(4 mol∕L,pH 5.0)与之混合。置于50℃孵育5 h,取出待室温后,每孔加入100 μL 30%(v/v)的吡啶-HEPES(20 mmol∕L,pH 7.5)溶液。室温放置10 h后,从每孔中移取50 μL上清液至另一96孔板中,之后每孔加入200 μL吡啶-HEPES(20 mmol∕L,pH 7.5)溶液,并在405 nm波长处测定吸收值。由羟高铁血红素标准曲线得出未反应的羟高铁血红素的浓度,从而计算出供试品对β-羟高铁血红素形成的半数抑制浓度(IC50)。设置氯喹为阳性对照,蒸馏水为溶媒对照〔3-5〕。
2.3 数据处理所得数据用均数±标准差(±s)表示,采用SPSS 17.0统计软件对数据进行单因素方差分析和组间LSD检验。
3 实验结果
3.1 β-羟高铁血红素形成抑制活性按“2.2”项下方法对头状四照花粗提物进行抗疟活性筛选,结果发现该样品具有一定的β-羟高铁血红素形成抑制活性,因此,又对其各萃取部位进行活性测试。见表1。从表1中可以看出,乙酸乙酯萃取物和萃余水相均具有一定的β-羟高铁血红素形成抑制活性;其中,乙酸乙酯萃取物活性较好,IC50值为(902.7±6.4)μg∕mL。
表1 头状四照花不同部位β-羟高铁血红素形成抑制结果(±s,n=3)
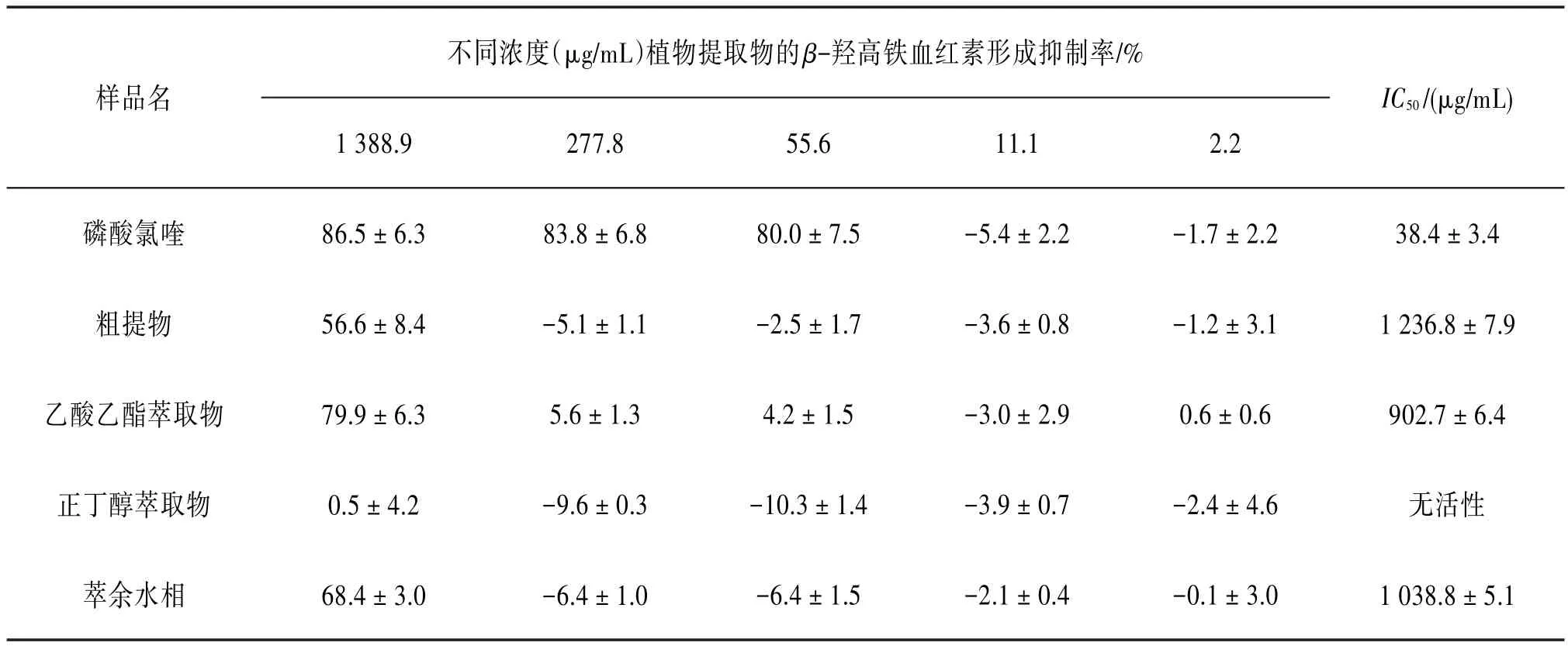
表1 头状四照花不同部位β-羟高铁血红素形成抑制结果(±s,n=3)
样品名不同浓度(μg∕mL)植物提取物的β-羟高铁血红素形成抑制率∕%1 388.9277.855.611.12.2 IC50∕(μg∕mL)磷酸氯喹粗提物乙酸乙酯萃取物正丁醇萃取物萃余水相86.5±6.3 56.6±8.4 79.9±6.3 0.5±4.2 68.4±3.0 83.8±6.8-5.1±1.1 5.6±1.3-9.6±0.3-6.4±1.0 80.0±7.5-2.5±1.7 4.2±1.5-10.3±1.4-6.4±1.5-5.4±2.2-3.6±0.8-3.0±2.9-3.9±0.7-2.1±0.4-1.7±2.2-1.2±3.1 0.6±0.6-2.4±4.6-0.1±3.0 38.4±3.4 1 236.8±7.9 902.7±6.4无活性1 038.8±5.1
继而采用硅胶柱层析对乙酸乙酯萃取物进行粗划段及活性测试,结果发现粗分段C和D具有较好的活性。见表2。随后又利用HPLC和RP18等柱层析技术方法追踪分离粗分段C和D中的活性成分。结果从二者中得到3个活性显著强于粗提物的化合物(1~3),IC50值分别为>277.8、(155.7±6.5)和>277.8 μg∕mL,以及1个非活性化合物(4)。见表3。
表2 头状四照花乙酸乙酯萃取物粗分段A~G的β-羟高铁血红素形成抑制结果(±s,n=3)
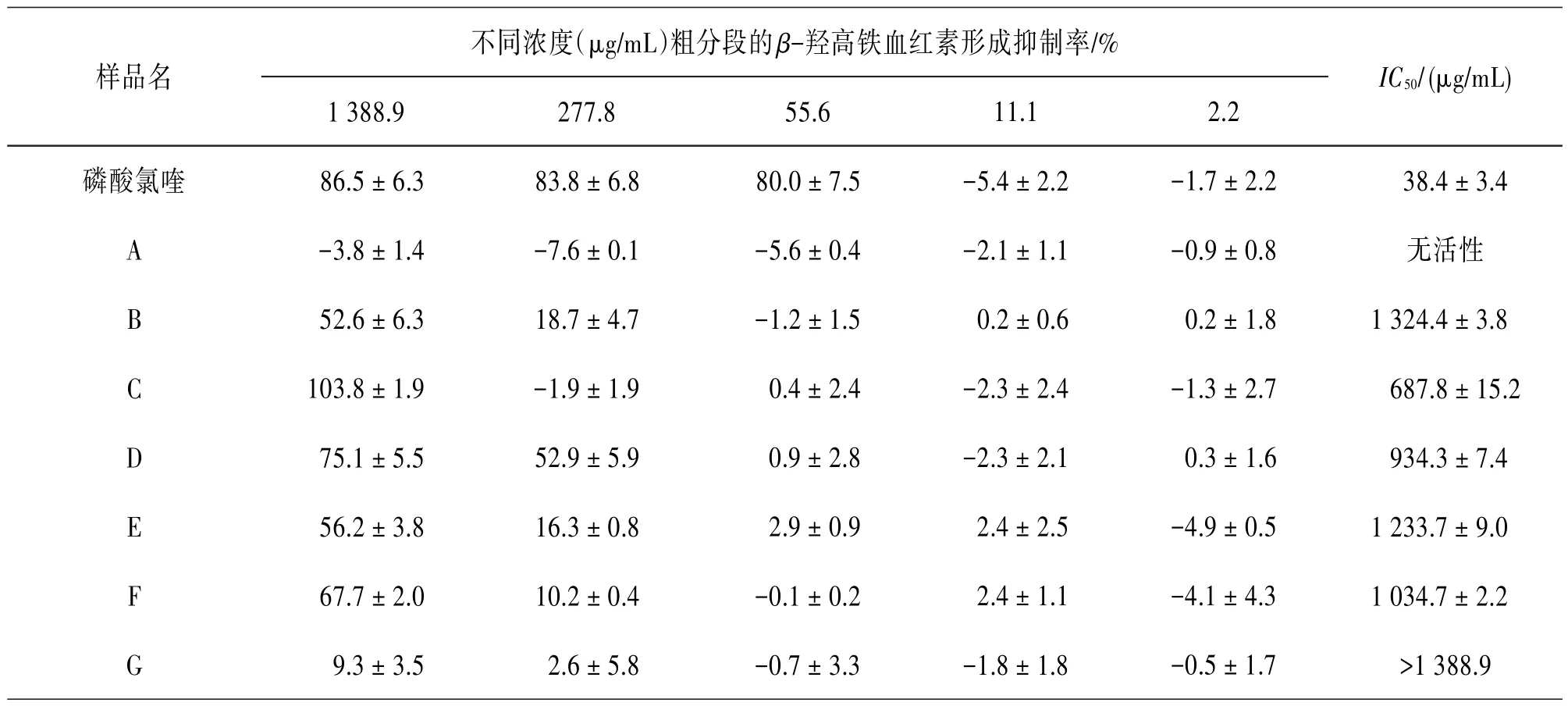
表2 头状四照花乙酸乙酯萃取物粗分段A~G的β-羟高铁血红素形成抑制结果(±s,n=3)
不同浓度(μg∕mL)粗分段的β-羟高铁血红素形成抑制率∕%样品名IC50∕(μg∕mL)磷酸氯喹A B C D E F G 1 388.9 86.5±6.3-3.8±1.4 52.6±6.3 103.8±1.9 75.1±5.5 56.2±3.8 67.7±2.0 9.3±3.5 277.8 83.8±6.8-7.6±0.1 18.7±4.7-1.9±1.9 52.9±5.9 16.3±0.8 10.2±0.4 2.6±5.8 55.6 80.0±7.5-5.6±0.4-1.2±1.5 0.4±2.4 0.9±2.8 2.9±0.9-0.1±0.2-0.7±3.3 11.1-5.4±2.2-2.1±1.1 0.2±0.6-2.3±2.4-2.3±2.1 2.4±2.5 2.4±1.1-1.8±1.8 2.2-1.7±2.2-0.9±0.8 0.2±1.8-1.3±2.7 0.3±1.6-4.9±0.5-4.1±4.3-0.5±1.7 38.4±3.4无活性1 324.4±3.8 687.8±15.2 934.3±7.4 1 233.7±9.0 1 034.7±2.2>1 388.9
表3 头状四照花单体化合物的β-羟高铁血红素形成抑制结果(±s,n=3)
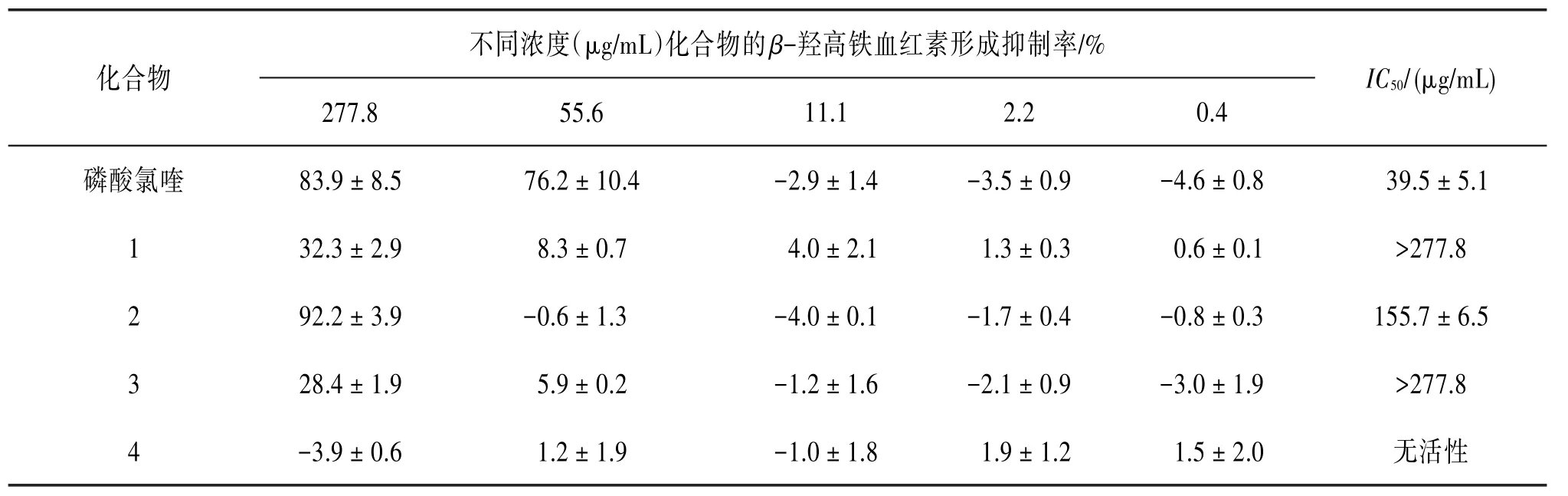
表3 头状四照花单体化合物的β-羟高铁血红素形成抑制结果(±s,n=3)
?
3.2 化合物结构解析化合物1:C15H14O6,淡黄色粉末。1H NMR(400 MHz,CD3OD)δ:6.86(1H,d,J=1.9 Hz,H-2′),6.79(1H,d,J=8.1 Hz,H-5′),6.74(1H,dd,J=8.1,1.9 Hz,H-6′),5.96(1H,d,J=2.3 Hz,H-8),5.88(1H,J=2.3 Hz,H-6),4.59(1H,d,J=7.5 Hz,H-2),4.00(1H,td,J=7.8,5.4Hz,H-3),2.87(1H,dd,J=16.1,5.4Hz,H-4a),2.53(1H,dd,J=16.1,8.1 Hz,H-4b);13C NMR(100 MHz,CD3OD)δ:82.8(C-2),68.8(C-3),28.5(C-4),156.9(C-5),96.2(C-6),157.8(C-7),95.5(C-8),157.5(C-9),100.8(C-10),132.2(C-1′),115.2(C-2′),146.2(C-3′,4′),116.1(C-5′),120.0(C-6′)。上述数据与文献〔6〕报道基本一致,故鉴定化合物1为儿茶素。
化合物2:C15H10O7,黄色针晶(吡啶)。1H NMR(400 MHz,C5D5N)δ:13.24(1H,s,5-OH),8.53(1H,d,J=2.1 Hz,H-2′),8.01(1H,dd,J=8.5,2.1 Hz,H-6′),7.31(1H,d,J=8.5 Hz,H-5′),6.68(1H,d,J=2.0 Hz,H-6),6.64(1H,d,J=2.0 Hz,H-8);13C NMR(100 MHz,C5D5N)δ:149.9(C-2),138.4(C-3),177.8(C-4),162.9(C-5),99.7(C-6),166.0(C-7),94.8(C-8),157.9(C-9),104.9(C-10),124.4(C-1′),117.1(C-2′),148.2(C-3′),147.6(C-4′),117.1(C-5′),121.5(C-6′)。上述数据与文献〔7〕报道基本一致,故鉴定化合物2为槲皮素。
化合物3:C21H20O12,黄色粉末。1HNMR(400 MHz,C5D5N)δ:8.46(1H,d,J=2.1 Hz,H-2′),8.14(1H,dd,J=8.4,2.0 Hz,H-6′),7.27(1H,d,J=8.4 Hz,H-5′),6.70(1H,d,J=2.0 Hz,H-8),6.64(1H,d,J=2.0 Hz,H-6),6.10(1H,d,J=7.8 Hz,H-1″),4.83(1H,dd,J=9.2,7.8 Hz,H-2″),4.62(1H,d,J=3.1 Hz,H-4″),4.44(1H,dd,J=10.9,6.3 Hz,H-6″a),4.34(1H,dd,J=11.2,4.9 Hz,H-6″b),4.31(1H,dd,J=9.2,3.1 Hz,H-3″),4.19(1H,t,J=6.2 Hz,H-5″);13C NMR(100 MHz,C5D5N)δ:157.3(C-2),135.3(C-3),178.6(C-4),162.5(C-5),99.5(C-6),165.7(C-7),94.3(C-8),157.6(C-9),105.2(C-10),122.1(C-1′),116.0(C-2′),146.5(C-3′),150.5(C-4′),117.6(C-5′),122.8(C-6′),104.9(C-1″),73.2(C-2″),75.2(C-3″),69.5(C-4″),77.5(C-5″),61.7(C-6″)。上述数据与文献〔8〕报道基本一致,故鉴定化合物3为异槲皮苷。
化合物4:C30H48O4,白色粉末。1H NMR(400 MHz,CDCl3+CD3OD)δ:5.25(1H,brs,H-12),3.64(1H,ddd,J=11.3,9.5,4.3 Hz,H-2),2.94(1H,d,J=9.5 Hz,H-3),1.12,1.03,1.02,0.84,0.81(各3H,s,5×Me),0.96(3H,d,J=5.4 Hz,Me-30),0.88(3H,d,J=6.6 Hz,Me-29);13C NMR(100 MHz,CDCl3+CD3OD)δ:47.7(C-1),69.2(C-2),84.2(C-3),40.4(C-4),56.3(C-5),19.2(C-6),33.9(C-7),40.2(C-8),48.5(C-9),38.9(C-10),24.2(C-11),126.3(C-12),139.3(C-13),43.0(C-14),28.8(C-15),25.0(C-16),48.7(C-17),53.9(C-18),40.0(C-19),40.0(C-20),31.5(C-21),37.7(C-22),29.2(C-23),17.6(C-24),17.2(C-25),17.5(C-26),24.1(C-27),181.4(C-28),17.3(C-29),21.5(C-30)。上述数据与文献〔9〕报道基本一致,故鉴定化合物4为2α-羟基乌索酸。
4 讨论
文献报道红内期抗疟药可通过与血红素络合而抑制β-羟高铁血红素(疟色素)形成,使疟原虫溶解而起到抗疟疾的效果〔10-11〕;提示血红素为红内期抗疟药物的作用靶点,并可通过抑制β-羟高铁血红素形成的活性大小来评价和筛选抗疟药〔12〕。本研究结果表明头状四照花(D.capitata)具有一定的β-羟高铁血红素形成抑制活性,通过活性追踪从中得到3个黄酮类活性成分。β-羟高铁血红素形成抑制实验结果显示,槲皮素的活性最强,儿茶素和异槲皮苷的活性相当。因条件限制,本研究仅对该植物的β-羟高铁血红素形成抑制活性以及其中的活性化学成分进行了初步探索,更加细致的β-羟高铁血红素形成抑制活性成分与构效关系,有待进一步研究。
本研究利用β-羟高铁血红素形成抑制实验为抗疟体外筛选模型,对药用植物头状四照花进行了相关活性成分追踪,为从滇西地区丰富的植物资源中寻找新型抗疟药提供了新模式,具有一定的学术价值。
[参考文献]
〔1〕中国科学院中国植物志编辑委员会.中国植物志:第56卷〔M〕.北京:科学出版社,1995:100-101.
〔2〕国家中医药管理局《中华本草》编委会.中华本草:第15卷〔M〕.上海:上海科学技术出版社,1999:743-744.
〔3〕NCOKAZI K K,EGAN T J.A colorimetric high-throughput B-hematin inhibition screening assay for use in the search for antimalarial compounds〔J〕.Anal Biochem,2005,338(2):306-319.
〔4〕AGUIAR A C C,SANTOS R D M,FIGUEIREDO F J B,et al.Antimalarial Activity and Mechanisms of Action of Two Novel 4-Aminoquinolines against Chloroquine-Resis⁃tant Parasites〔J〕.PLoS ONE,2012,7(5):e37259.
〔5〕肖朝江,徐伟,刘子琦,等.滇西地区25种药用植物抗疟活性研究〔J〕.中国病原生物学杂志,2014,9(6):542-545.
〔6〕SANG S,LAPSLEY K,ROSEN R T,et al.New prenylated benzoic acid and other constituents from almond hulls(Prunus amygdalus Batsch)〔J〕.J Agric Food Chem,2002,50(3):607-609.
〔7〕王洪玲,梁文娟,朱继孝,等.藏族药西伯利亚蓼化学成分的分离鉴定〔J〕.中国实验方剂学杂志,2017,23(7):60-63.
〔8〕宋丽华,杨胜祥,李跃中,等.金叶子叶化学成分的研究〔J〕.中草药,2009,40(9):1377-1380.
〔9〕CHENG J J ,ZHANG L J,CHENG H L,et al.Cytotoxic Hexacyclic Triterpene Acids from Euscaphis japonica〔J〕.J Nat Prod,2010,73(10):1655-1658.
〔10〕CHONG C R,SULLIVAN D J J.Inhibition of heme crystal growth by antimalarials and other compounds:implica⁃tions for drug discovery〔J〕.Biochem Pharmacol,2003,66(11):2201-2212.
〔11〕FITCH C D,CHEVLI R,KANJANANGGULPAN P,et al.Intracellular ferriprotoporphyrin IX is a lytic agent〔J〕.Blood,1983,62(6):1165-1168.
〔12〕EGAN T J.Haemozoin Formation as a Target for the Ratio⁃nal Design of New Antimalarials〔J〕.Drug Design Re⁃views-Online,2004,1(1):93-110.
