紫娟茶树叶片不同发育期花青素积累及合成相关基因的表达
2018-04-18蒋会兵孙云南李梅戴伟东宋维希田易萍夏丽飞陈林波
蒋会兵,孙云南,李梅,戴伟东,宋维希,田易萍,夏丽飞,陈林波*
紫娟茶树叶片不同发育期花青素积累及合成相关基因的表达
蒋会兵1,孙云南1,李梅1,戴伟东2,宋维希1,田易萍1,夏丽飞1,陈林波1*
1. 云南省农业科学院茶叶研究所,云南省茶树种质资源创新与配套栽培技术工程研究中心,云南省茶学重点实验室,云南 勐海 666201; 2. 中国农业科学院茶叶研究所,浙江 杭州 310008
为明确紫娟茶树(cv. Zijuan)叶片发育中花青素积累特性及合成途径上相关基因的表达特点,利用液质联用法(HPLC-MS)、转录组测序(RNA-Seq)和数字基因表达谱技术(DGE),分析了紫娟茶树芽、第二叶、开面叶和成熟叶4个发育期花青素的种类、含量及合成相关基因的表达水平。结果表明,花青素积累量随叶片发育先增加后减少,第二叶含量最大(9.87 mg·g-1)、成熟叶含量最小(0.11 mg·g-1),与叶色表现相吻合。结构基因在芽、第二叶和开面叶高表达,在成熟叶下调表达;和表达模式相似,表达量均随叶片发育而降低,在芽期高表达,在成熟叶全部下调表达;在第二叶上调表达,在成熟叶下调表达,与花青素积累情况一致;在各发育期均有上调和下调表达。和表达模式相似,在第二叶、开面叶和成熟叶上调表达;和表达模式相似,在芽、第二叶和开面叶高表达,在成熟叶下调表达。和在各发育期均有上调或下调表达。说明紫娟茶树叶片不同发育阶段结构基因和调控基因的表达水平不同,导致花青素积累存在差异,具有一定的时间表达特异性。
茶树品种;花青素;数字表达普;差异表达基因
茶叶因其保健无副作用、消费群体庞大等因素成为世界三大饮料之一。紫娟茶树品种(cv.)的新梢和嫩叶富含大量花青素而呈紫色,是天然食用色素的重要来源,近年在饮料、保健等方面备受关注[1-2]。然而在紫娟茶树叶片在发育过程中呈现出由紫转绿的表型变化,所积累的花青素随着幼叶的发育而变化,导致花青素、儿茶素等内含物质含量降低,从而影响茶叶品质[3-4]。因此,了解紫娟茶树品种芽叶色泽变化的分子机制变得迫切需要。
目前已将基因芯片、高通量测序和蛋白质组分析等技术应用到茶树研究领域,探索了与茶树叶片花青素生物合成相关酶基因(的表达情况,并进行了功能注释[5-7],筛选克隆出茶树转录调控因子[8-9],分析了茶树紫叶与绿叶的差异表达蛋白[10],这为茶树基因组学和代谢组学的研究奠定了基础。茶树叶片花青素的合成、积累和降解随叶片发育而变化,受时间、空间和内外因子的影响,其调控机理目前尚不完全明确[11]。本研究基于实验室前期对紫娟茶树品种转录组测序结果[12],应用数字基因表达谱技术分析了紫娟茶树叶片从顶芽到成熟叶的生长发育过程中花青素合成相关基因表达情况,为揭示茶树叶片花青素合成及性状控制的研究提供参考。
1 材料与方法
1.1 试验材料
实验材料为于云南省农业科学院茶叶研究所品种园采集的紫娟茶树叶片。根据叶片生长发育顺序,将其分为4个发育期:ZJ_1为单个顶芽,色泽紫色;ZJ_2为一芽二叶期的第二叶,色泽深紫色;ZJ_3为芽形成驻芽时期的开面叶片,色泽紫红色;ZJ_4为成熟叶片,色泽深绿色(图1)。2015年10月,采集同一植株各发育期样品,一部分微波固样,做代谢物检测;一部分液氮固样,–80℃冰箱保存,做转录组分析。
1.2 花青素组分及含量分析
参照文献[13]的方法,利用Agilent 1100液相色谱和离子阱质谱联用分别测定各样品的花青素组分和含量。称取0.2 g样品,加10 mL 20%酸性乙醇(含0.1%盐酸),超声波提取(40 kHz,20 min,室温),离心取上清液(8 000 r·min-1,10 min),沉淀物重复2次,合并上清液(30 mL),旋转蒸发(45℃),3%甲醇定容至5 mL,SPE柱净化,复溶(2 mL 0.1%盐酸水溶液),过滤膜(0.45 μm)后测定。每个样品重复3次。流动相A相为0.1%甲酸-水溶液,B相为100%乙腈,进样量5 μL,流速0.3 mL·min-1,柱温40℃,扫描范围(200~650 m/z),干燥气体(N2,12 L·min-1,350℃),喷雾气压(30 psi),毛细管电压(3 500 V)。
1.3 RNA提取与文库构建
选用CTAB-LiC1方法[14]提取各样品的总RNA,2%的琼脂糖凝胶电泳分析RNA降解程度及有无污染,Nanodrop检测RNA纯度,Qubit定量RNA浓度,Agilent 2100检测RNA完整性。cDNA文库构建与测序由北京诺禾致源科技股份有限公司完成,通过Illumina Hiseq 2500的测序平台,得到原始读序(Raw reads),经过滤得到干净读序(Clean reads),利用Trinity软件通过序列之间的重叠信息组装得到重叠群(Contigs),局部组装得到转录本(Transcripts),用Tgicl和Phrap软件对Transcripts进行同源聚类和拼接得到单基因簇(Unigene)。
1.4 差异基因分析
利用Rsem软件的Bowtie2将Trinity拼接得到的转录组作为参考序列(Ref),将每个样品的Clean reads往Ref上绘制Mapping。采用TMM对Read count数据进行标准化处理,利用DEGseq对差异表达基因进行差异表达分析。按照FPKM法计算差异基因的表达量,筛选阈值小于0.005以及|log2Fold change|>1;对于差异基因,如果其log2Fold change>0,认为是上调表达,反之,认为是下调表达。
2 结果与分析
2.1 叶片发育中花青素组分和含量分析
通过HPLC-MS分析,从紫娟茶树叶片不同发育期样品中共检测到7种花青素苷衍生物组分(表1),分别为飞燕草-3--半乳糖苷(D3Ga)、矢车菊素-3--半乳糖苷(C3Ga)、天竺葵-3--葡萄糖苷(P3G)、芍药素(Peon)、天竺葵色素(Pela)、飞燕草-3--(6-香豆酰)-半乳糖苷(DCZGa)和矢车菊素-3--(6-香豆酰)-半乳糖苷(CCZDGa)。其中DCZGa、CCZDGa和C3Ga 3种组分含量在芽、第二叶和开面叶中均较高,成熟叶各组分含量极少或未检出。花青素总量随叶片发育先增加后减少,在第二叶达高峰值,为9.87 mg·g-1,芽和开面叶含量分别为3.03 mg·g-1和3.41 mg·g-1,成熟叶最低,仅有0.11 mg·g-1。第二叶与成熟叶花青素含量相差近90倍,芽和开面叶花青素含量相差不大。可见,紫娟茶树叶片花青素积累量主要来源于DCZGa、CCZDGa和C3Ga,不同发育期花青素含量变化趋势与叶片色泽表现相吻合。
2.2 叶片发育中基因差异表达分析
对紫娟茶树芽、第二叶、开面叶和成熟叶4个时期样品进行转录组测序,共筛选出242 757条基因系列(Unigene),其总长度126.51 Mb、最大长度14 589 bp、平均长度521 bp、N50为637 bp,KEGG富集分析得到284个代谢通路。将相连两个发育期进行比对,即第二叶/芽(ZJ_2 vs ZJ_1)、开面叶/第二叶(ZJ_3 vs ZJ_2)、成熟叶/开面叶(ZJ_4 vs ZJ_3),筛选不同发育期的差异表达基因(图2)。在ZJ_2 vs ZJ_1中获得1 108条差异表达基因,其中上调基因数457条,主要涉及光合作用、氨基酸代谢、脂质代谢、萜类和酮类化合物代谢等128个通路;下调基因数651条,主要涉及核糖体代谢、细胞周期和嘧啶代谢等159个通路。在ZJ_3 vs ZJ_2中获得639条差异表达基因,其中上调基因数321条,主要涉及苯丙素合成、光合作用、氮代谢、葡萄糖醛酸转换和碳代谢等99个通路;下调基因数318条,主要涉及细胞周期、DNA的复制、细胞减数分裂和p53信号等95个通路。在ZJ_4 vs ZJ_3中获得1 889条差异表达基因,其中上调基因数892条,主要涉及光合作用、光合生物固碳、氮代谢和类胡萝卜素生物合成等216个通路;下调基因数997条,主要涉及黄酮类合成、苯丙素生物合成、苯丙氨酸代谢、淀粉与蔗糖代谢、黄酮和黄酮醇生物合成等214个通路。对类黄酮生物合成途径中57条差异表达基因进行NCBI系列比对,被注释为苯丙氨酸解氨酶()、肉桂酸羟化酶()、4-香豆酰CoA连接酶()、查耳酮合成酶()、查耳酮异构酶()、黄烷酮3-羟化酶()、类黄酮3'-羟化酶()、类黄酮3',5'-羟化酶()、黄酮醇合成酶()、二氢黄酮醇-4-还原酶()和花色素合成酶()等11种酶基因。

注:ZJ_1:芽,紫色;ZJ_2:第二叶,深紫色;ZJ_3:开面叶,紫红色;ZJ_4:成熟叶,深绿色。下同。

表1 紫娟茶树叶片不同发育期花青素组分及含量
注:“—”表示未检测到。
Note: “—” indicates not detected.

图2 紫娟茶树叶片不同发育期差异基因的表达情况
2.3 叶片发育中花青素生物合成及调控基因的表达
2.3.1 叶片发育中花青素合成结构基因的表达
对紫娟茶树叶片发育中花青素合成相关基因、、、、、、、、和表达情况分析表明(表2)。基因中共获得17条差异表达基因,其表达量在芽、第二叶和开面叶均有高峰值,在成熟叶均为最低,第二叶5条基因下调表达,开面叶3条基因上调表达,成熟叶全部下调表达。在、、和中共获得18条差异表达基因,其表达量均随叶片发育而减少,在芽期最高,成熟叶最低,表达模式基本一致,第二叶3条基因下调表达,开面叶3条基因下调表达,成熟叶全部下调表达。中获得4条差异表达基因,表达量随叶片发育先增加后减少,在第二叶达高峰值,为上调表达,在成熟叶最低,为下调表达,与花青素积累情况一致。中获得4条差异表达基因,其中1条基因表达量随叶片发育而减少,在第二叶和成熟叶下调表达;3条基因表达量在成熟叶增至最大,为上调表达。中获得3条差异表达基因,表达量随叶片发育而减少,第二叶2条基因下调表达,开面叶1条基因下调表达,成熟叶全部下调表达。可见,与花青素合成相关基因在紫娟茶树叶片发育的4个时期均有表达,其中、、、、、、、、和基因的表达模式相似,在第二叶和开面叶部分基因下调表达,成熟叶全部下调表达,与花青素积累情况基本一致;基因的表达模式无变化规律,在各发育期存在上调或下调表达。
2.3.2 叶片发育中花青素合成修饰基因的表达
对紫娟茶树叶片发育中糖基化转移酶()、酰基化酶()、无色花色素还原酶()及花色素还原酶()相关基因表达检测发现(表3)。类黄酮-3-葡糖基转移酶、花青素3'--β-葡萄糖基转移酶和花青素5,3--葡萄糖基转移酶的表达量随叶片发育逐渐增加,芽期最低、成熟叶最高,在第二叶、开面叶和成熟叶均为上调表达;花青素3--葡萄糖基转移酶和花青素5--葡萄糖基转移酶的表达量随叶片发育先增加后减少,在第二叶上调表达,在开面叶和成熟叶下调表达,与花青素含量变化趋势一致。花青素-5-芳族酰基转移酶的表达量在成熟叶最高,为上调表达。基因表达量随叶片发育而减少,第二叶2条基因下调表达,开面叶2条基因下调表达,成熟叶全部下调表达。基因表达量在芽、第二叶和开面叶高表达,成熟叶急剧降低,为下调表达。可见,紫娟茶树叶片花青素合成修饰途径中基因表达较复杂,其中和在成熟叶下调表达,与花青素积累情况一致,而和在成熟叶上调表达,与花青素积累情况相反。
2.3.3 叶片发育中花青素合成调控基因的表达
对花青素合成相关调控因子蛋白、蛋白和蛋白的表达情况检测发现(表4),在中获得6条差异基因,其中、和基因的表达量随叶片发育而减少,在开面叶和成熟叶下调表达;、和基因的表达量随叶片发育先增加后减少,在第二叶上调表达,成熟叶下调表达。中获得7条差异基因,其中、和基因的表达量随叶片发育而减少,在第二叶、开面叶和成熟叶下调表达;和基因的表达量随叶片发育而增加,在成熟叶上调表达。中获得7条差异基因,其中c中4条基因的表达量随叶片发育而减少,在第二叶、开面叶和成熟叶下调表达;中3条基因在各时期的表达特征无变化规律,在芽、第二叶、开面叶和成熟叶均有上调和下调表达。整体而言,在紫娟茶树叶片花青素合成调控途径中基因和基因在不同发育期的表达特征与花青素含量变化情况基本一致,而基因在各时期均有上调或下调表达,存在与花青素积累情况相同或相反的表达模式。

表2 紫娟茶树叶片不同发育期花青素合成结构基因的表达
注:“up”为上调表达,“down”为下调表达,“—”为差异不显著。
Note: “up” is up regulation expression, “down” is down regulation expression, “—”for the no significant difference.
表3紫娟茶树叶片不同发育期花青素合成修饰基因的表达
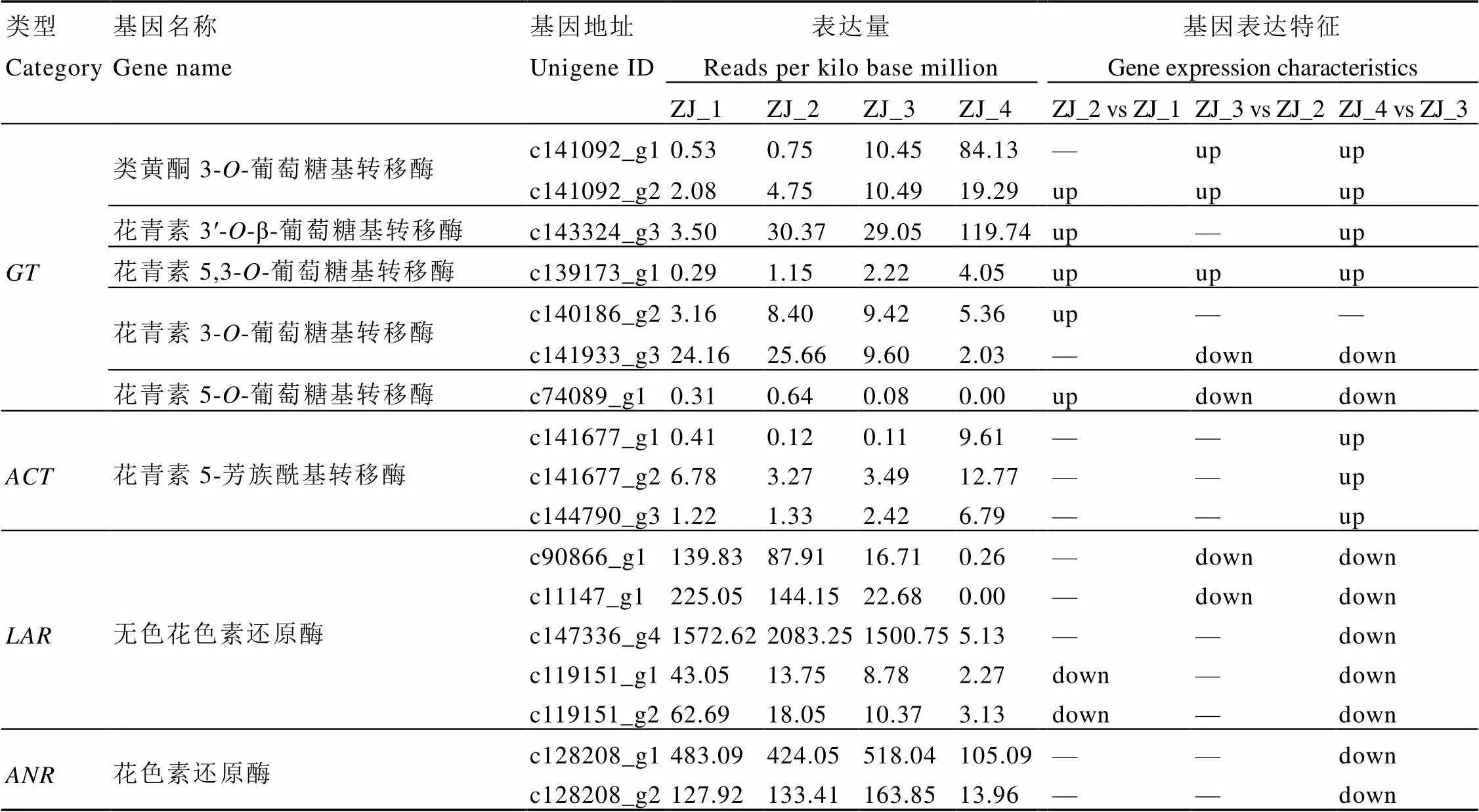
Table 3 The expressions of later biosynthetic genes in different leaf positions in C. sinensis cv. Zijuan
注:“up”为上调表达,“down”为下调表达,“—”为差异不显著。
Note: “up” represents up regulation expression, “down” represents down regulation expression, “—” indicates no significant difference.

表4 紫娟茶树叶片不同发育期花青素合成调控基因的表达
注:“up”为上调表达;“down”为下调表达;“—”为差异不显著。
Note: “up” is up regulation expression;“down” is down regulation expression;“—”for the no significant difference.
3 讨论
本文应用HPLC-MS技术,从紫娟茶树芽、第二叶、开面叶和成熟叶样品中检测出7种花青苷衍生物,花青素主要积累在呈紫色的芽、第二叶和开面叶中,而成熟叶花青素的积累很少,很可能是茶树幼嫩叶片易于花青素合成和积累。不同发育阶段花青素含量变化趋势与叶色表现相吻合,花青素的积累与DCZGa、CCZDGa和C3Ga三种组分密切相关,而与Peon和Pela两种组分关系不大,这与解东超等[15]对紫娟鲜叶花青素含量测定结果基本一致。
前人的研究表明,基因的表达与儿茶素类化合物、花青素的累积呈正相关[16-17]。本研究表明,紫娟茶树叶片发育中基因在芽、第二叶和开面叶高表达,在成熟叶下调表达,与花青素含量变化趋势基本一致,说明基因在紫娟茶树叶片花青素合成中起重要作用。、、、、、和等8个基因在时间上的表达模式相似,均在芽期高表达,第二叶和开面叶少数差异基因下调表达,成熟叶全部下调表达,而HPLC-MS检测结果表明,第二叶花青素苷积累量最大,说明花青素的积累滞后于基因表达一个时期,这与菊花花瓣中花青素苷合成基因表达类似[18],推测在紫娟茶树叶片发育中可能存在基因表达先于花青素苷的合成。整体而言,这些花青素合成酶在呈紫色的芽和第二叶大量表达促进了花青素苷的生物合成,而在呈深绿色的成熟叶完全下调表达使花青素苷的积累量显著降低。注释到中的差异基因的表达量随叶片发育先增加后减少,第二叶达高峰值,为上调表达,成熟叶最低,为下调表达,与花青素积累情况相吻合,说明与黄酮醇和花青素的合成密切相关,由此推测,可能通过底物竞争方式影响花青素苷合成,或生成黄酮醇等助色素改变紫娟茶树叶片的色泽[19-20]。注释到中的差异基因存在两种不同的表达模式,可能分别是途径中的两个分支限速酶[21],其功能有待进一步证实。
本研究表明,花青素3--葡萄糖基转移酶和花青素5--葡萄糖基转移酶在第二叶上调表达,在开面叶和成熟叶下调表达,与花青素积累量情况相吻合,说明这两个基因在花青素的合成修饰途径中起主要作用,可能是决定茶树叶片花青素呈紫色的关键因子[22]。而类黄酮3--葡萄糖基转移酶、花青素3'--β-葡萄糖基转移酶、花青素5,3--葡萄糖基转移酶和花青素5 -芳族酰基转移酶的表达模式与花青素积累情况相反,其修饰功能有待进一步研究。和基因的表达模式相似,在芽、第二叶和开面叶高表达,在成熟叶下调表达,与花青素合成途径中上游结构基因的表达模式基本一致,这可能是因为、分别参与儿茶素和表儿茶素的合成[23-24],推测和在紫娟茶树叶片原花青素的合成中起关键作用。
在紫娟茶树叶片不同发育期,和基因的表达水平与结构基因基本一致,推测可激活结构基因的表达而调控花青素的生物合成[25-26]。和在第二叶高表达,在成熟叶下调表达,与花青素积累情况一致,说明这两个基因可能参与类黄酮合成途径中结构基因的表达,促进花青素的积累[27-28]。和基因在成熟叶上调表达,与花青素积累情况相反,可能抑制花青素和类黄酮的积累[29-30],推测基因可能起正调控和负调控作用。在第二叶、开面叶和成熟叶均为下调表达,与结构基因表达水平基本一致。在各发育期均有上调和下调表达,其作用机制有待进一步研究。
[1] Jiang LH, Shen XJ, Shoji T, et al. Characterization and activity of anthocyanins in Zijuan tea (var. kitamura) [J]. Journal of Agricultural & Food Chemistry, 2013, 61(13): 3306-3310.
[2] 赵瑜, 周家春, 张靖伟, 等. 紫娟茶提取物对血管紧张素转换酶、α-淀粉酶和胰脂肪酶的体外抑制作用[J]. 食品工业科技, 2017, 38(19): 11-20.
[3] 吴华玲, 何玉媚, 李家贤, 等. 11个红紫顶芽茶树新品系的顶芽叶特性和生化成分研究[J]. 植物遗传资源学报, 2012, 13(1): 42-47.
[4] 周琼琼, 孙威江. 茶树顶芽叶紫化的生理生化分析及其关键酶基因的表达[J]. 生物技术通报, 2015, 31(1): 86-91.
[5] 马春雷, 姚明哲, 王新超, 等. 利用基因芯片筛选茶树芽叶紫化相关基因[J]. 茶叶科学, 2011, 31(1): 59-65.
[6] Rani A, Singh K, Ahuja PS, et al. Molecular regulation of catechins biosynthesis in tea [(L.) O. Kuntze] [J]. Gene, 2012, 495(2): 205-210.
[7] 陈林波, 夏丽飞, 孙云南, 等. 特异茶树品种“紫娟”叶色转变的基因表达差异分析[J]. 茶叶科学, 2012, 32(1): 59-65.
[8] 马春雷, 姚明哲, 王新超, 等. 茶树2个MYB转录因子基因的克隆及表达分析[J]. 林业科学, 2012, 48(3): 31-37
[9] 贡年娣, 郭丽丽, 王弘雪, 等. 茶树两个MYB转录因子基因的克隆及功能验证[J]. 茶叶科学, 2014, 34(1): 36-36.
[10] 陈伟, 吕晓杰, 宋晓敏, 等. ‘紫鹃’茶树紫叶和绿叶差异表达蛋白分析[J]. 福建农业学报, 2016, 31(3): 230-235.
[11] 唐秀华, 孙威江, 唐琴. 紫化茶树生理生化及其花青素调控机理研究进展[J]. 天然产物研究与开发, 2017, 29(6): 1077-1083.
[12] 陈林波, 夏丽飞, 周萌, 等. 基于RNA-Seq技术的“紫娟”茶树转绿组分析[J]. 分子植物育种, 2015, 13(10): 2250-2255.
[13] 李智, 王日为, 张丽霞, 等. 茶树紫色芽叶花青苷组分分析及结构推测[J]. 茶叶科学, 2014, 34(3): 279-287.
[14] 史成颖, 宛晓春, 江昌俊, 等. 提取高质量茶树总RNA的方法研究[J]. 安徽农业大学学报, 2007, 34(3): 360-363.
[15] 解东超, 戴伟东, 李朋亮, 等. 基于LC-MS的紫娟烘青绿茶加工过程中花青素变化规律研究[J]. 茶叶科学, 2016, 36(6): 603-612.
[16] Singh K, Kumar S, Rani A, et al. Phenylalanine ammonia-lyase (PAL) and cinnamate 4-hydroxylase (C4H) and catechins (flavan-3-ols) accumulation in tea [J]. Funct Integr Genomic, 2009, 9(1): 125-134.
[17] 周天山, 王新超, 余有本, 等. 紫顶芽茶树类黄酮生物合成关键酶基因表达与总儿茶素、花青素含量相关性分析[J]. 作物学报, 2016, 42(4): 525-531.
[18] 韩科厅, 赵莉, 唐杏姣, 等. 菊花花青素苷合成关键基因表达与花色表型的关系[J]. 园艺学报, 2012, 39(3): 516-524.
[19] Davies KM, Schwinn KE, Deroles SC, et al. Enhancing anthocyanin production by altering competition for substrate between flavonol synthase and dihydroflavonol 4-reductase [J]. Euphytica, 2003, 131(3): 259-268.
[20] Tsuda S, Fukui Y, Nakamura N, et al. Flower color modification of Petunia hybrida commercial varieties by metabolic engineering [J]. Plant Biotechnology, 2004, 21(5): 377-386.
[21] 戴思兰, 洪艳. 基于花青素苷合成和呈色机理的观赏植物花色改良分子育种[J]. 中国农业科学, 2016, 49(3): 529-542.
[22] 王晓帆, 田艳维, 王云生, 等. 茶树类黄酮3-O-葡萄糖基转移酶基因的克隆和表达分析[J]. 茶叶科学, 2012, 32(5): 411-418.
[23] 祝志欣, 鲁迎青. 花青素代谢途径与植物颜色变异[J]. 植物学报, 2016, 9(1): 107-119.
[24] Liao L, Vimolmangkang S, Wei C, et al. Molecular characterization of genes encoding leucoanthocyanidin reductase involved in proanthocyanidin biosynthesis in apple [J]. Frontiers in Plant Science, 2015, 10(6): 234.
[25] Wada T, Kunihiro A, Tominagawada R. Arabidopsis CAPRICE (MYB) and GLABRA3 (bHLH) control tomato () anthocyanin biosynthesis [J]. PLOS ONE, 2014, 9(9): e109093.
[26] Albert NW, Davies KM, Lewis DH, et al. A conserved network of transcriptional activators and repressors regulates anthocyanin pigmentation in eudicots [J]. Plant Cell, 2014, 26(3): 962-980.
[27] Taylor LP, Grotewold E. Flavonoids as developmental regulators [J]. Curr Opin Plant Biol, 2005, 8(3): 317-323.
[28] Verdonk JC, Haring MA, Van-Tunen AJ, et al. ODORANT1 regulates fragrance biosynthesis in petunia flowers [J]. Plant Cell, 2005, 17(5): 1612-1624.
[29] Fornale S, Lopez E, Salazar-Henao JE, et al. AtMYB7, a new player in the regulation of UV-Sunscreens in[J]. Plant Cell Physiology, 2014, 55(3): 507-516.
[30] Jin H, Cominelli E, Bailey P, et al. Transcriptional repression by AtMYB4 controls production of UV-protecting sunscreens in[J]. The Embo Journal, 2000, 19(22): 6150-6161
Anthocyanin Accumulation and Expression of Synthesis-related Genes in Leaves of Different Developmental Stages incv. Zijuan
JIANG Huibing1, SUN Yunnan1, LI Mei1, DAI Weidong2, SONG Weixi1, TIAN Yiping1, XIA Lifei1, CHEN Linbo1*
1. Tea Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Engineering Research Center of Tea Germplasm Innovation and Matching Cultivation, Yunnan Provincial Key Laboratory of Tea Science, Menghai 666201, China; 2. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China
In order to explore the regulatory factors and structural genes of anthocyanin biosynthesis in leaves of different developmental stages incv., anthocyanin contents and compositions were analyzed by high performance liquid chromatography-mass, and the expression of synthesis-related genes were tested by RNA-sequencing and digital gene expression (DGE) profiling technology. HPLC-MS analysis showed that the anthocyanin content was consistent with color changes, increased firstly and then decreased with the leaf positions of Zijuan, with the highest anthocyanin content in the second leaf (9.87 mg·g-1) and the lowest content in mature leaf(0.11 mg·g-1). DGE determination results showed that the expression levels ofgene were relatively high in bud,second leaf and open surface leaf, but low in mature leaf.andshoweda patternof declining expression asin different leaf positions of Zijuan.was firstly up-regulated in the second leaf and then declined in the mature leaf, which was consistent to the anthocyanin changes.showed no clear expression pattern.andexhibited similar expression patterns, which were up-regulated in the second, open surface and mature leaves.andshowed similar expression patterns, which were high in bud, second and open surface leaves, but low in mature leaf. The gene expression of,andshowed different expressionpatterns in different leaf positons of Zijuan. These results suggested that the temporal expression specificitiesof structural and regulatory genes may significantly affect the accumulation of anthocyanin in Zijuan.
tea cultivar,anthocyanin, digital expression patterns, differentially expressed genes
S571.1
A
1000-369X(2018)02-174-09
2017-10-16
2017-12-01
国家自然科学基金(31560220,31460216)、云南省人才培养计划(2015HB105)
蒋会兵,男,副研究员,主要从事茶树种质资源研究。
chenlinbo2002@sina.com
