不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化性的影响
2018-04-12韩雪王毕妮张富新彭海霞邵玉宇
韩雪,王毕妮,张富新,彭海霞,邵玉宇
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
酚酸类化合物具有很强的抗氧化性,在预防心脑血管疾病、癌症、骨质疏松症和神经退行性疾病中发挥着重要作用[1-3]。据报道,红枣的果肉、果皮、果核中都含有丰富的酚酸类化合物[4],且红枣中的酚酸主要是以游离态和结合态两种形式存在,其中游离态酚酸仅占酚酸总量的7.5%,但游离态酚酸的生物利用率远远高于以结合态形式存在的酚酸[5]。因此,红枣中游离态酚酸含量的增加有利于提高红枣中酚酸的生物利用率。
有研究表明,乳酸菌能够将结合态酚酸转化为游离态酚酸,并提高其生物活性[6-7]。这是因为乳酸菌在生长过程中能够产生多种酶类,通过这些酶的转化作用将结合态酚酸分解为游离态酚酸[8]。因此利用乳酸菌发酵来提高红枣中酚酸类化合物的生物利用率及抗氧化性,对开发以红枣为原料的功能性产品具有一定的意义。
关于乳酸菌发酵有利于提高果蔬的抗氧化性已有报道,叶盼研究了植物乳杆菌发酵对苹果汁的理化性质影响及其酚类物质的鉴定[9];靳玉红等研究了红枣乳酸发酵饮料的抗氧化性[10]。国外有将嗜热链球菌和保加利亚乳杆菌作为发酵剂发酵胡萝卜汁制成的酸奶,所含的抗氧化物质的数量高于纯胡萝卜汁[11];植物乳杆菌和嗜酸乳杆菌发酵石榴汁增加了其清除自由基能力,这与游离形式的酚酸增加有关[12]。但目前关于不同乳酸菌发酵对红枣中游离态酚酸含量、组成及抗氧化性影响的研究鲜有报道。
本研究以陕西的狗头枣为原料,选用了5种乳酸菌对其进行发酵,在发酵后第3、6、12、24、48 h取样,根据游离态酚酸总量、DPPH自由基清除力及FRAP抗氧化能力3个指标筛选出最适菌种及最佳发酵时间,并采用GC-MS分析方法对发酵后红枣浆中的酚酸进行分析,目的就是为了探究5种不同乳酸菌发酵过程中,红枣浆中游离态酚酸含量、组成及抗氧化性的变化规律,以期为提高红枣浆中酚酸的生物利用率,开发具有高抗氧化性的发酵红枣保健产品提供参考。
1 材料与方法
1.1 实验材料与仪器
QP-2010Ultra气质联用仪,日本岛津;Rtx-5毛细管色谱柱(0.25 mm×30 m,0.25 μm),美国Agilent公司;721-分光光度计,上海精密仪器仪表有限公司;分析天平,北京赛多利斯电子天平有限公司;立式离心机,张家港轻工设备厂;旋转式蒸发器,上海安亭有限公司;HY-4调速多用振荡器,江苏金坛市国胜实验仪器厂;水浴锅,余姚市东方电子仪器厂;JYL-C93T榨汁搅拌机,九阳股份有限公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂。
陕西狗头枣,购置于超市;嗜热链球菌(Streptococcusthermophiles1.185 5)、嗜酸乳杆菌(Lactobacillusacidophilus1.187 8)、干酪乳杆菌(Lactobacilluscasei1.243 5)、德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.Bulgaricus1.697 0)、植物乳杆菌(Lactobacillusplantarumsubsp.Plantarum1.243 7),购自中国普通微生物菌种保藏管理中心;MRS培养基、琼脂,北京奥博星生物技术有限公司;甘油,天津市福晨化学试剂厂;无水碳酸钠、无水乙酸钠,天津市天力化学试剂有限公司;三氯化铁、冰醋酸(分析纯)、甲醇(色谱纯)、乙酸乙酯(分析纯),上海科密欧公司;水杨酸(≥99%)、4-羟基苯甲酸(≥99%)、香草酸(≥97%)、2,5-二羟基苯甲酸(≥98%)、原儿茶酸(≥97%)、对香豆酸(≥97%)、(双三甲基硅烷基)三氟乙酰胺(含1%的三甲基氯硅烷)(BSTFA,含1%TMCS)、福林酚试剂、2,4,6-三吡啶基三嗪(TPTZ≥99%)、1,1-二苯基-2-三硝基苯肼(DPPH≥98%),美国Sigma公司。
1.2 乳酸菌的活化与保存
将5种乳酸菌分别在MRS肉汤培养基中进行活化,活化后的乳酸菌按照(菌种)∶体积分数(30%甘油)=1∶1的体积比例保存至冻存管中,置于-20 ℃冰箱保存,用时再用MRS培养基进行活化或直接使用。
1.3 红枣浆乳酸菌发酵培养[13]
将红枣清洗干净后去核,加水(1∶4,w/v)打浆,灭菌冷却后,置于无菌操作台上,吸取1 mL活化后的乳酸菌(菌浓度:108~109CFU/mL),6 000 r/min,离心10 min,加入1 mL灭菌的生理盐水,混匀后接入灭菌的红枣浆中,于37℃下培养,分别在发酵后第3、6、12、24、48 h取样,空白不加菌液,各一式3份。
1.4 游离态酚酸的提取
参考韩国民[14]的方法,略有改动。用与红枣浆等体积的乙酸乙酯萃取,再在6 000 r/min条件下离心10 min,重复萃取4次后,合并上清液,在45 ℃下真空浓缩,用甲醇定容至10 mL,分装至离心管中冻存以备用。
1.5 游离态酚酸含量的测定
采用Folin-Ciocalteu比色法[15]。准确移取待测液0.5 mL,分别加入体积分数10%Folin酚试剂3 mL,混匀,再加入质量分数10%的Na2CO3溶液1.5 mL,然后用蒸馏水定容至10 mL,混合均匀,75 ℃水浴锅中避光反应10 min。冷却至室温,以蒸馏水为空白,于760 nm处测定吸光值,结果以每克红枣中含有相当没食子酸的毫克数表示(mg/g)。
1.6 FRAP抗氧化能力的测定[16]
取适待测液0.5 mL,加入3.0 mL TPTZ工作液(由300 mmol/L pH 3.6的醋酸盐缓冲液25 mL,10 mmol/L TPTZ溶液2.5 mL,20 mmol/L FeCl3溶液2.5 mL组成),加蒸馏水定容至10 mL,混匀后37 ℃反应10 min,在593 nm处测定其吸光值,以1.0 mmol/L FeSO4为标准,样品抗氧化活性以达到同样吸光值所需 FeSO4的浓度(μmol/L)表示,定义为FRAP值。
1.7 DPPH自由基清除能力的测定[17]
取待测液0.5 mL,加入浓度为50 mg/L的DPPH无水乙醇溶液4 mL,用蒸馏水定容至10 mL,充分混匀,在室温下避光静置30 min,然后于波长为517 nm的可见光分光光度计下测定其吸光值为A1,然后再测定4 mL质量浓度为50 mg/L的DPPH无水乙醇溶液加0.5 mL甲醇定容至10 mL,测吸光值A0。
DPPH自由基清除率/%=(1-A1/A0)×100
式中A1为样品组的吸光值;A0为对照组的吸光值。
1.8 酚酸类物质组成及含量测定[18]
1.8.1气相-质谱条件
气相色谱条件:Rtx-5毛细管色谱柱(0.25 mm×30 mm,0.25 μm);分流比20∶1;载气为高纯度氦气,流速为1.0 mL/min;接口温度250 ℃,进样口温度280 ℃;进样量为1 μL。色谱柱升温程序:初始柱温为100 ℃,以10 ℃/min升至200 ℃,然后再以5 ℃/min上升到250 ℃,保持5 min,总共运行时间为25 min。
质谱条件:离子源EI;电离能量70 eV,倍增器电压350 V;离子源温度200 ℃;四极杆温度150 ℃;扫描质量范围为33~500 m/z,扫描速度0.5 s/次。
1.8.2样品的衍生化处理
取待测液1 mL,用氮气吹干,加入0.5 mL [BSTFA(99%)+TMCS(1%)],在35 ℃下反应30 min。
1.8.3混合标准溶液的配制
分别称取各种酚酸标品0.010 g,配制成0.1 g/L的各标准酚酸储备液。再对各标准酚酸储备液进行不同程度的稀释,分别配制为不同浓度的各标准酚酸溶液以待用。按照1.9的色谱条件进行检测,所得色谱图见图1,将不同浓度的酚酸标准溶液按照上述色谱条件制作标准曲线,相关系数均达到0.995以上,标准品回收试验回收率均达到93%以上,可以满足定量分析的要求。

1-水杨酸;2-4-羟基苯甲酸;3-香草酸;4-原儿茶酸;5-对香豆酸图1 五种酚酸混合标准溶液的色谱图Fig.1 The chromatogram of a mixture of five phenolic acids
1.9 数据统计与分析
所有数据均为3次试验的平均值,误差均为对应的标准偏差;利用Excel 2016对数据进行图表绘制;利用DPS 9.50对数据进行分析,采用Duncan多元回归方法分析0.05水平上均值的显著性差异。
2 结果与分析
2.1 乳酸菌发酵对红枣浆中游离态酚酸总量的影响
从图2可以看出,嗜酸乳杆菌和嗜热链球菌在发酵前期(0~6 h),红枣浆中的游离态酚酸总量逐渐上升,在第6 h达到最大值,此时红枣浆中游离态酚酸总量分别增加了14.8%和37.9%,但在第12~48 h游离态酚酸总量显著下降(p<0.05);干酪乳杆菌发酵后红枣浆中的游离态酚酸总量随着发酵时间的延长呈现先上升后下降的趋势,其游离态酚酸总量在第6 h达到最高,但与其他4种乳酸菌相比其上升幅度最小;德氏乳杆菌发酵前12 h,红枣浆的游离态酚酸总量没有显著变化(p>0.05),但在第24 h上升至未发酵前的1.3倍左右,随后显著下降;对于植物乳杆菌来说,发酵前24 h红枣浆的游离态酚酸总量显著上升(p<0.05),在第24 h达到最大值,此时游离态酚酸总量是未发酵前的1.4倍左右,随后显著下降。从本实验结果可以看出,5种乳酸菌发酵均能不同程度地提高红枣浆的游离态酚酸总量,但其最佳发酵时间并不相同,其中植物乳杆菌提高红枣浆中游离态酚酸总量的能力明显优于其他菌种。红枣中富含丰富的酚酸,而且这些酚酸多以结合态的形式存在[5]。目前已有研究证明,乳酸菌能够将结合态酚酸释放出来,成为游离态酚酸[6]。本研究所使用的5种乳酸菌均为发酵食品中最常使用的菌种,这些菌种在发酵过程中产生多种酶,从而引起与酚酸结合的糖苷及酯等物质的裂解与酸化,进而释放出与其结合的酚酸[19]。赖婷[13]等利用7种不同乳酸菌(植物乳杆菌、嗜酸乳杆菌、戊糖片球菌、明串珠菌、保加利亚乳杆菌、德氏乳杆菌保加利亚亚种和干酪乳杆菌)发酵桂圆肉,发现桂圆肉中的游离态酚含量显著增加,增加幅度为0.4%~11.9%,其中植物乳杆菌提高桂圆肉中游离态酚含量的能力最强,与本实验结果一致,但其未对发酵时间的影响进行研究。

图2 不同乳酸菌发酵对红枣浆游离态酚酸总量的影响Fig.2 Effects of five different lactic acid bacteriafermentation on the content of total free phenol acid injujube pulb注:柱状图中不同字母表示具有显著差异(p<0.05)
2.2 乳酸菌发酵对红枣浆中游离态酚酸含量及组成的影响
目前枣果中被检出的酚酸有11种,包括6种羟基肉桂酸型酚酸(咖啡酸、对香豆酸、阿魏酸、肉桂酸、绿原酸、芥子酸)、4种苯甲酸型酚酸(没食子酸、原儿茶酸、对羟基苯甲酸、香草酸)以及鞣花酸[20],本研究通过GC-MS鉴定了发酵后红枣浆中的酚酸组成,结果见图3。共检测到了5种酚酸成分,通过采集到的质谱图与NIST14 标准谱库及标准品中各种酚酸的保留时间对照进行定性,鉴定出这5种酚酸分别为水杨酸、4-羟基苯甲酸、香草酸、原儿茶酸和对香豆酸。
由表1可以看出,经嗜酸乳杆菌发酵后,红枣浆中除对香豆酸含量降低以外,水杨酸、4-羟基苯甲酸、香草酸、原儿茶酸含量均显著增加(p<0.05),与未发酵前相比增加了35.9%~132.4%;嗜热链球菌发酵后,红枣浆中的水杨酸、4-羟基苯甲酸含量呈现先下降后上升的趋势,在发酵第48 h分别增加了29.2%和64.7%,而香草酸、原儿茶酸含量则分别减少了1.7%和5.9%,对香豆酸含量在发酵6 h后下降为0;干酪乳杆菌发酵后红枣浆中水杨酸、4-羟基苯甲酸、香草酸和原儿茶酸含量显著增加(p<0.05),其最大增加幅度为42.5%~153%,但对香豆酸含量则显著下降;德氏乳杆菌发酵后,5种酚酸的含量均呈现上升趋势,其中原儿茶酸与对香豆酸含量增加最多,其最大增加量为94.1%和41.2%;植物乳杆菌发酵后,红枣浆中5种酚酸均显著增加(p<0.05),其中水杨酸与香草酸含量增加最多,其最大增加量为85%和73%。王子浩等利用乳酸菌发酵普洱茶,结果表明在乳酸菌发酵后表儿茶素含量增加至原来的3倍左右[21];TIJANAM[19]等研究表明,植物乳杆菌发酵豇豆后,游离态槲皮素由 0 μg/100 g DW 增加到(2 202±400)μg/100 g DW。其原因可能是在于乳酸菌发酵过程中产生的酶将连接酚酸与糖或蛋白的酯键打开,结合态的酚酸被释放,形成游离态[22]。本研究表明,红枣浆在发酵过程中,酚酸的组成及含量都有变化,并且与发酵的菌种和发酵时间都有关系,其具体的原因将在后续研究中进行详细深入的研究。

A-发酵前;B-植物乳杆菌发酵24 h1-水杨酸;2-4-羟基苯甲酸;3-香草酸;4-原儿茶酸;5-对香豆酸图3 植物乳杆菌发酵前后红枣浆中5种酚酸的色谱图Fig.3 Chromatograms of five phenolic acids in jujube pulp before and after fermentation of Lactobacillus plantarum
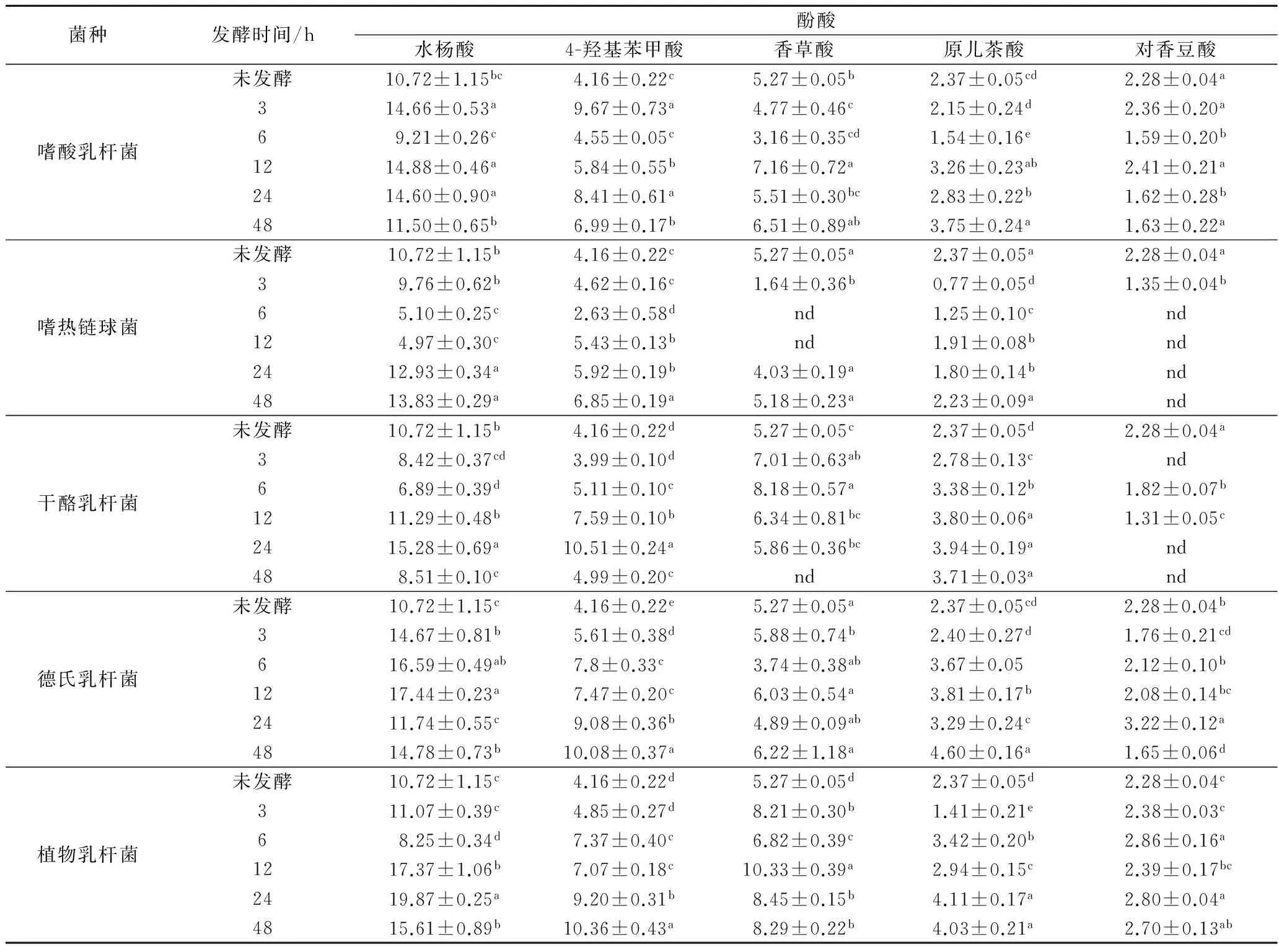
表1 不同乳酸菌发酵对红枣浆中游离态酚酸含量及组成的影响单位:mg/kg
注:表中同列不同字母表示具有显著差异(p<0.05);nd代表未检出。
2.3 乳酸菌发酵对红枣浆中游离态酚酸抗氧化性的影响
2.3.1FRAP抗氧化能力
本研究采用FRAP抗氧化能力方法作为第一种抗氧化评价方法,结果如图4所示。从图4可以看出,植物乳杆菌和嗜热链球菌发酵后,红枣浆中游离态酚酸的FRAP抗氧化能力显著增强(p<0.05),而嗜酸乳杆菌、干酪乳杆菌以及德氏乳杆菌发酵后对提高红枣浆中游离态酚酸的FRAP抗氧化能力效果不显著。嗜热链球菌发酵后红枣浆中游离态酚酸的FRAP值呈现先上升后下降的趋势,在发酵6 h后达到最高,与未发酵前相比提高了19.8%;植物乳杆菌在发酵后0~24 h期间,红枣浆中游离态酚酸的FRAP值逐渐升高,这可能是因为红枣中的结合态酚在乳酸菌产生的酶的作用下分解使得游离态酚含量增加引起的[19];在发酵后24~48 h期间,FRAP值逐渐降低,可能是由于在微生物的作用下,红枣中的酚类物质的组分及含量一直处于动态变化中所致[23]。其中植物乳杆菌提高红枣浆中游离态酚酸FRAP值的能力最强,其FRAP值在发酵后24 h达到最大值,与发酵前相比增加了53.8%。

图4 不同乳酸菌发酵对红枣浆中游离态酚酸FRAP抗氧化能力的影响Fig.4 Effects of five different lactic acid bacteriafermentation on the antioxidant capacity of free phenolacid in jujube pulb by FRAP assay注:柱状图中不同字母表示具有显著差异(p<0.05)
2.3.2DPPH自由基清除力
本研究采用DPPH方法作为第二种抗氧化评价方法,结果如图5所示。由图5可知,经5种乳酸菌发酵后,红枣浆中游离态酚酸的DPPH自由基清除率均显著增加(p<0.05),并且都随着发酵时间的延长而增加。这可能是乳酸菌在发酵时,产生某些酚酸酯酶(如阿魏酸酯酶[24])水解一些结合酚,释放果蔬中的游离酚,并且释放大量的有机酸,防止酚类物质的降解,从而提高了其清除自由基的能力。嗜酸乳杆菌与嗜热链球菌在发酵24 h后,红枣浆中游离态酚酸的DPPH自由基清除率达到最大值,与发酵前相比分别提高了76.4%和73.7%;干酪乳杆菌、德氏乳杆菌发酵48 h后红枣浆中游离态酚酸的DPPH自由基清除率达到最大值,与发酵前相比分别提高了82.7%、76.2%;其中植物乳杆菌提高红枣浆中游离态酚酸的DPPH自由基清除率的能力最高,其DPPH自由基清除率在发酵24 h后是未发酵前的2.4倍左右。KUSZNIEREWICZ[27]等的研究表明,乳酸菌发酵能够提高卷心菜的DPPH自由基清除能力,这与本实验结果一致。

图5 不同乳酸菌发酵对红枣浆中游离态酚酸DPPH自由基清除力的影响Fig.5 Effects of five different lactic acid bacteriafermentation on the DPPH radical scavenging capacitiesof free phenol in jujube pulb注:柱状图中不同字母表示具有显著差异(p<0.05)
2.4 相关性分析
不同酚类物质对于抗氧化性的影响是不同的[25],楚文靖等研究了紫甘薯酒中的酚酸类物质,发现紫甘薯酒的抗氧化性和花色苷、总酚的含量高度相关。其中,绿原酸和芥子酸与紫甘薯酒抗氧化性有较高的相关性,而阿魏酸、咖啡酸、对羟基苯甲酸与抗氧化性相关性较小,甚至没有相关性[26]。为进一步确定红枣浆中酚酸与其抗氧化活性之间的关系,对发酵后红枣浆中的5种酚酸与DPPH自由基清除能力与FRAP抗氧化能力进行相关性分析,其相关系数与p值见表2。由表2可见,发酵后红枣浆的DPPH自由基清除能力与水杨酸含量呈显著正相关(R2=0.87,p<0.05),与4-羟基苯甲酸含量呈极显著正相关(R2=0.89,p<0.01),说明发酵后红枣浆中的水杨酸与4-羟基苯甲酸对其DPPH自由基清除力有很大的贡献。此外,发酵后红枣浆的FRAP抗氧化能力与4-羟基苯甲酸和对香豆酸含量呈显著正相关(R2≥0.76,p<0.05),说明发酵后红枣浆的FRAP抗氧化能力与红枣中4-羟基苯甲酸和对香豆酸有关。

表2 酚酸含量与其抗氧化性的相关性分析Table 2 Correlation analysis of phenolic acid andantioxidant activity
注:相关系数R2;*p<0. 05,**p<0. 01。
3 结论
本研究结果表明,5种乳酸菌发酵均能不同程度提高红枣浆中游离态酚酸含量及其抗氧化性,并且对红枣浆中酚酸的组成及含量产生影响。不同乳酸菌及发酵时间对红枣浆中游离态酚酸含量及抗氧化性的影响存在显著差异,其中,植物乳杆菌提高红枣浆中游离态酚酸含量及其抗氧化性的能力明显优于其他菌种,并且结合游离态酚总量、DPPH自由基清除力、FRAP抗氧化能力这3个指标确定其最佳的发酵时间为24 h。因此,采用植物乳杆菌发酵24 h后的红枣浆具有很高的抗氧化性,可以开发成一种营养品或功能性食品加以利用。
[1]ZHANG X X, ZHANG S, HUANG X Y, et al. Anti-lipoperoxidation of several organic polyphenol acidsinvitro[J]. Natural Product Research & Development, 2014, 26(3): 398-402.
[2]KHURANA S, VENKATARAMAN K, HOLLINGSWO-RTH A, et al. Polyphenols: benefits to the cardiovascular system in health and in aging[J]. Nutrients, 2013, 5(10): 3 779-3 827.
[3]ZHAO H X, ZHANG H S, YANG S F. Phenolic compounds and its antioxidant activities in ethanolic extracts from seven cultivars of Chinese jujube[J]. Food Science & Human Wellness, 2014, 3(3-4): 183-190.
[4]王毕妮, 曹炜, 樊明涛, 等. 红枣不同部位的抗氧化活性[J]. 食品与发酵工业, 2011, 37(6): 126-129.
[5]WANG B N, LIU H F, ZHENG J B, et al. Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J]. Journal of Agricultural & Food Chemistry, 2011, 59(4): 1 288-1 292.
[6]R T, F S-P, M M, et al. Effect of grape polyphenols on lactic acid bacteria and bifidobacteria growth: resistance and metabolism[J]. Food Microbiology, 2011, 28(7): 1 345-1 352.
[7]KUSZNIEREWICZ B, A, BARTOSZEK A, et al. The effect of heating and fermenting on antioxidant properties of white cabbage[J]. Food Chemistry, 2008, 108(3): 853-861.
[8]杨艳, 杨荣玲, 邹宇晓, 等. 肠道微生物菌群生物转化天然多酚类化合物研究进展[J]. 食品科学, 2014, 35(17): 319-325.
[9]叶盼. 植物乳杆菌发酵苹果汁的生理活性探究[D]. 上海:华东理工大学, 2016.
[10]靳玉红, 李志西, 乔艳霞, 等. 红枣乳酸发酵饮料的抗氧化活性[J]. 西北农林科技大学学报(自然科学版), 2016, 44(1): 199-205.
[11]ELABASY A E, ABOUGHARBIA H A, MOUSA H M, et al. Mixes of carrot juice and some fermented dairy products: potentiality as novel functional beverages[J]. Food & Nutrition Sciences, 2012, 3(2): 233-239.
[12]MOUSAVI Z E, MOUSAVI S M, RAZAVI S H, et al. Effect of fermentation of pomegranate juice byLactobacillusplantarumandLactobacillusacidophiluson the antioxidant activity and metabolism of sagars organic acids and phenolic compounds[J]. Food Biotechnology, 2013,27(1):1-13.
[13]赖婷, 刘磊, 张名位, 等. 不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J]. 中国农业科学, 2016, 49(10): 1 979-1 989.
[14]韩国民, 陈锋, 侯敏, 等. 葡萄酒中14种单体酚的高效液相色谱测定[J]. 食品科学, 2011, 32(2): 180-183.
[15]HINNEBURG I, DORMAN H J D, HILTUNEN R. Antioxidant activities of extracts from selected culinary herbs and spices[J]. Food Chemistry, 2006, 97(1): 122-129.
[16]BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[17]ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: Their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36.
[18]GRÜN C H, VAN DORSTEN F A, JACOBS D M, et al. GC-MS methods for metabolic profiling of microbial fermentation products of dietary polyphenols in human andinvitrointervention studies[J]. Journal of Chromatography B, 2008, 871(2): 212-219.
[19]TIJANAM , SLAVICAS, SUZANAI D. Effect of fermentation on antioxidant properties of some cereals and pseudo cereals[J]. Food Chemistry, 2010, 119(3): 957-963.
[20]丁胜华, 王蓉蓉, 吴继红, 等. 枣果实中生物活性成分与生物活性的研究进展[J]. 现代食品科技, 2016, 32(5): 332-348,321.
[21]王子浩, 秦廷发, 张可, 等. 外源添加乳酸菌发酵对云南普洱茶特征成分的影响[J]. 云南农业大学学报, 2014, 29(6): 867-872.
[22]KATINA K, LAITILA A, JUVONEN R, et al. Bran fermentation as a means to enhance technological properties and bioactivity of rye[J]. Food Microbiology, 2007, 24(2): 175-186.
[23]王行, 张海宁, 马永昆, 等. 蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J]. 现代食品科技, 2015, 31(1): 90-95.

[25]WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural & Food Chemistry, 2007, 55(22): 8 896-8 907.
[26]楚文靖. 紫甘薯酒的加工和抗氧化活性研究[D]. 南宁:广西大学, 2008.
