一株毛色二孢菌发酵产茉莉酸
2018-04-12董文华郑璞陈鹏程赵路平
董文华,郑璞,陈鹏程,赵路平
(江南大学 生物工程学院,工业生物技术教育部重点实验室, 江苏 无锡,214122)
茉莉酸(化学名称3-氧-2-2′-顺-戊烯基-环戊烷-1-乙酸,分子式C12H18O3)是一种新型的植物激素。它普遍存在于植物的花、茎、叶、根等组织、器官中,在植物的生长发育过程中发挥着重要的作用[1];它可作为第二信号,当植物受到生物与非生物的伤害时诱导激活植物体内的防御基因,抵御外界的伤害[2]。在农业生产中,可以代替部分杀虫剂,并可用于提高植物的抗旱性[3]。在香料业的生产中,茉莉酸及其甲酯因具有清淡、幽雅的香味可作为很多香花精油主香的成分,应用于香烟、肥皂、口香糖等的生产中[4]。
DEMOLE最先从素馨花中发现并提取到茉莉酸类似物[6],但在植物中茉莉酸的含量低(10-9~10-6g/g),满足不了当今市场的需求。化学合成法存在反应收率不高(30%以下),反应条件苛刻,合成的产物具有外消旋的缺陷,限制了其使用的范围[7-9]。因此,微生物发酵生产茉莉酸受到人们的关注。ALDRIDGE等[10]最早在可可毛色二孢菌(Lasiodiplodiatheobroma)的培养液中,分离到茉莉酸。此外,MIERSCH等[11-12]发现突变的藤仓赤霉菌(Gibberellafujikuroi)在添加了对氯苯氧乙酸钠后的发酵培养液中,也能检测到茉莉酸类化合物。这些发现使得用微生物发酵茉莉酸成为可能。美国国际香精香料公司的FARBOOD和BLOCKER等[13]研究了棉色二孢菌(Diplodiagossypina)发酵产茉莉酸及茉莉酸甲酯的方法,并且比较了不同发酵培养基、发酵条件对该类菌产茉莉酸的影响,其中D.gossypinaATCC 10936产茉莉酸质量浓度可达1.2 g/L。印度萨达尔帕特尔大学通过优化L.theobromae发酵培养基的成分,在最佳的培养条件下,L.theobromaeMTCC 3068最高产茉莉酸为225.3 mg/L[5]。国内韩晓敏等[14]研究可可毛色二孢菌对白木香产生倍半萜的诱导作用时,在可可毛色二孢菌的培养液中检测到茉莉酸类化合物,将它们甲酯化后,质量浓度为250.55 mg/L。目前国内尚未见茉莉酸发酵方面的研究报道。
本文从实验室保藏和自然界分离收集的121株霉菌中,筛选到1株高产茉莉酸的霉菌,对其进行了菌种鉴定和发酵条件的研究,为微生物发酵法生产茉莉酸提供参考。
1 材料与方法
1.1 材料
1.1.1菌种
LasiodiplodiairanensisDWH-2保藏在中国典型培养物保藏中心,保藏号CCTCC NO:M2017288,从腐烂的玉蕊根中筛选得到。
1.1.2主要试剂
茉莉酸标准品购买于一飞生物科技有限公司;甲醇、乙腈,色谱纯;磷酸、盐酸,分析纯。以上试剂及实验所用培养基成分均来自于国药集团化学试剂有限公司。大豆油购于中粮集团。薄层层析硅胶板GF254购于青岛海洋化工厂分厂。
1.1.3培养基
斜面培养基(g/L):土豆200,葡萄糖20,琼脂20,自然pH。
初始发酵培养基(g/L):蔗糖50,NaNO37.5,KH2PO42.0,KCl 0.3,MgSO4·7H2O 6,FeSO4· 7H2O 0.6,酵母膏1,麦芽提取物2,微量元素10ml/L pH 5.5。
微量元素:ZnSO4· 7H2O 0.03 g/L,MnSO4·7H2O 0.003 g/L,CuSO4· 7H2O 0.003 g/L,Na2MoO4·2H2O 0.003 g/L。
优化后发酵培养基(g/L):蔗糖50,NaNO34.5,KH2PO42.0,KCl 0.4,MgSO4·7H2O 6,FeSO4·7H2O 0.9,玉米浆1.5,大豆油10,微量元素10 ml/L pH 5.5。
1.1.4主要仪器与设备
SW-CJ-IFD超净工作台,苏州净化设备有限公司;LDZX-75KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;Quanta-200扫描电子显微镜,荷兰FEI公司;高效液相色谱仪,美国Waters公司;ZD-2雷磁自动滴定仪,上海仪电科技有限公司;SHIMADZU GCMS-QP2010 气相色谱-质谱联用仪,岛津企业管理(中国)有限公司。
1.2 实验方法
1.2.1产茉莉酸菌株的筛选
在PDA平板上活化实验室保存的霉菌,并将其接入发酵培养基中,28 ℃培养6 d后,取处理好的发酵上清液,用薄层层析(thin layer chromatography, TLC)方法进行初步的定性分析。收集果蔬、植物等的腐烂部位,每份筛菌材料经过相同的处理之后稀释涂布于PDA抗性平板上(100 mg/L的氯霉素),28 ℃培养4 d,观察菌落形态,挑出单菌落,培养后将其接于发酵培养基中,28 ℃培养6 d后,取发酵上清液,处理后通过TLC方法进行初步的定性分析。
1.2.2种子培养
斜面种子接于PDA平板上,在28 ℃下培养。
1.2.3发酵培养基碳源的确定
按1.2.2的种子培养方法,分别以等碳摩尔数的蔗糖、乳糖、淀粉、麦芽糖、葡萄糖、果糖为唯一碳源,根据菌株生长及产物质量浓度确定最合适的碳源后,设置25、50、75、100、125、150 g/L的碳源质量浓度梯度,确定碳源的最适质量浓度。
1.2.4发酵培养基无机氮源的确定
按1.2.2的种子培养方法及1.2.3确定的碳源,分别以等氮摩尔数的NaNO3、脲素、NH4NO3、NH4Cl、(NH4)2SO4为唯一无机氮源,根据菌株生长及产物质量浓度确定最合适的无机氮源后,设置3、4.5、6、7.5、9、10.5 g/L的无机氮源质量浓度梯度,确定无机氮源的最适质量浓度。
1.2.5发酵培养基有机氮源的确定
按1.2.2的种子培养方法及1.2.3确定的碳源、1.2.4确定的无机氮源,将牛肉膏、蛋白胨、玉米浆、酵母膏、麦芽提取物分别以2 g/L的添加量作为唯一的有机氮源加入发酵培养基中,且以初始培养基中同时添加酵母膏、麦芽提取物为对照组, 根据菌株生长及产物质量浓度确定最合适的有机氮源后,设置1、1.5、2、2.5、3 g/L的有机氮质量浓度梯度,确定有机氮源的最适质量浓度。
1.2.6发酵培养基无机盐及微量元素的确定
按1.2.2的种子培养方法及1.2.3确定的碳源、1.2.4确定的无机氮源、1.2.5确定的有机氮源,通过正交实验考察KH2PO4、KCl、MgSO4·7H2O、FeSO4·7H2O以及微量元素浓度对菌体生长以及产物质量浓度的影响。
1.2.7发酵培养基初始pH的确定
在以上培养基成分优化的基础上,按1.2.2的种子培养方法,设置发酵的初始pH为4.5、5.5、6.5、7.5、8.5,发酵7 d。
1.2.8装液量的确定
在以上培养基成分优化的基础上,按1.2.2的种子培养方法、1.2.7确定的最适初始pH,设置500 mL摇瓶的装液量为50、100、150、200、250 mL,发酵7 d。
1.2.9发酵温度的确定
在以上培养基成分优化的基础上,按1.2.2的种子培养方法、1.2.7确定的最适初始pH、1.2.8确定的最适装液量,设置培养温度分别为20、25、28、30、35、40 ℃,发酵7 d。
1.2.10大豆油添加量的确定
在以上培养基成分及培养条件优化的基础上,按1.2.2的种子培养方法设置大豆油的浓度为1、5、10、15、20 g/L五个质量浓度梯度,发酵7 d,根据菌株生长及产物质量浓度确定最合适的大豆油添加量。
1.2.11发酵罐上的初步扩大培养
在以上培养基成分及培养条件优化的基础上,在3 L的发酵罐中装液量1.5 L,发酵12 d,测定茉莉酸的含量。
1.3 分析方法
1.3.1TLC检测方法
取适量的发酵液与茉莉酸标样一起点于硅胶板上,将点好的薄层板放在展缸中,待展开剂前沿跑到板长的2/3处时将其取出,晾干,喷洒显色剂,加热一段时间,观察是否有与标样一样的红色斑点出现。
展开剂V(正己烷)∶V(乙酸乙酯)∶V(醋酸)=60∶40∶1
显色剂V(浓硫酸)∶V(甲醇)=1∶1
1.3.2HPLC检测方法
取适量发酵液12 000 r/min离心15 min,取上清液与等体积的甲醇混合后过膜,通过HPLC检测。
色谱条件,色谱柱:Amethyst C18-H(4.6 mm×250 mm,5 μm)反相色谱柱,检测波长210 nm,柱温35 ℃,流动相为V(甲醇)∶V(0.1%磷酸)=11∶9,进样量为20 μL,流速1 mL/min。
1.3.3GC-MS检测
气质条件:色谱柱(DB-5 ms,30.0 m×0.25 mm×0.25 μm),初始温度60 ℃,保持时间0.6 min,终温度为280 ℃。柱箱温度60 ℃,进样口温度270 ℃,进样方式不分流,离子源温度200 ℃,接口温度280 ℃。
1.3.4生物量的测定
发酵结束后,取出菌体放于已称重的烘干滤纸上,于70 ℃真空干燥箱中烘至恒重,以恒重减去滤纸重即得菌体的质量。
1.4 菌种鉴定
1.4.1菌株DWH-2电镜方法
挑取适量的生长旺盛的菌体,用5%戊二醛进行前固定,0.1 mol/L磷酸缓冲液漂洗;1%锇酸进行后固定,0.1 mol/L磷酸缓冲液漂洗;后用乙醇梯度脱水,在临界点干燥后将样品粘贴于样品台,离子溅射仪镀膜后置于扫描电子显微镜下观察。
1.4.2菌株DWH-2 ITS鉴定方法
菌株基因组DNA用Ezup柱式真菌基因组抽提试剂盒进行提取,ITS区域的扩增选择真核生物ITS的通用扩增引物:
ITS1 5’ -TCCGTAGGTGAACCTGCGG-3’
ITS4 5’ -TCCTCCGCTTATTGATATGC-3’
PCR反应体系:
Template(基因组 DNA20-50 ng/μL)0.5 μL
10×Buffer(with Mg2+)2.5 μL
dNTP(各2.5 mmol/L)1.0 μL
Taq聚合酶0.2 μL
上游引物0.5 μL
下游引物0.5 μL
加双蒸水至25 μL
PCR循环条件为94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。
PCR扩增产物经1%琼脂糖凝胶电泳检测后,进行测序。
2 结果与讨论
2.1 产茉莉酸菌株的筛选及其产物鉴定
按1.2.1的筛选方法,将得到的121株菌发酵后用TLC方法分析发酵上清液,得到3株疑似产茉莉酸的菌株,TLC图谱如图1所示。对这3株菌进行复筛,用GC-MS对发酵液中的产物鉴定,证实它们的发酵液中存在茉莉酸,如图2所示,经HPLC测定,DWH-2合成茉莉酸的量最多,质量浓度达到320 mg/L。
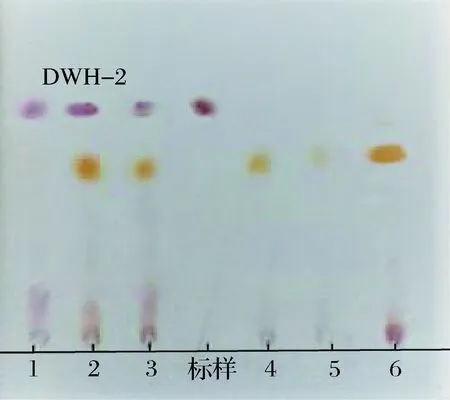
图1 部分菌株发酵液TLC图谱Fig.1 TLC patterns of some strains

a-发酵液产物GC分析;b-茉莉酸MS分析图2 菌株DWH-2发酵液GC-MS定性分析Fig.2 GC-MS analysis of fermentation broth of DWH-2
2.2 高产菌DWH-2的鉴定
DWH-2形态特征:DWH-2在PDA平板上生长时,菌落的正面为白色,绒毛状,菌丝疏松,呈蔓延生长状态(培养初期背面为白色,4 d后变为绿色,最后为黑色)。在透射电镜下观察到该菌的分生孢子呈卵圆形或椭圆形,平均长度均小于25 μm,表面光滑,具有纵条纹。
ITS鉴定:真核生物rDNA的ITS区段既具有保守性又在科、属、种水平上具有差异性,常用其来鉴定真核微生物。将生长旺盛的DWH-2送至上海生工进行ITS测序,得到了大小为519 bp的序列。在NCBI中检索与该菌株序列相似性较高的菌株,结果表明DWH-2与GenBank数据库中二孢属的多株菌同源性高达98%~100%。下载了同源性较高的菌株序列进行比对,发现DWH-2与菌株LasiodiplodiairanensisisolateCMW25232亲缘关系最近,并将其命名为LasiodiplodiairanensisDWH-2。以菌株DWH-2的ITS序列为基础构建的进化树如图4所示。
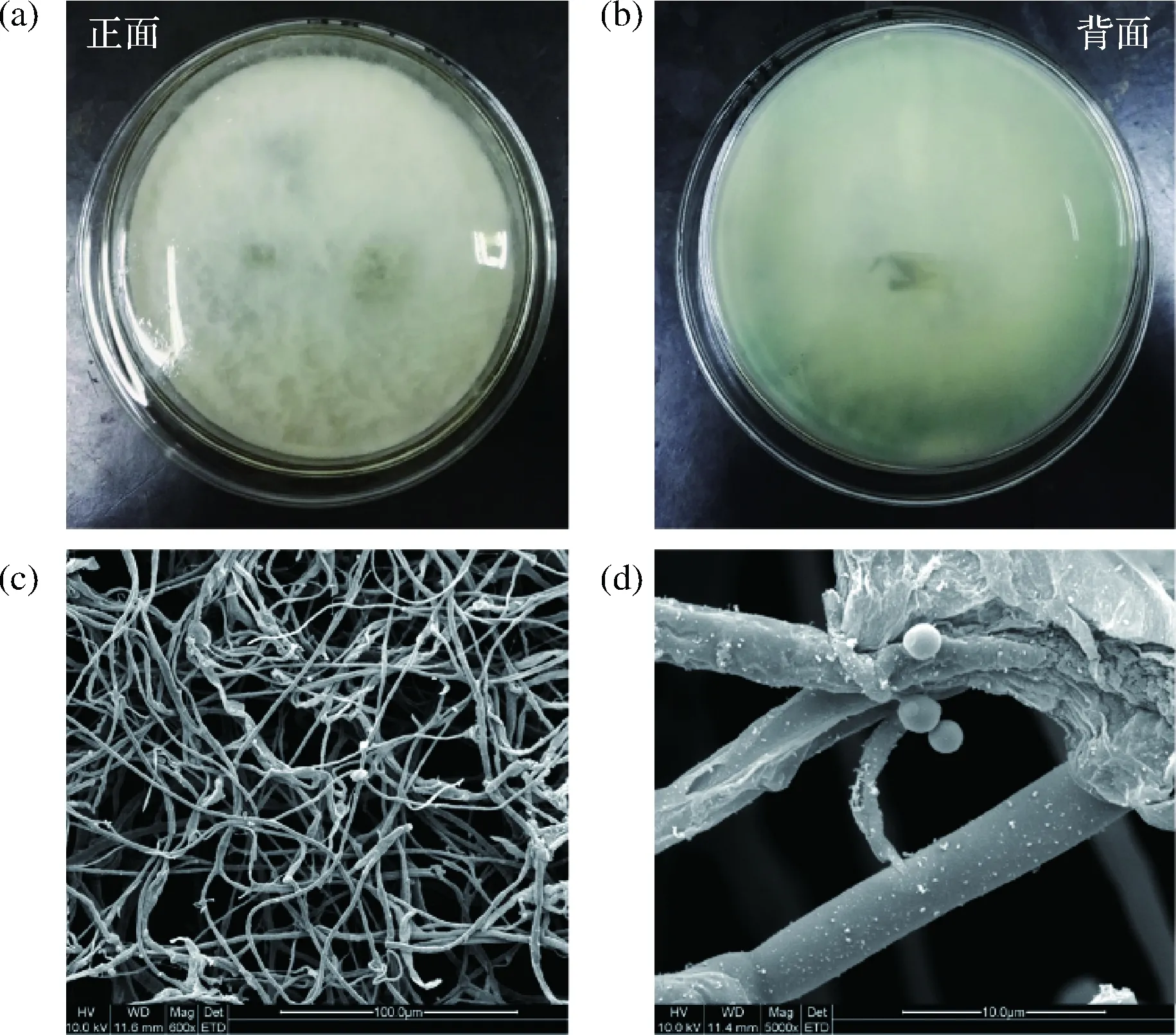
a,b-DWH-2在平板上生长的正面与背面;c,d-DWH-2电镜图图3 菌株DWH-2形态学鉴定Fig.3 Morphological identification of strain DWH-2
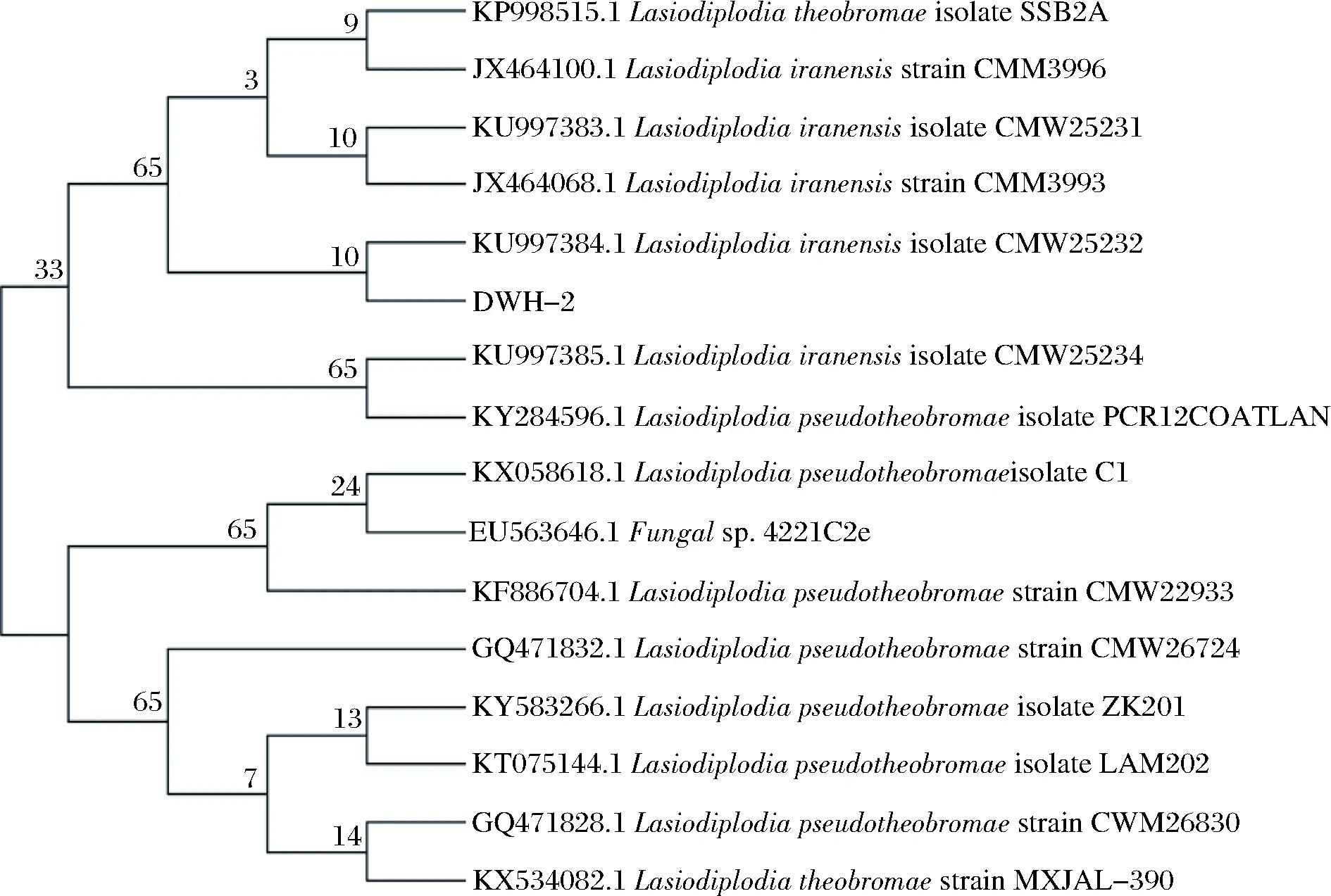
图4 基于菌株DWH-2的ITS序列构建的系统进化树Fig.4 Phylogenetic tree of strain DWH-2 based onITS sequences
2.3 发酵培养基碳源的确定
在以蔗糖、麦芽糖、葡萄糖为唯一碳源时,菌体的生物量均可达17 g/L左右,但是以蔗糖为碳源时产物质量浓度要明显高于其他碳源,达到了342 mg/L,如图5所示,所以选择蔗糖为最适碳源;确定蔗糖的最适质量浓度实验结果如图6所示,在发酵过程中,随着蔗糖含量的增加,菌体的生物量也在增加,但产物的质量浓度却在蔗糖质量浓度为50 g/L时达到最高值,为437 mg/L,所以产物的产生不需要很高的糖含量,故采用50 g/L为蔗糖的最佳质量浓度。
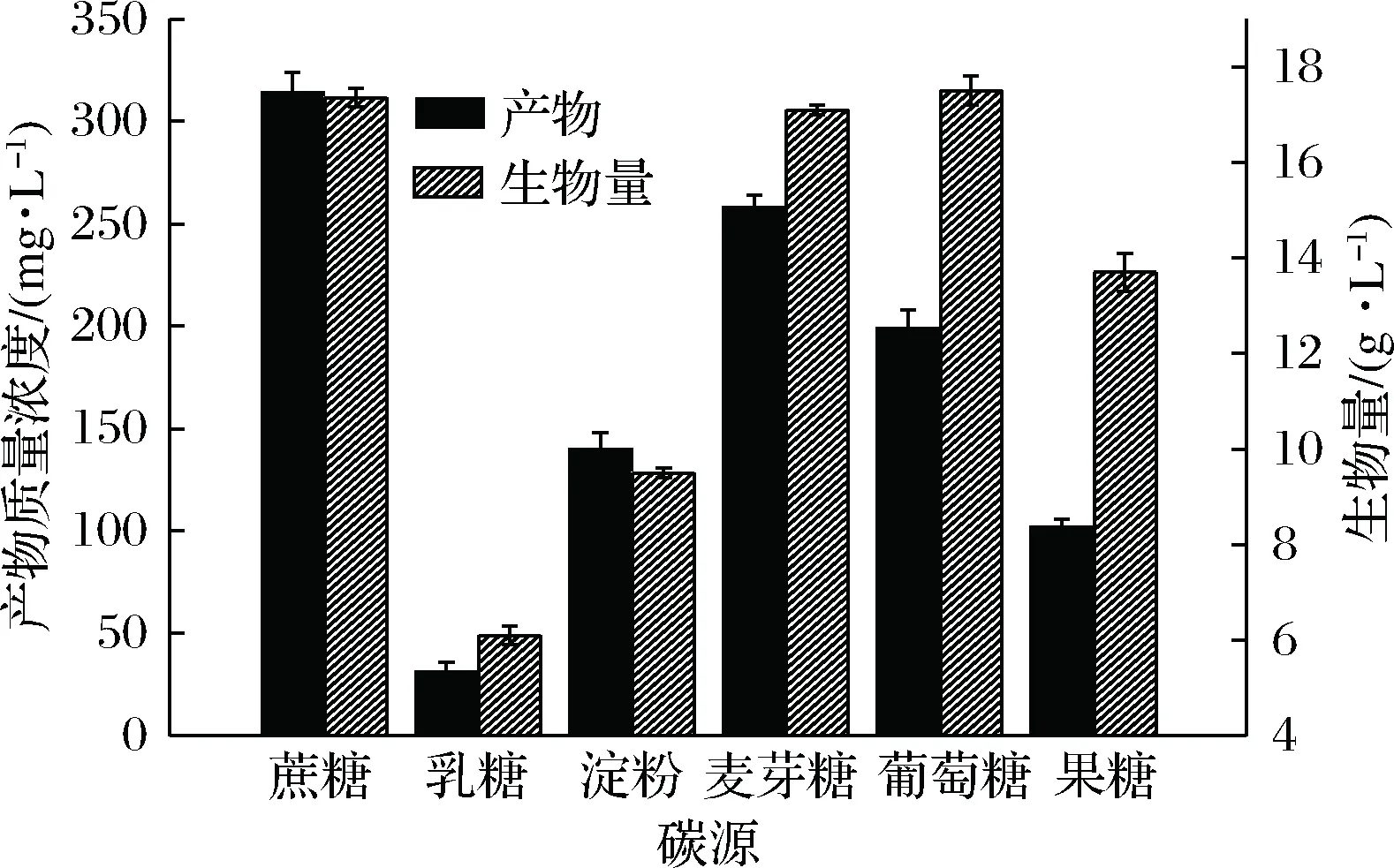
图5 不同碳源对菌株生长及产物质量浓度的影响Fig.5 Effects of different carbon sources on cellgrowth and product concentration
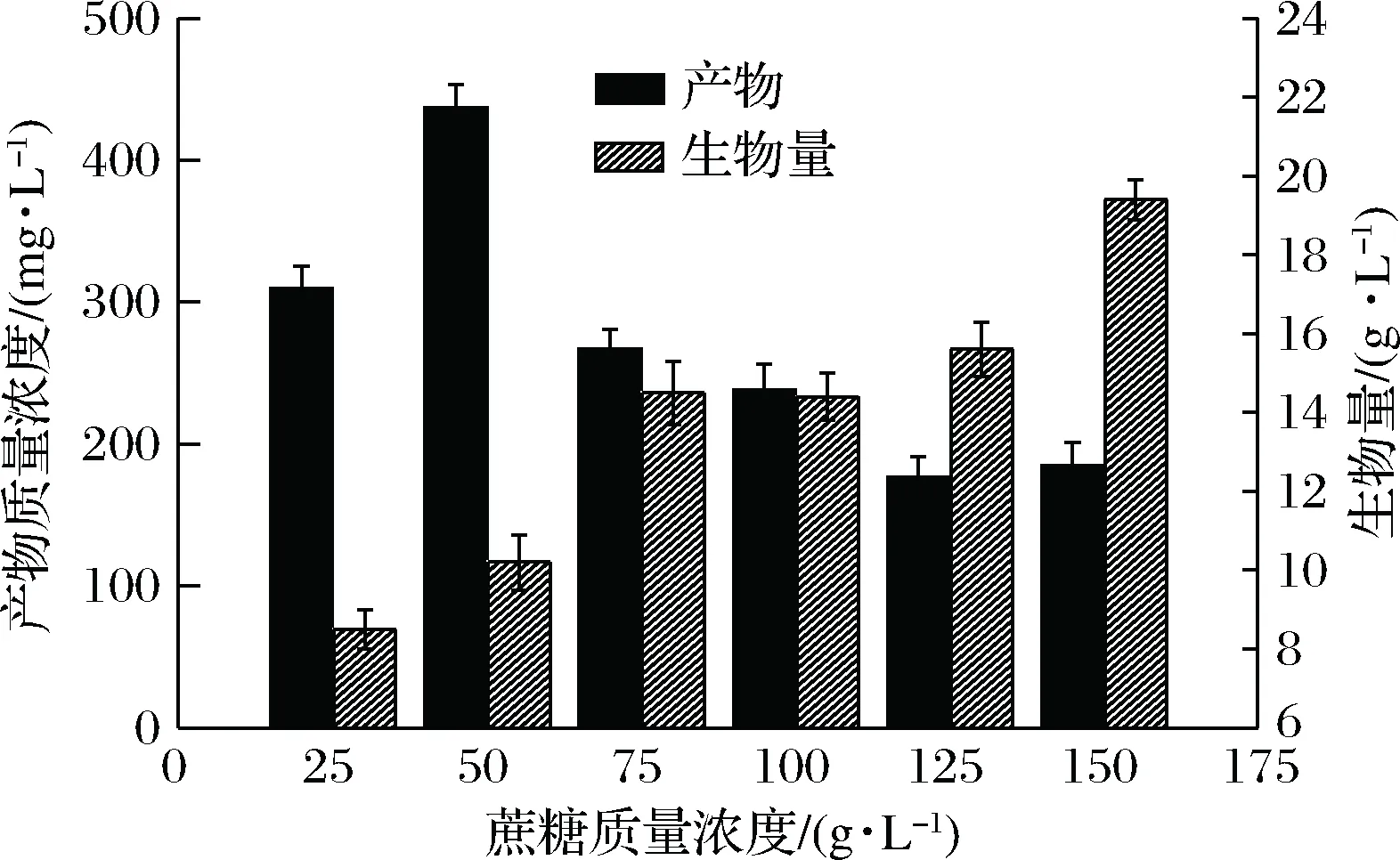
图6 蔗糖浓度对菌株生长及产物浓度的影响Fig.6 Effects of sucrose concentration on cellgrowth and product concentration
2.4 发酵培养基无机氮源的确定
在以硝酸钠为唯一无机氮源时,不论是产物质量浓度还是菌体的生物量都明显高于其他的无机氮源,故选择硝酸钠为最适的无机氮源(图7);为了考察硝酸钠的最适质量浓度,设置了6个质量浓度梯度,结果如图8所示,随着硝酸钠质量浓度的增加菌体的生物量也呈现不断增加的趋势,说明硝酸钠对菌体的生长有显著的影响,但是产物的质量浓度却呈现与之相反的趋势,先增加后减少。在硝酸钠质量浓度为4.5 g/L时,产物质量浓度最高,达到688 mg/L,故选用4.5 g/L作为硝酸钠的最适质量浓度。

图7 不同无机氮源对菌株生长及产物浓度的影响Fig.7 Effects of different inorganic nitrogen sourceson cell growth and product concentration

图8 硝酸钠质量浓度对菌株生长及产物的影响Fig.8 Effects of sodium nitrate concentration oncell growth and product concentration
2.5 发酵培养基有机氮源的确定
以对照组为参照,以玉米浆为唯一的有机氮源时,产物质量浓度是最高的,为700 mg/L,如图9所示,此时的生物量为13.9 g/L略低于对照组的15.3 g/L,综合考虑选择玉米浆做为唯一的有机氮源;为了确定最适的玉米浆添加量,设置了5个梯度,结果如图10。从图10可以看出,玉米浆质量浓度对菌体的生物量有一定的影响,但对产物质量浓度没有明显的影响,在1~3 g/L的范围内产物质量浓度基本保持在680~715 mg/L之间,但在1.5 g/L时,产物质量浓度最高为715 mg/L,故选择1.5 g/L为最适的有玉米浆质量浓度。
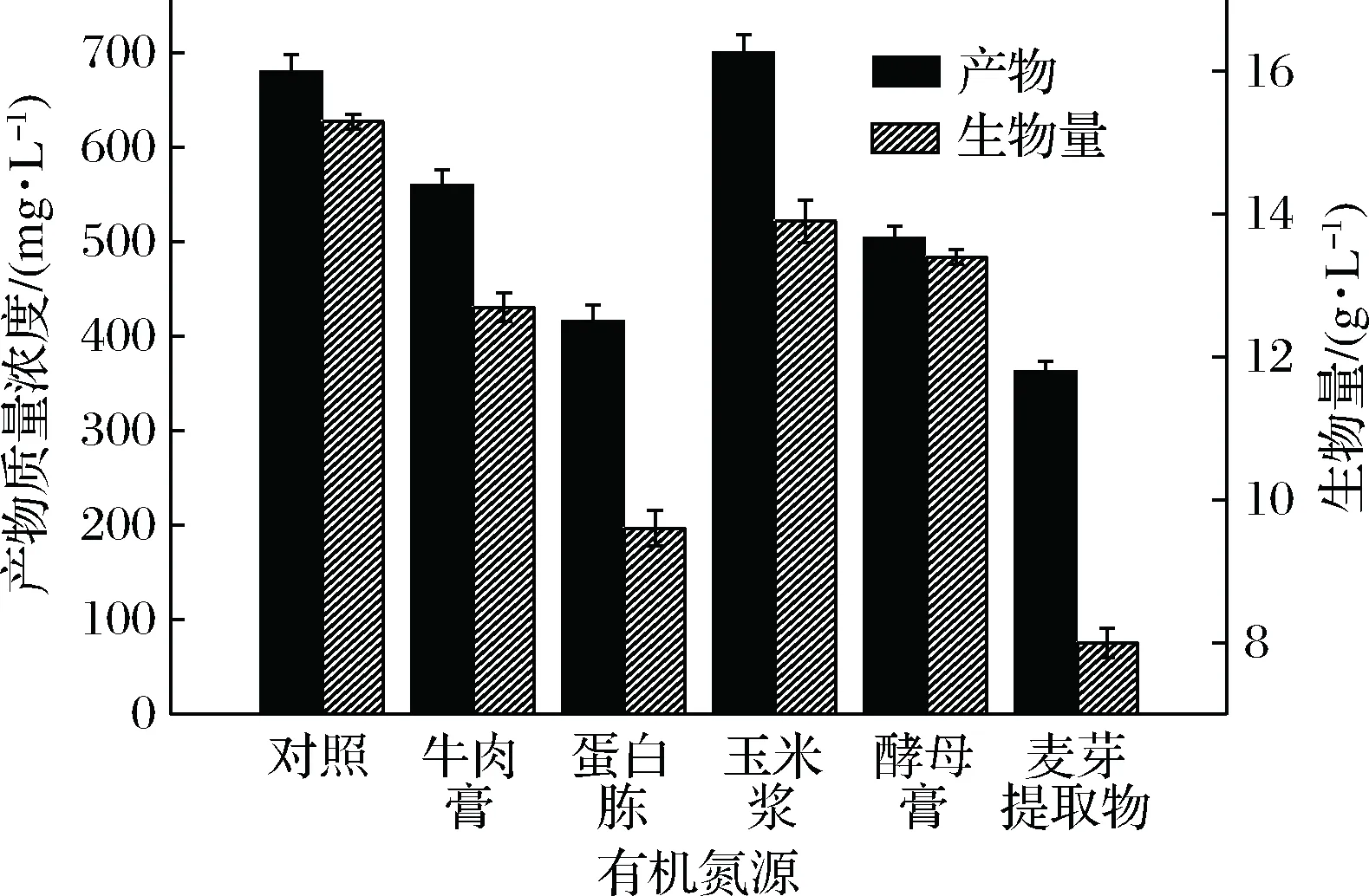
图9 有机氮源对菌体及产物质量浓度的影响Fig.9 Effects of organic nitrogen on cellgrowth and product concentration
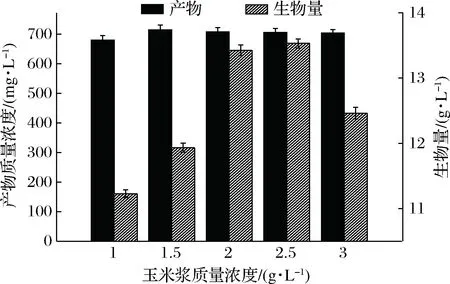
图10 玉米浆质量浓度对菌体及产物浓度的影响Fig.10 Effects of corn syrup concentration oncell growth and product concentration
2.6 发酵培养基无机盐及微量元素的确定
本实验通过设计正交实验考察了KH2PO4、KCl、MgSO4·7H2O、FeSO4·7H2O以及微量元素对茉莉酸合成及菌体的影响,设计了5因素4水平的正交实验L16(45),实验设计如表1,实验结果如表2。
微量元素配方:FeSO4·7H2O 0.6 g/L;ZnSO4·7H2O 0.03 g/L;MnSO4·7H2O 0.003 g/L;CuSO4·7H2O 0.003 g/L;二水合钼酸钠0.003 g/L。
从实验结果来看,MgSO4·7H2O、FeSO4·7H2O是最显著的2个影响因素,以茉莉酸的产量为标准,得到的无机盐的最优组合为:KH2PO42 g/L、KCl 0.4 g/L、MgSO4·7H2O 6 g/L、FeSO4·7H2O 0.9 g/L、微量元素10 mL/L。
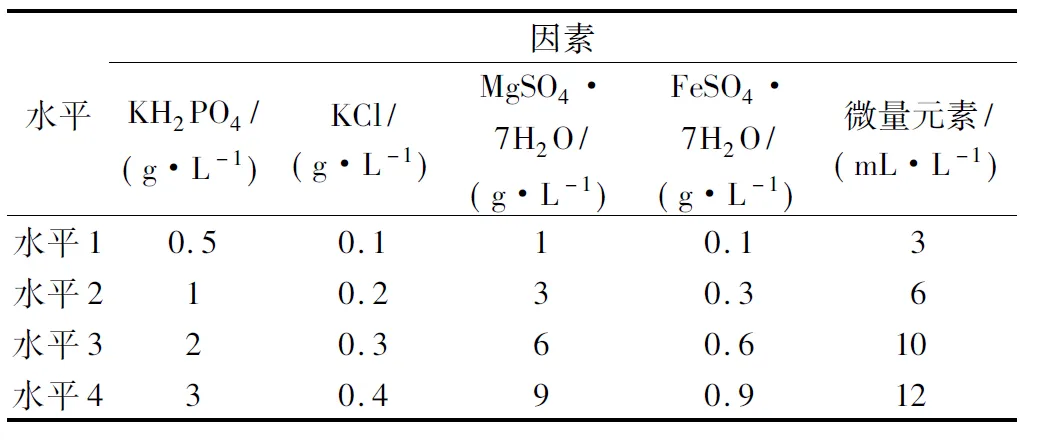
表1 不同元素水平Table 1 Levels of different elements

表2 无机盐及微量元素正交表Table 2 Inorganic salts and trace elements orthogonal table
2.7 发酵初始pH对菌株产茉莉酸的影响
发酵液的pH在发酵过程中随菌体生长情况的变化而变化,从而影响代谢产物的分泌。从图11可以看出在发酵过程中,随着pH的升高,菌体的生物量及产物浓度都呈现一个先增加后降低的趋势,在pH为4.5的时候,有产物的产生,但菌体的生物量偏低,在pH为5.5时,产物浓度及菌体量都达到了最高值,故确定发酵初始pH为5.5。

图11 初始pH对菌体及产物质量浓度的影响Fig.11 Effect of initial pH on cell growth and productconcentration
2.8 装液量对菌株产茉莉酸的影响
绝大多数微生物在生长过程中是需要氧的,发酵过程中装液量的多少直接影响发酵液中所溶解氧的浓度,进而影响菌体的生长及代谢产物的分泌。由图12可知,当装液量为50 mL/500 mL时,菌体的生物量达到最大值为17.5 g/L,随着装液量的增加菌体生物量在减少而产物浓度却先增加后减少,说明该菌的生长是需要氧的,但产物的产生却不需要太多的氧。装液量为100 mL/500 mL时产物浓度达到最大,故选择100 mL/500 mL为最佳装液量。
2.9 发酵温度的确定
温度对菌体生长及代谢产物的分泌有重要的影响,温度的高低会影响菌体所产酶的活性从而影响次级代谢产物的产生。如图13所示,该菌株的最适生长温度为25~30 ℃,高于30 ℃菌体几乎不生长。且产物产生的最适温度与菌体生长的最适温度基本保持一致,在28 ℃时,产物浓度达762 mg/L,故选28 ℃为最适的发酵温度。
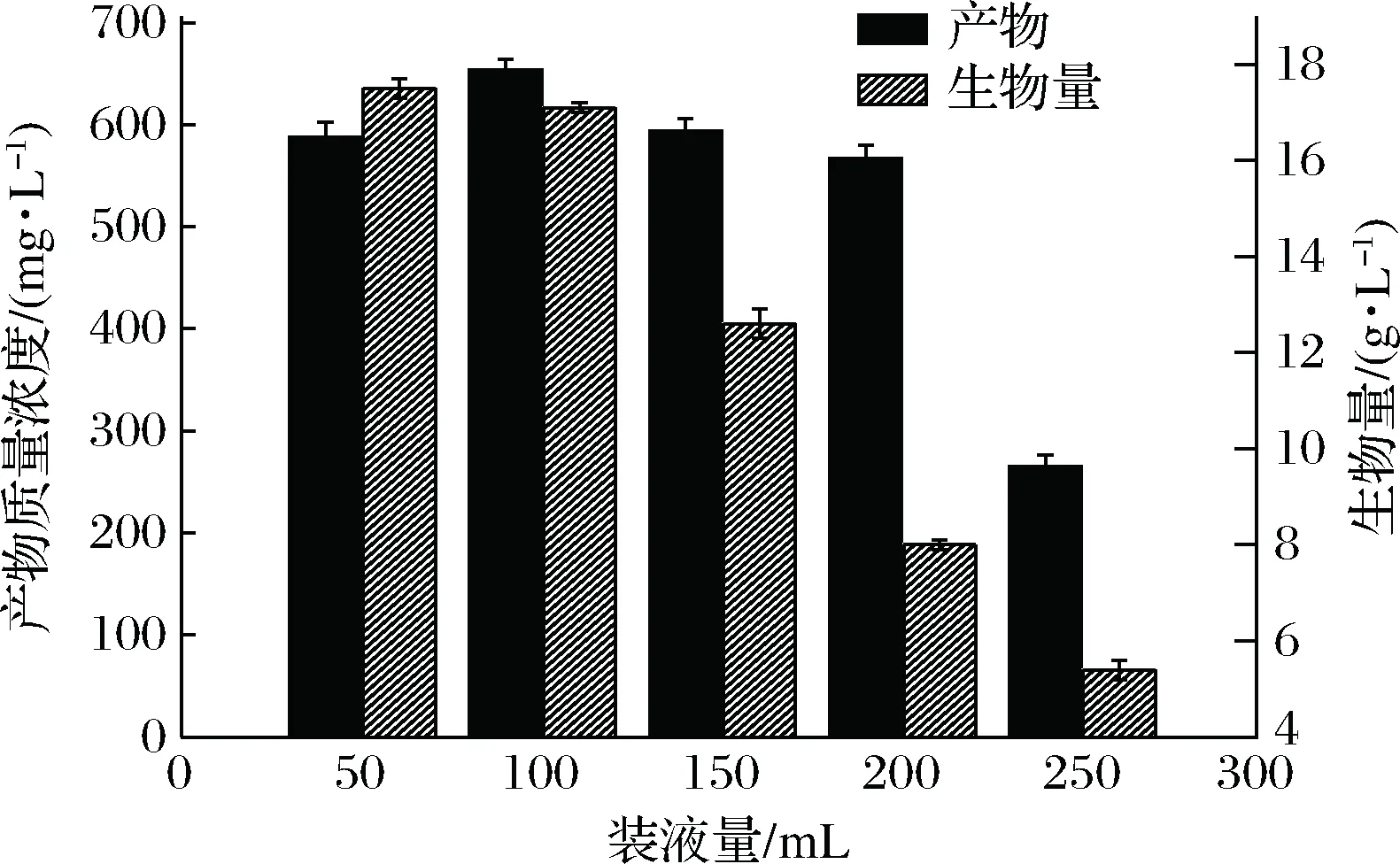
图12 装液量对菌体及产物浓度的影响Fig.12 Effect of liquid volume on cell growth and productconcentration
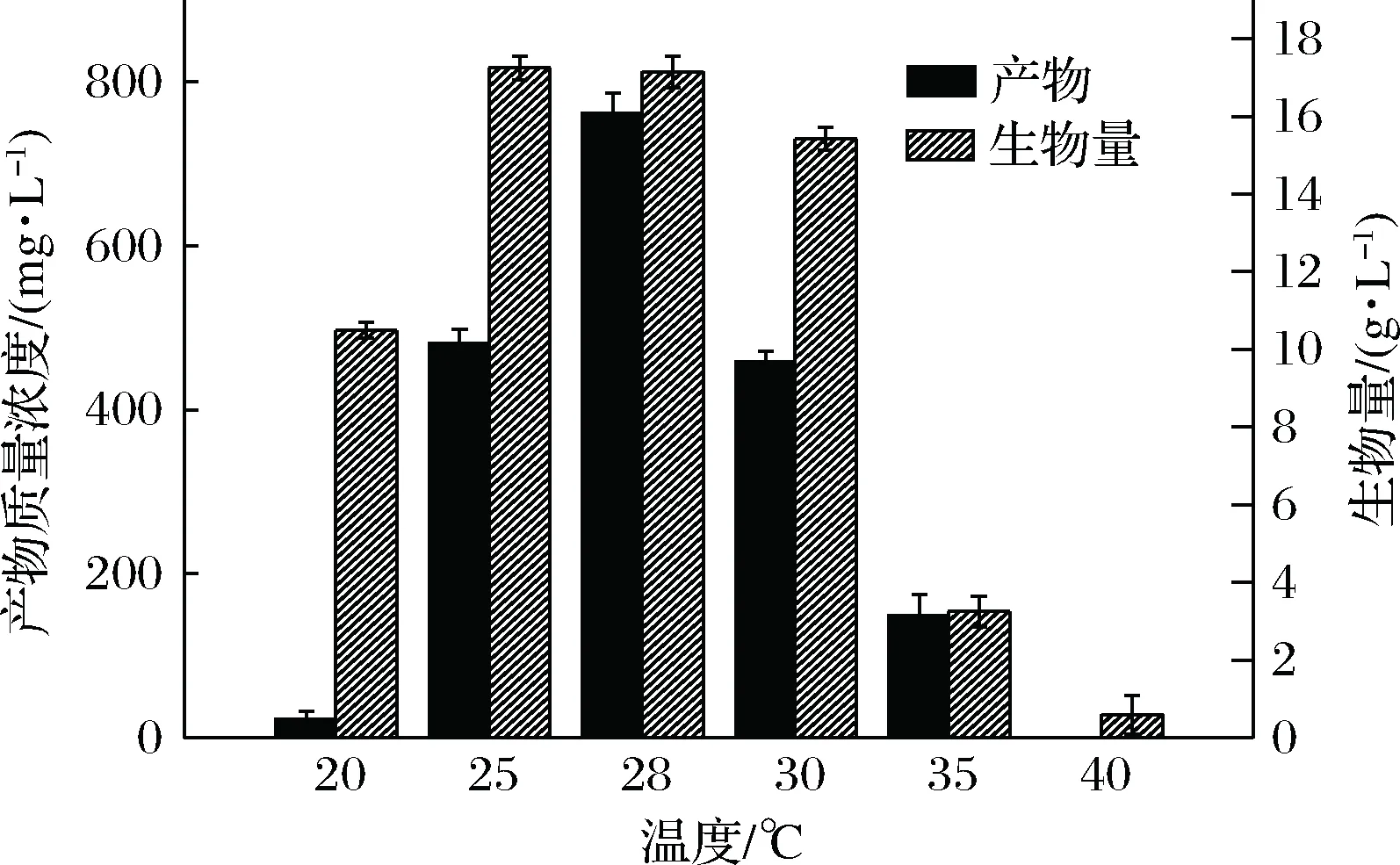
图13 发酵温度对菌体生长及产物浓度的影响Fig.13 Effect of temperature on cell growth andproduct concentration
2.10 大豆油添加量的确定
茉莉酸合成途径中的第一个关键酶为脂氧合酶,大豆油可以提高脂氧合酶的活性,所以在发酵过程中加入适量的大豆油以期提高茉莉酸的产量,实验结果如图14所示。添加大豆油后产物的浓度有所提高,基本上在1 100~1 540 mg/L的范围内,在大豆油添加量为10 g/L时,产物浓度达到最高为1 543 mg/L。由此可以看出,大豆油可以提高产物浓度,可能的原因就是大豆油的加入提高了该合成途径中第一个关键酶脂氧合酶的活性,且大豆油也可作为发酵碳源,使最终的产物浓度增加。

图14 大豆油添加量对菌体及产物质量浓度的影响Fig.14 Effects of Soybean Oil concentration on cellgrowth and product concentration
2.11 发酵罐上的初步扩大培养
在以上优化的基础上把该菌株在3 L的发酵罐上做了一次初步的扩大培养,实验结果如图15所示。在发酵过程中pH先降低后升高,茉莉酸的产生与菌株的生长也不是同步的,而是在发酵的第四天开始出现,此时pH也在开始回升,在发酵后期当pH接近于8时,茉莉酸积累量减少且出现分解的现象,发酵过程茉莉酸最高积累量达1 292 mg/L。发酵到12 d时,茉莉酸的积累量开始下降,并且与摇瓶发酵相比,发酵罐上的发酵周期较长,说明发酵罐的发酵条件有待进一步研究。
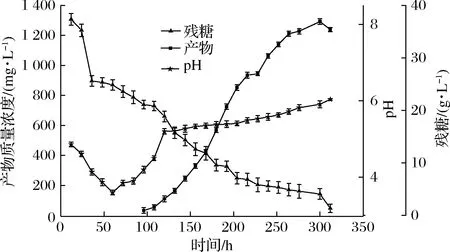
图15 发酵罐中菌体生长与产物积累情况Fig.15 Cell growth and accumulation of product in fermenter
3 结论
本文从121株霉菌中筛选到1株高产茉莉酸的菌株LasiodiplodiairanensisDWH-2,并对该菌株产茉莉酸的发酵培养基的碳源、氮源、无机盐及发酵条件如pH、温度、装液量等做了初步优化,使茉莉酸的产量由原来的320 mg/L提高到1 543 mg/L。并且在3 L发酵罐上扩大培养时,DWH-2可以产1 292 mg/L的茉莉酸。
[1]LIAN Qing-long, XIN Hai-bo,LI Xiao-xin,et al. Isolation, characterization and expression analysis of the genes—GhAOS, GhAOC and GhOPR3: Encoding the key enzymes involved in jasmonic acid biosynthesis in Gladiolus hybridus[J].ScientiaHorticulturae, 2013, 154(2):88-95.
[2]Nabity P D, Zavala J A, Delucia E H. Herbivore induction of jasmonic acid and chemical defences reduce photosynthesis in Nicotianaattenuata[J].Journal of Experimental Botany, 2013, 64(2):685-694.
[3]李倩楠, 唐清华, 周琪. 茉莉酸对植物生长发育的作用以及在农业生产上的应用[J].安徽农学通报, 2008, 14(12):38-38.
[4]朱宏涛, 李江, 李元,等. 激素类农药茉莉酸及其甲酯的植物生物活性及其在农业生产中的应用[J].农药, 2013(8):552-557.
[5]DHANDHUKIA P C, THAKKAR V R. Significant medium components for enhanced Jasmonic acid production byLasiodiplodiatheobromaeusing Plackett-Burman design[J].Current Trends in Biotechnology & Pharmacy, 2007, 1(1):79-86.
[6]李清清, 李大鹏, 李德全. 茉莉酸和茉莉酸甲酯生物合成及其调控机制[J].生物技术通报, 2010(1):53-57.
[7]洪忠, 陈虎保. 天然生理活性物质茉莉酸及其甲酯的生理作用与生物化学合成[J].农药, 2000, 39(5):8-11.
[8]TSUKADA K, TAKAHASHI K, NABETA K. Biosynthesis of jasmonic acid in a plant pathogenic fungus,Lasiodiplodiatheobromae[J]. Phytochemistry, 2010, 71(17): 2 019-2 023.
[9]李祖光,李建亮,沈德隆. 茉莉酸类化合物的合成研究进展[J].浙江化工,2008,09:19-23+5.
[10]ALDRIDGE D C, GILES D, TURNER W B. Antibiotic 1233A: a fungal, -lactone.[J].Journal of the Chemical Society Perkin Transactions, 1971, 23(8):3 888.
[11]MIERSCH O, BRÜCKNER B, SCHMIDT J, et al. Cyclopentane fatty acids from Gibberellafujikuroi[J].Phytochemistry, 1992, 31(31):3 835-3 837.
[12]CROSS B E, WEBSTER G R. New metabolites of Gibberellafujikuroi. XV. N-jasmonoyl- and N-dihydrojasmonoyl-isoleucine.[J].Journal of the Chemical Society Perkin Transactions, 1970, 13(13):1 839-1 842.
[13]FARBOOD,MOHAMAD I,BLOCHER,et al. Production of food flavor-acceptable jasmonic acid and methyl jasmonate byDiplodiagossypinEP patent,EP1118672 A2[P].2001-07-25.
[14]韩晓敏, 梁良, 张争,等. 可可毛色二孢菌对白木香产生倍半萜诱导作用[J].中国中药杂志, 2014, 39(2):192-196.
