鳀鱼蒸煮液的壳聚糖絮凝洁净化及机理分析
2018-04-12林龙戚雅楠丁玉庭张建友
林龙,戚雅楠,丁玉庭,张建友
(浙江工业大学海洋学院,浙江 杭州,310014)
鳀鱼是鳀属(Engraulis)鱼类的统称,分布于南北半球的温带沿海水域,是一种中上层集群性鱼类,亦是世界海洋捕捞量最大的鱼种,年产量大约有900万t[1],中国近海鯷鱼资源主要以日本鯷鱼为主[2]。鳀鱼捕获后一般加工成干制品,加工过程产生大量的蒸煮液,每加工1t鳀鱼,就会产生1.5t左右蒸煮液。蒸煮液中含有丰富的蛋白质、氨基酸、核苷酸及一些钙、钾、磷、铁等矿物质。对于蒸煮液的深加工,用于生产调味品、蛋白营养强化剂等食品具有较好的市场前景。膜浓缩是蒸煮液回收利用的重要加工途径,但蒸煮液中含有大量的悬浮物,有机质含量高,在膜浓缩过程中,容易形成膜污染,使通量快速衰减[3]。因此,对蒸煮液进行洁净化处理显得十分必要,不但可以回收蒸煮液中的蛋白质,而且可降低蒸煮液的有机质含量,减缓膜污染,延长膜组件运行周期。食品加工中,常见的洁净化处理方式有过滤、离心和絮凝[4-7]等方法。其中,由于过滤的时间较长,离心又不能除去水溶性物质,应用的局限性较大。
絮凝不仅具有分离悬浮物等杂质的作用,而且具有去除部分水溶性物质的功能,因此更具有净水除杂的效用。絮凝过程中,胶体脱稳形成分散的絮状胶体与絮凝剂发生电中和、吸附架桥等作用聚集成大颗粒物质[8]。在众多天然高分子絮凝剂中,壳聚糖是从自然界广泛存在的几丁质(chitin)经过脱乙酰作用得到的一种阳离子型絮凝剂,具有无毒、易生物降解和较强的螯合、络合能力等优点,广泛应用于净化饮用水、食品与发酵工业废水的絮凝工艺中。GUERRERO等[7]和WIBOWO等[9]使用壳聚糖絮凝回收鱼糜加工废水中的蛋白质,其中壳聚糖/藻朊酸盐复合絮凝剂对蛋白质的回收率达到80%以上。另外,壳聚糖也具有去除金属离子的能力,GAMAGE等[10]的研究表明,壳聚糖填充柱对工业废水中Hg、Pb、Cd等重金属元素的去除率高达95%以上。同时,CHENG等[11]在絮凝净化饮用水研究发现,添加0.2 mg/L的壳聚糖具有高效的除菌抑菌效果,而且LERTSUTTHIWONG[12]在净化养殖虾池水体时也使用壳聚糖絮凝去除浮游生物。
因此,为了净化鳀鱼蒸煮液,在不同pH条件下壳聚糖与蒸煮液中溶性蛋白的絮凝过程中,通过对溶解曲线、红外光谱、分子质量分布、重金属及氨基酸含量的变化进行分析,探究适宜的絮凝pH值和絮凝机理。
1 材料与方法
1.1 试验材料
鳀鱼蒸煮液(盐含量为2.51%,pH=5.9~6.0)的蒸煮时间一般控制在4~5 h,由浙江瑞安市华盛水产有限公司提供,-18℃冷冻保藏,试验前流水解冻待用。
1.2 仪器设备
HPLC高效液相(2695),美国Waters公司;ICP-AES分析仪(IRIS Intrepid),美国热电TJA公司;FT-IR红外光谱分析仪(Nicolet 6700),美国Thermo公司;氨基酸分析仪(SYKAM433D),德国Cham公司。
1.3 实验方法
1.3.1流程
研究蒸煮液pH对水溶性蛋白絮凝效果的影响。试验流程如图1所示,蒸煮液中加入壳聚糖絮凝剂,添加量为1 g/L,pH值降至5.5后,调节pH使其在1~12范围内,在室温条件下,低速搅拌30 min后,离心过滤,上清液进行水溶性蛋白含量和分子质量分布测定,沉淀物进行红外分析。然后,在不添加絮凝剂的条件下,直接调节蒸煮液的pH使其在1~12范围内,在室温条件下,低速搅拌30 min后,离心过滤,上清液进行水溶性蛋白含量和分子质量分布测定。
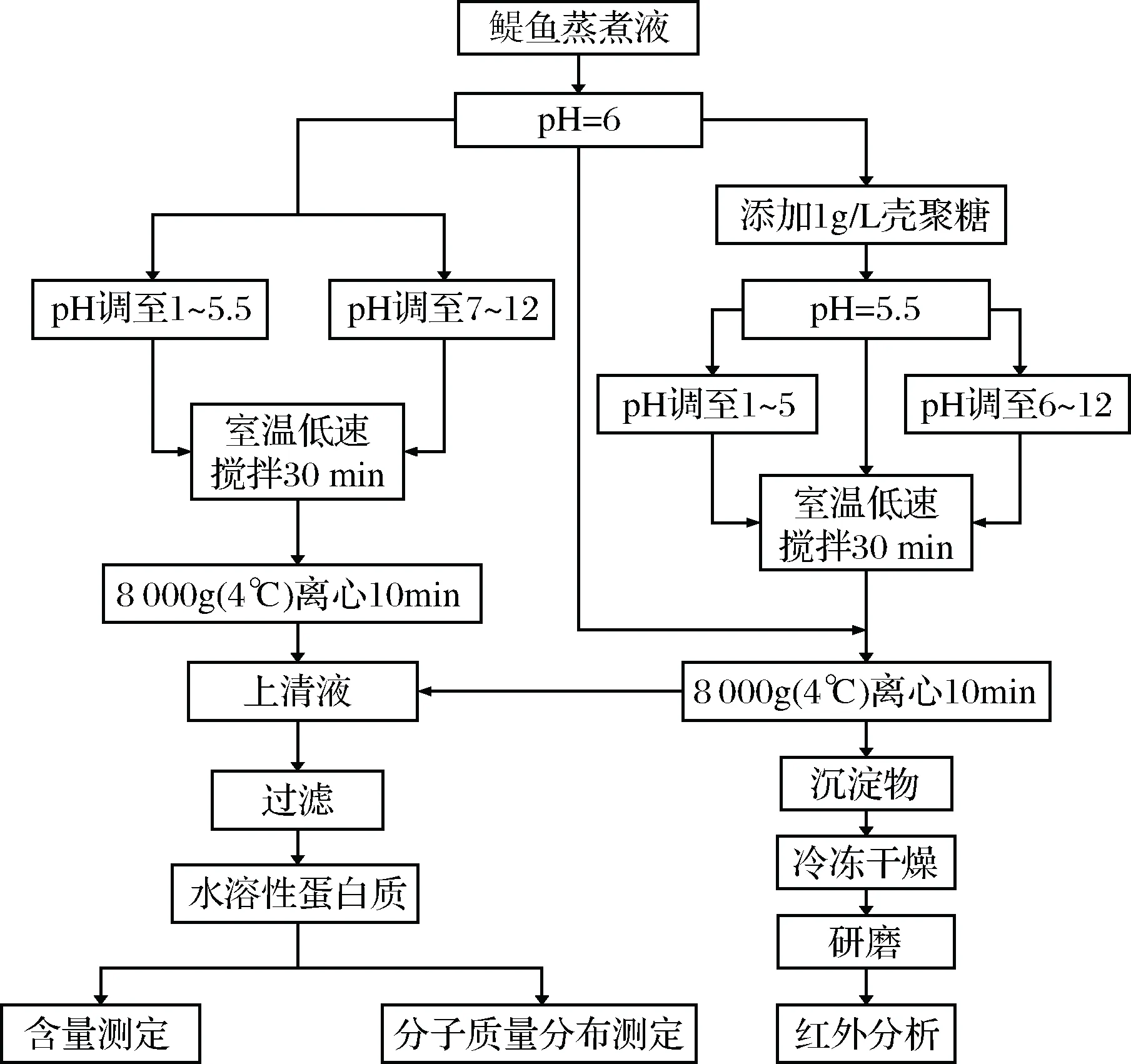
图1 pH值对壳聚糖絮凝水溶性蛋白影响的试验流程图Fig.1 The experimental flow chart of the influence of pHon flocculation of water soluble proteins by Chitosan
1.3.2蛋白质含量测定[13]
采用双缩脲比色法测定。蒸煮液8 000 g离心后,1 mL上清液与4 mL双缩脲试剂混合,显色30 min后540 nm测定。
1.3.3蛋白质分子质量及分布测定[14-16]
采用HPLC(高效液相色谱)方法测定蒸煮液中蛋白质分子质量及分布。色谱柱为TSK-GEL G3000-PWXL(7.8 mm×300 mm,孔径7 μm),柱温25℃,流动相为0.05 mol/L Na3PO4缓冲液(pH=7.2),流速0.5 mL/min,检测波长为280 nm。铁蛋白(450 kDa,Sigma)、牛血清蛋白(66.43 kDa,Aladdin)、核糖核酸酶(13.7 kDa,Sigma)、胰岛素(5.73 kDa,Sigma)和B12(1 355 Da,Aladdin)标准品在相同色谱条件测定出峰时间。分子质量的对数(lgMw)与出峰时间(T)呈良好的线性关系,回归方程:lgMw=-0.180 0T+7.419 1,R2=0.988 5。
1.3.4红外光谱分析[17]
蒸煮液8 000 g(4℃)离心10 min,沉淀物质经冷冻干燥后研磨成粉末状,加入KBr混合研磨,压片后放入红外光谱仪中扫描,波数范围4 000~400 cm-1。
1.3.5水溶性固形物含量
参考GB/T 10786—2006。
1.3.6氨基酸组成及含量分析[18]
蒸煮液用5-磺基水杨酸(质量分数2%)沉淀蛋白后,8 000 g(4℃)离心10 min,上清液过0.45 μm水系膜后经氨基酸自动分析仪测定。
1.3.7重金属离子测定[10, 19]
采用ICP-AES(电感耦合等离子发射光谱仪)方法测定蒸煮液中砷(As)、镉(Cd)、铬(Cr)、汞(Hg)、铅(Pb)和硒(Se)元素的含量。取15 mL样品于聚四氟乙烯消解罐中,消解罐中加入10 mL HNO3,在电子加热板中90℃消解4 h,消解后溶液呈透明略带黄色。用超纯水定容于50 mL容量瓶中,每个样品做3个平行,同时做空白试验。ICP-AES射频功率1 050 kW,雾化压力4.25 MPa,,辅助气流速1.0 L/min,样品提升量1.70 mL/min,样品冲洗时间1 min,高波扫描5 s,低波扫描30 s。
1.4 数据分析
图表数据采用Origin8.0和Excel 2013软件进行统计、分析以及绘图,显著性分析p>0.05为不显著。
2 结果与分析
2.1 溶液pH对水溶性蛋白溶解性的影响
图2中水溶性蛋白的溶解曲线表明,蒸煮液pH=3时水溶性蛋白的残留率最低,溶解度最小,即蒸煮液水溶性蛋白的等电点pI=3左右。当蒸煮液pH逐渐增大时,水溶性蛋白表面携带的负电荷增加,溶解度增加。但是当蒸煮液呈碱性后,部分水溶性蛋白逐渐形成沉淀,可能是由于蒸煮液中由鯷鱼引入了碱不溶性金属离子Ca和Mg,形成Ca(OH)2和Mg(OH)2絮凝核心引起蛋白质沉淀。王路[20]检测了阿拉斯加狭鳕鱼糜的漂洗废水中金属离子组成,也发现了Ca和Mg离子是碱不溶金属离子中含量最高的元素。
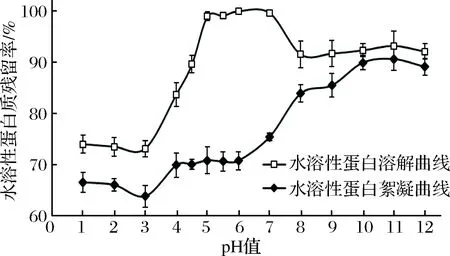
图2 蒸煮液pH值对水溶性蛋白溶解和絮凝的影响Fig.2 Effect of pH on the solubility and flocculation ofwater soluble protein
不同pH条件下蒸煮液中水溶性蛋白溶解性的差异通过蛋白分子质量分布的GPC图谱(图3)可知,在溶液pH=3、4、5.5和10 条件下水溶性蛋白的分子质量分布差异主要集中在出峰时间10~16 min,pH=5.5的起始出峰时间在10.41 min(331 kDa),pH=10的起始出峰时间在11.31 min(241 kDa),pH=4的起始出峰时间在11.96 min(181 kDa),pH=3的起始出峰时间在13.35 min(103 kDa),即溶液pH值的改变,主要影响大分子水溶性蛋白的溶解性,对分子质量小于19 kDa的蛋白质溶解性几乎没有影响。同时pH=5.5、10、4和3的峰面积依次减少,与图2中水溶性蛋白溶解曲线的变化趋势一致。
2.2 絮凝pH对壳聚糖絮凝水溶性蛋白的影响
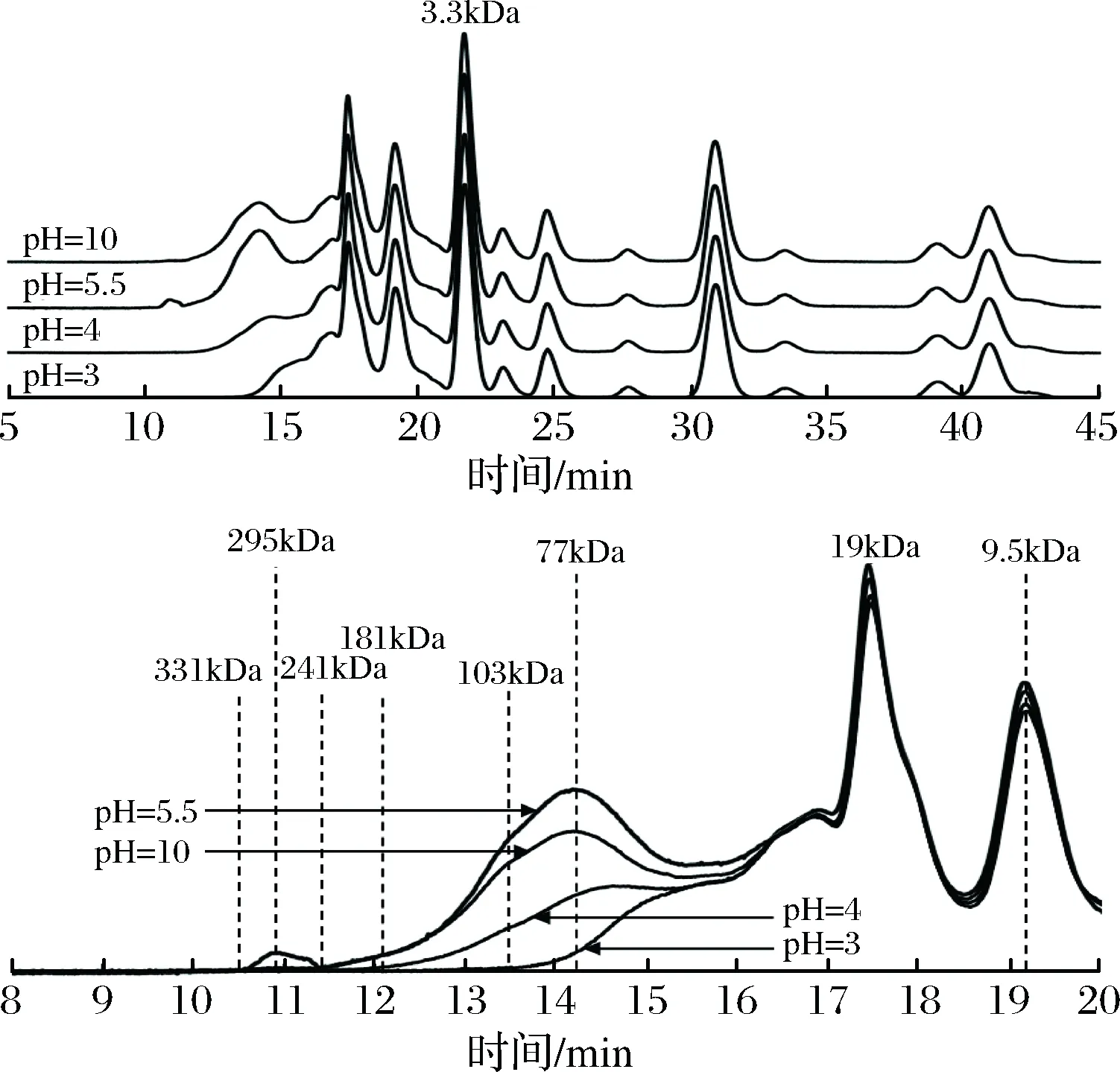
图3 不同pH值条件下蒸煮液水溶性蛋白分子质量分布图(GPC)Fig.3 The molecular weight distribution of water solubleprotein in cooking liquor under different pH conditions (GPC)

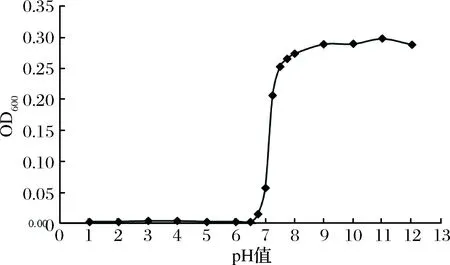
图4 pH值对壳聚糖溶解性能的影响Fig.4 Effect of pH on the solubility of Chitosan
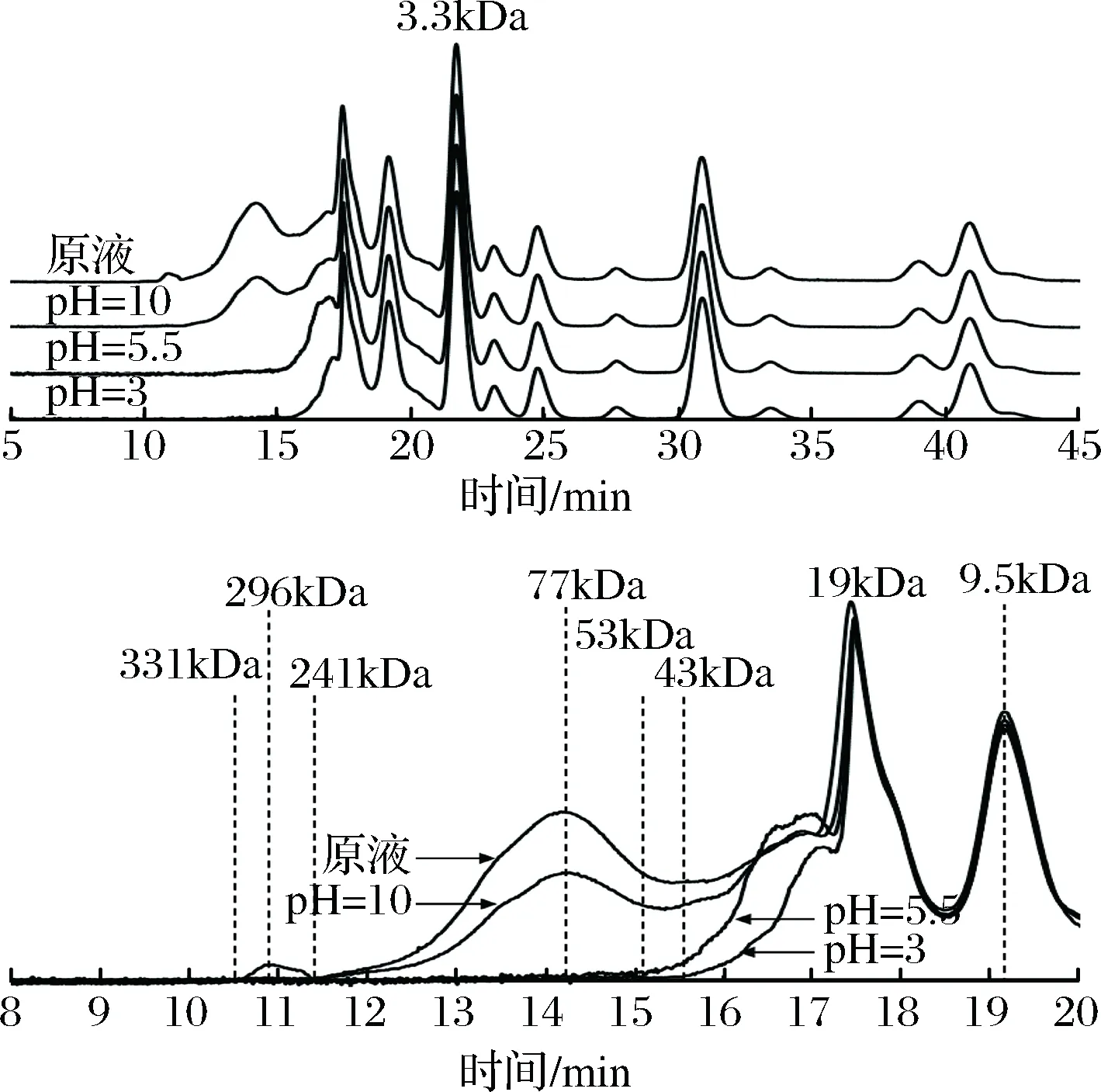
图5 不同pH絮凝后水溶性蛋白分子质量分布图(GPC)Fig.5 The molecular weight distribution of water solubleprotein in cooking liquor after different pH flocculation (GPC)
2.3 壳聚糖絮凝蛋白沉淀物的红外分析
通过对不同pH条件下壳聚糖絮凝水溶性蛋白产生的沉淀物进行红外扫描分析,如图6所示。
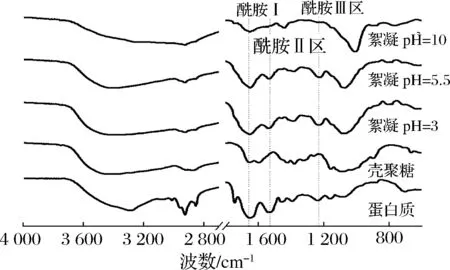
图6 不同pH絮凝沉淀物的红外光谱分析Fig.6 FTIR spectra of different pH flocculation precipitates



2.4 pH=3与pH=5.5壳聚糖絮凝的GPC比较
溶液pH=5.5和蒸煮原液(pH=6)中水溶性蛋白的溶解度相同,蛋白质分子质量分布的GPC图也相同。
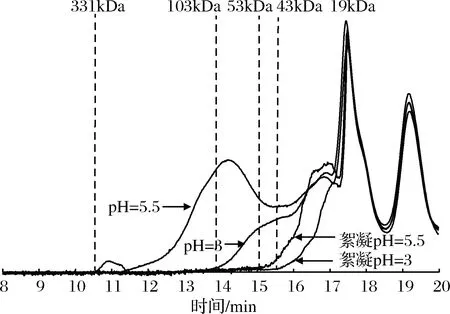
图7 pH=3和pH=5.5条件下水溶性蛋白溶解性能和絮凝性能比较(GPC图)Fig.7 Comparison of solubility and flocculation properties ofwater soluble protein at pH=3 and pH=5.5 (GPC)
由图7表明,壳聚糖絮凝pH=5.5时,蒸煮液中分子质量大于53 kDa的蛋白质完全被去除,分子量在53~19 kDa的蛋白质峰面积明显下降。溶液pH=3时,蒸煮液中分子质量大于103 kDa的蛋白质已完全不溶于水;壳聚糖絮凝pH=3时,能除尽分子质量大于43 kDa的蛋白质,后者蒸煮液水溶性蛋白的残留量比前者减少了9.30%,说明pH=3时壳聚糖絮凝效果最好的原因不仅是由于壳聚糖-NH2的质子化作用达到最大[26],而且蒸煮液中水溶性蛋白的溶解度也达到最低。pH=3时壳聚糖的絮凝效果比絮凝pH=5.5提高23.12%;但是壳聚糖絮凝pH=5.5时可以简化絮凝操作。蒸煮液中添加壳聚糖絮凝剂后,pH值从5.9~6.0降至5.5左右,不必再调节pH值,减少引入酸碱物质,尽量保持原有的风味。因此,选择壳聚糖的絮凝pH值为5.5。
2.5 壳聚糖对蛋白絮凝能力的分析
壳聚糖对水溶性蛋白的去除率最大为36.23%(图2),与WIBOWO和GAMAGE等[9-10]的研究结果相差较大。这可能存在的原因有:第一,蒸煮液的盐含量(2.51%)较高,离子强度大,影响壳聚糖和蛋白质的静电结合,使壳聚糖的絮凝能力降低[24, 27-29];第二,壳聚糖对大分子蛋白质具有较好的絮凝能力,但对小分子蛋白质无絮凝作用。因为如图8所示蒸煮原液主要是以小分子蛋白为主,分子质量小于19 kDa的蛋白质占58%左右。蛋白沉淀剂TCA(三氯乙酸)与壳聚糖絮凝剂相比,TCA对蛋白质具有较好的沉淀作用[30],添加量为5 g/100mL时蒸煮原液水溶性蛋白的去除率达到55.71%,分子质量小于19 kDa的蛋白峰面积明显小于蒸煮原液和絮凝pH=3的GPC图,表明TCA不仅对大分子蛋白质有较好的沉淀作用,而且对小分子蛋白质同样具有一定的沉淀作用。壳聚糖絮凝pH=3的GPC图表明壳聚糖对蒸煮液中分子质量大于19 kDa的水溶性蛋白具有较好的絮凝作用,絮凝去除效率是TCA的65%。
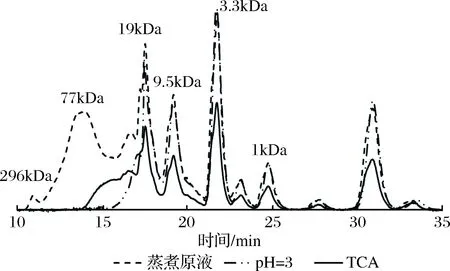
图8 壳聚糖絮凝和TCA沉淀水溶性蛋白性能比较(GPC图)Fig.8 Comparison of the properties of water soluble proteinby chitosan flocculation and TCA precipitation (GPC)
2.6 絮凝后水溶性固形物和重金属含量的变化
在pH=5.5条件下,壳聚糖絮凝前后鳀鱼蒸煮液中水溶性固形物、水溶性蛋白、游离氨基酸和重金属含量分别见表1和表2。壳聚糖絮凝后水溶性固形物含量降低6.72%,主要是由于水溶性蛋白含量降低引起;而各种游离氨基酸的含量变化不显著,表明壳聚糖絮凝不影响氨基酸含量的变化。同时,由于颗粒状壳聚糖对重金属离子有较强螯合、络合作用,溶解状态的壳聚糖同样具有一定去除重金属元素的作用。实验结果表明,絮凝前后铬、硒、砷和汞元素的含量有显著性差异,分别降低52.82%、40.95%、21.92%和13.63%。
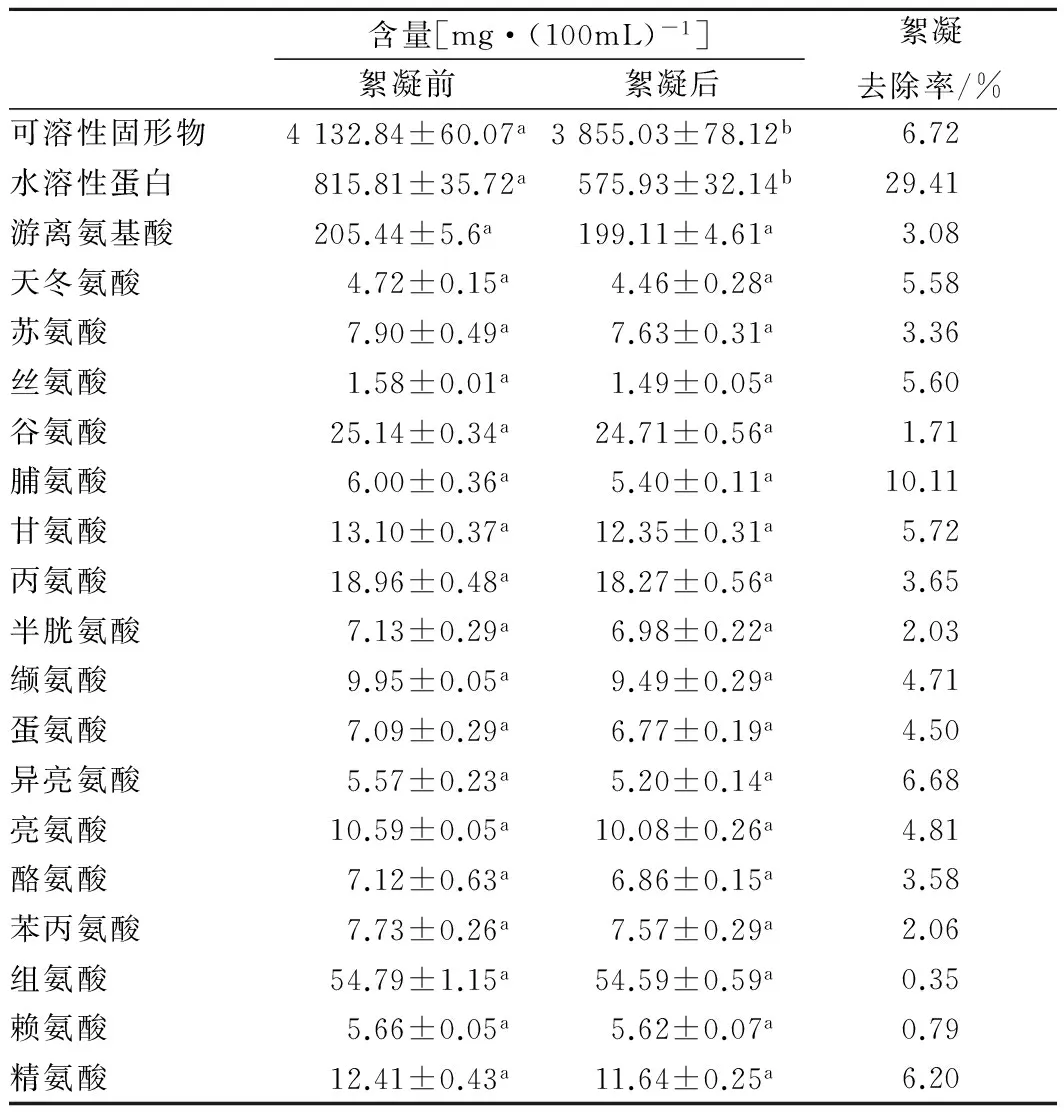
表1 絮凝前后可溶性固形物、水溶性蛋白和游离氨基酸含量的变化(p>0.05不显著)Table 1 Changes of soluble solids, water soluble proteinand free amino acid content after flocculation (p>0.05)
注:数字上标小写字母相同表示差异不显著,字母不相同表示差异显著,表2同。
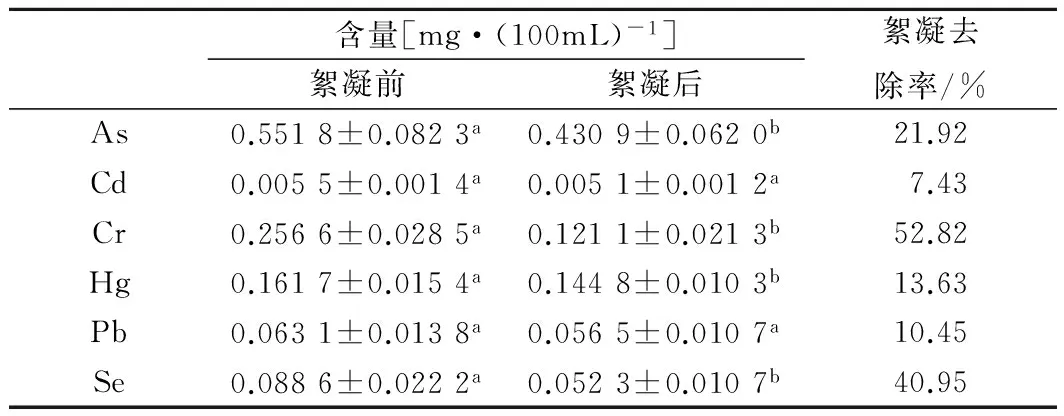
表2 絮凝前后重金属含量的变化(p>0.05不显著)Table 2 The change of heavy metal content afterflocculation (p>0.05)
3 结论
(1)在不同pH条件下壳聚糖与鯷鱼蒸煮液水溶性蛋白的絮凝机理的试验中发现,碱性环境中,壳聚糖主要通过吸附作用形成沉淀物;而酸性环境中,壳聚糖絮凝主要通过电中和作用和吸附架桥作用,形成类似蛋白-壳聚糖-蛋白的结构。不同的酸碱环境表现出不同的絮凝能力,酸性环境则更有利于壳聚糖与蛋白的絮凝作用。絮凝pH=3时的絮凝效果最好,但是水溶性蛋白絮凝去除率只达到36.23%,说明壳聚糖对蒸煮液水溶性蛋白絮凝洁净化能力不足,这可能是因为壳聚糖对大分子水溶性蛋白具有较好的絮凝能力,而蒸煮液分子量小于19 kDa的蛋白质基本不参与絮凝作用引起的。
(2)在絮凝pH=3和pH=5.5的比较中,选择壳聚糖絮凝pH=5.5更符合蒸煮液洁净化的理念,加入更少的酸碱物质,絮凝过程变得更加简单经济,便于工业化应用。絮凝pH=5.5时絮凝后蒸煮液蛋白质和铬、硒、砷和汞元素含量显著降低,但氨基酸含量无显著变化,保持了氨基酸对鯷鱼蒸煮液风味的贡献。
[1]WU Hao-hao, LIU Zun-ying, ZHAO Yuan-hui, et al. Enzymatic preparation and characterization of iron-chelating peptides from anchovy (Engraulisjaponicus) muscle protein[J]. Food Research International, 2012,48(2):435-441.
[2]薛利建, 刘子藩. 东海日本鳀数量分布和生物学特性的研究[J]. 浙江海洋学院学报:自然科学版, 2005, 24(4):312-317.
[3]郑晓杰, 李燕, 张井, 等. 陶瓷膜微滤鲲鱼蒸煮液的工艺条件研究[J]. 食品科学, 2009, 30(24):217-220.
[4]WICKRAMASINGHE S R, WU Yan-ling, HAN Bin-bing. Enhanced microfiltration of yeast by flocculation[J]. Desalination, 2002, 147(1-3):25-30.
[5]WICKRAMASINGHE S R, HAN Bin-bing, AKEPRATHUMCHAI S, et al. Improved permeate flux by flocculation of biological feeds: comparison between theory and experiment[J]. Membrane Science, 2004, 242(1/2):57-71.
[6]KIM J S, AKEPRATHUMCHAI S, WICKRAMASINGHE S R. Flocculation to enhance microfiltration[J]. Membrane Science, 2001, 182(1/2):161-172.
[7]GUERRERO L, OMIL F, MENDEZ R, et al. Protein recovery during the overall treatment of wastewaters from fish-meal factories[J]. Bioresource Technology, 1998, 63(3):221-229.
[8]RENAULT F, SANCEY B, BADOT P M, et al. Chitosan for coagulation/flocculation processes-An eco-friendly approach[J]. European Polymer, 2009, 45(5):1 337-1 348.
[9]WIBOWO S, VELAZQUEZ G, SAVANT V, et al. Surimi wash water treatment for protein recovery: effect of chitosan-alginate complex concentration and treatment time on protein adsorption[J]. Bioresource Technology, 2005, 96(6):665-671.
[10]GAMAGE A, SHAHIDI F. Use of chitosan for the removal of metal ion contaminants and proteins from water[J]. Food Chemistry, 2007, 104(3):989-996.
[11]CHENG Qing-li, WANG Wen-lin. Studies on Inhibition Activity of Chitosan against Bacteria from Drinking Water[C]. 2011 International Conference on Electric Technology and Civil Engineering (ICETCE), Piscataway USA, Institute of Electrical and Electronics Engineers, 2011:4 475-4 478.
[12]LERTSUTTHIWONG P, SUTTI S, POWTONGSOOK S. Optimization of chitosan flocculation for phytoplankton removal in shrimp culture ponds[J]. Aquacultural Engineering, 2009, 41(3):188-193.
[13]ANANTHAN G, KARTHIKEYAN M M, SELVA P A, et al. Studies on the seasonal variations in the proximate composition of ascidians from the Palk Bay, Southeast coast of India[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(10):793-797.
[14]HAYAKAWA K, FELICE D C, WATANABE T, et al. High-recovery protein purification by high-performance gel-permeation chromatography: application to human serum biotinidase[J]. Chromatography B, 1993, 616(2):327-332.
[15]KATO Y, KITAMURA T, HASHIMOTO T. Operational variables in high-performance hydrophobic interaction chromatography of proteins on tskgel phenyl-5PW[J]. Chromatography A, 1984, 298(3):407-418.
[16]FUKANO K, KOMIYA K, SASAKI H, et al. Evaluation of new supports for high-pressure aqueous gel permeation chromatography: TSK-GEL SW type columns[J]. Chromatography A, 1978, 166(1):47-54.
[17]YUAN Yuan, WAN Zhi-li, YIN Shou-wei, et al. Characterization of complexes of soy protein and chitosan heated at low pH[J]. LWT-Food Science and Technology, 2013, 50(2):657-664.
[18]杜书, 岳喜庆, 武俊瑞, 等. 自然发酵酸菜游离氨基酸的分析[J]. 食品与发酵工业, 2013, 39(2):174-176.
[19]OZCAN M M, AL JUHAIMI F Y. Determination of heavy metals in bee honey with connected and not connected metal wires using inductively coupled plasma atomic emission spectrometry (ICP-AES)[J]. Environmental Monitoring & Assessment, 2012, 184(4):2 373-2 375.
[20]王路. 鱼糜漂洗水中蛋白的分级等电沉淀和絮凝回收工艺研究[D]. 青岛: 中国海洋大学, 2015.
[21]VARMA A J, DESHPANDE S V, KENNEDY J F. Metal complexation by chitosan and its derivatives: A review[J]. Carbohydrate Polymers, 2004, 55(1):77-93.
[22]GUIBAL E. Interactions of metal ions with chitosan-based sorbents: a review[J]. Separation and Purification Technology, 2004, 38(1):43-74.
[23]PAWLAK A, MUCHA M. Thermogravimetric and FTIR studies of chitosan blends[J]. Thermochimica Acta, 2003, 396(1/2): 153-166.
[24]HUANG Guo-qing, SUN Yan-ting, XIAO Jun-xiao, et al. Complex coacervation of soybean protein isolate and chitosan[J]. Food Chemistry, 2012, 135(2):534-539.
[25]TENG Zi, WANG Qin. Extraction, identification and characterization of the water-insoluble proteins from tobacco biomass[J]. Agricultural and Food Chemistry, 2012, 92(7):1 368-1 374.
[26]GUIBAL E, VAN VOOREN M, DEMPSEY B A, et al. A review of the use of chitosan for the removal of particulate and dissolved contaminants[J]. Separation Science and Technology, 2006, 41(11):2 487-2 514.
[27]LIU Shuang-hui, CAO Yuan-long, GHOSH S, et al. Intermolecular interactions during complex coacervation of pea protein isolate and gum arabic[J]. Agricultural and Food Chemistry, 2010, 58(1):552-556.
[28]CRINI G, BADOT P M. Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes using batch studies: A review of recent literature[J]. Progress in Polymer Science, 2008, 33(4):399-447.
[29]CHIOU M S, LI H Y. Adsorption behavior of reactive dye in aqueous solution on chemical cross-linked chitosan beads[J]. Chemosphere, 2003, 50(8):1 095-1 105.
[30]SIVARAMAN T, KUMAR T K S, JAYARAMAN G, et al. The mechanism of 2,2,2-trichloroacetic acid-induced protein precipitation[J]. Protein Chemistry, 1997, 16(4):291-297.
