CD31启动子表达载体的构建与功能鉴定
2018-04-10毛杨柳常振宇丁丽华刘婕叶棋浓
毛杨柳,常振宇,丁丽华,刘婕,叶棋浓
1.军事科学院 军事医学研究院 生物工程研究所,北京100850;2.解放军总医院 肝胆外二科,北京100853
肿瘤血管系统的形成对于肿瘤的发生、发展以及侵袭转移有着十分重要的作用[1-3]。血管形成的很大一部分原因是由于血管内皮细胞的生成与增殖,没有血管内皮细胞生成和增殖,就很难形成肿瘤,也无法转移[4-5]。传统观念认为肿瘤新生血管的内皮细胞是由骨髓来源的内皮祖细胞分化形成的[6-9],但最近的研究发现肿瘤干细胞也具有向血管内皮细胞分化的能力[10-13]。因此,内皮细胞的发生及鉴定是研究肿瘤细胞发生、分化与转移的重要手段之一。
目前,鉴定内皮细胞的方法主要是通过内皮细胞的特异性标志物和内皮细胞的功能进行检测。已知的内皮细胞特异性标志物有CD31、CD105、VEGFR2 等,通过Q-PCR、流式细胞技术、Western 印迹、免疫荧光等技术检测内皮细胞特异性标志物的表达情况;另外可以通过成管实验检测内皮细胞的功能。血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule- 1,
PECAM-1/CD31)是黏附分子免疫球蛋白超家族成员,可能参与肿瘤细胞黏附于内皮细胞并促进肿瘤血管形成的过程[14]。我们将在内皮细胞中特异性表达的CD31 的启动子插入融合表达绿色荧光蛋白和萤光素酶的载体,转染内皮细胞,由此为内皮细胞的鉴定提供新的技术方法。
1 材料与方法
1.1 材料
HUVEC、BEND3、MCF7细胞,大肠杆菌DH5α,载体pGL4和pCDH-coGFP由本实验室保存;KpnⅠ与XhoⅠ限制性核酸内切酶、T4DNA连接酶、PCR试剂、DNA聚合酶、高保真Pfu酶购自TaKaRa公司;DMEM为本实验室自配;新生牛血清由浙江天杭生物有限公司生产;高效真核转染试剂盒Lipo2000购自Invitrogen公司;PCR产物和酶切产物回收试剂盒、胶回收试剂盒、质粒提取试剂盒均为Promega公司产品。
1.2 从基因组钓取CD31启动子
根据人CD31启动子序列设计上游引物(5′-GGGGTACCGCCCAGCCGTTAATTCTATTCT-3′)和下游引物(5′-CCGCTCGAGAAGCTTCGATGCTCA TGGAG-3′),并在上、下游引物的5′端分别添加KpnⅠ与XhoⅠ酶切位点,以cDNA为模板进行扩增(反应条件:94℃1min,以94℃ 70 s、65℃40s、70℃ 1 min进行35个循环,72℃ 5 min)。PCR产物经1%琼脂糖凝胶电泳,条带位置特异后,胶回收得到CD31 启动子片段。
1.3 质粒的构建与鉴定
用限制性内切酶KpnⅠ与XhoⅠ将PCR 产物、pGL4 载体和pCDH-coGFP 载体进行酶切,酶切后的产物分别与pGL4 和pCDH-copGFP 载体连接,连接产物转化大肠杆菌DH5α感受态并克隆扩大培养,挑取单克隆提取质粒,用KpnⅠ与XhoⅠ双酶切鉴定并测序。
1.4 质粒瞬时转染哺乳动物细胞
用含1%双抗及10%新生牛血清的DMEM 培养基将BEND3、HUVEC、MCF7 细胞分别接种于24孔板中,接种量为转染时70%~80%最佳,转染前1h更换新鲜的DMEM培养基。将0.5 μL/孔VigoFect与250μL/孔NaCl 混合,静置5 min,在此期间将1.5 μg/孔的pGL4-CD31promotor-Lucif⁃erase 质粒与250 μL/孔的NaCl混合,然后再将2种溶液混匀,室温静置15 min 后逐滴加入24 孔板中;以相同方法转染pGL4.0 载体作为对照。37℃、5% CO2常规培养,4~6 h 后换新鲜的DMEM培养基,24 h 后收取细胞。
1.5 双萤光素酶检测
分别将质粒瞬时转染BEND3、HUVEC、MCF7细胞系,24 h 后弃DMEM,用PBS 清洗2 次后加入1×ULB 裂解细胞,于摇床上裂解30 min。将裂解液同细胞碎片一同吸进EP 管中,振荡5~10 min,12 000 r/min 离心1 min,取上清做发光检测。
1.6 慢病毒的包装
将293T 细胞接种于10 cm 皿中,当细胞密度达到70%~80%时,将慢病毒包装系统中的pAX2、pLP-VSVG 和pCDH-CD31promotor-copGFP 质 粒 按照一定的比例混合,用无血清无双抗的DMEM 稀释,加入一定比例的Megatran 混匀,振荡10 s,静置10 min,然后将以上混合液逐滴加入293T 细胞中混匀,48 h 后收集含有病毒粒子的上清液,离心、过滤后置4℃或-80℃保存。
1.7 稳定表达GFP的HUVEC细胞株的构建
将HUVEC 细胞与MCF7 细胞接种于6 cm 皿中,待细胞密度达70%~80%时即可感染,加入包装好的病毒液,同时加入8 μg/mL 的聚凝胺促进病毒转染。感染8 h 后更换新鲜培养基,扩大培养后于荧光显微镜下观察荧光。
1.8 数据统计
采用SPSS19.0 进行统计学处理分析,所有实验数据均以x±s表示,3 组间比较采用方差分析,P<0.05 认为差异有统计学意义。
2 结果
2.1 质粒的构建与鉴定
以实验室保存的基因组DNA 为模板扩增CD31 启动子序列,即CD31 核酸序列的-710~+116部分,获得887 bp 片段,与预期一致(图1)。将载体pGL4 和pCDH-copGFP 用KpnⅠ、XhoⅠ双 酶切后与PCR 产物连接,转化感受态大肠杆菌DH5α,挑选单克隆经菌液PCR 鉴定,或得与目的条带887 bp 接近的单克隆。阳性克隆经由提取质粒、酶切鉴定,可切出约800 bp 的目的条带,对照空载体经双酶切后仅见载体大片段,符合预期结果(图2)。测序结果表明,插入片段的DNA 序列与CD31 启动子序列完全一致(图3)。

图1 CD31 启动子的PCR 扩增

图2 重组质粒pGL4-CD31promoter(A)和pCDH-copGFPCD31promoter(B)的KpnⅠ与XhoⅠ双酶切电泳图谱

图3 pGL4-CD31promoter(A)和pCDH-copGFP-CD31promoter(B)的测序结果
2.2 启动子活性测定
将构建的pGL4-CD31promotor-Luciferase 质粒和TK 质粒与空载体pGL4.0 和TK 质粒分别瞬时转染BEND3、HUVEC、MCF7 细胞,24~48 h 后裂解细胞,与特异性底物反应后获得荧光比值(图4)。结果表明,与空载体相比,CD31 启动子特异性在内皮细胞中促进荧光酶表达。CD31 启动子在乳腺上皮细胞MCF-7 中没有活性,而在内皮细胞HUVEC 和BEND3 中,CD31 启动子的活性升高了约7 倍(P<0.01)。
2.3 GFP稳定表达的MCF7细胞株构建
用包装好的pCDH-CD31promotor-copGFP 慢病毒分别感染HUVEC 与MCF7 细胞,8 h 后更换培养基,扩大培养后,将被病毒感染过的MCF-7细胞系与被病毒感染过且有荧光的HUVEC 细胞系种于腔室载玻片中,通过免疫荧光可观察到HUVEC 细胞中有绿色荧光,阴性对照MCF7 细胞中无荧光(图5),说明CD31 启动子特异性在内皮细胞中表达。

图4 pGL4-CD31promotor 启动子活性
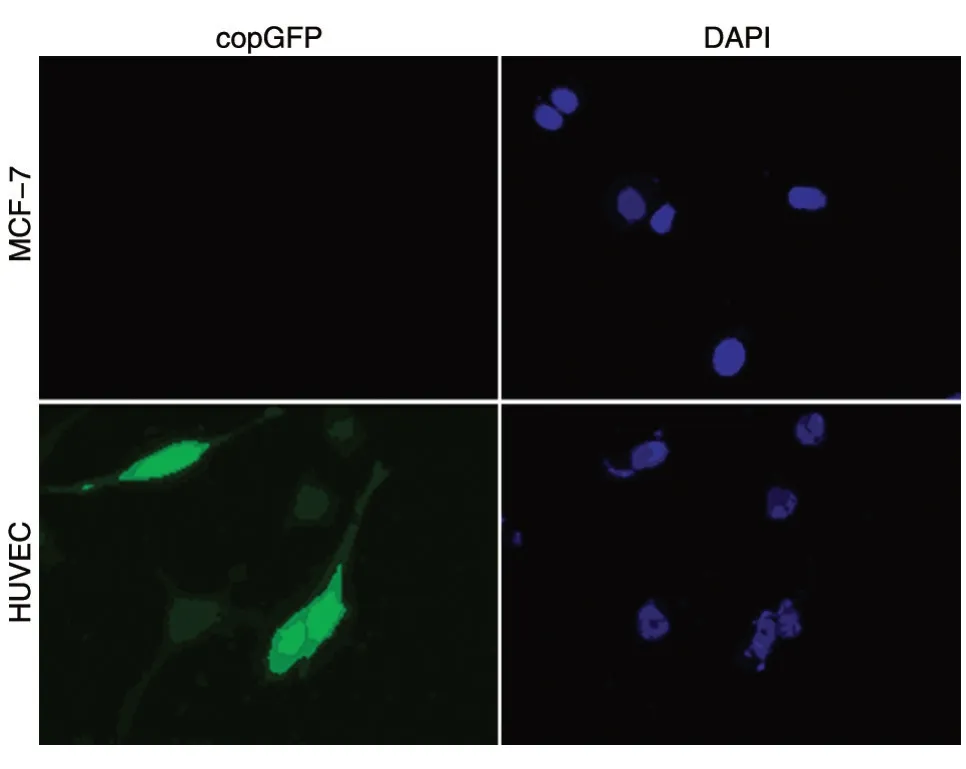
图5 CD31 启动子在HUVEC 细胞系与阴性对照MCF-7 细胞系中的表达
3 讨论
目前,对于血管内皮细胞的鉴定大部分是通过鉴定其特异性标志物来实现的,由此衍生出许多方法,如Q-PCR、流式分选、Western 印迹、免疫荧光;也有根据内皮细胞的功能进行鉴定,例如成管实验。但这些方法大部分步骤较为繁琐,实验周期较长,且结果往往不具有确定性,须几种方法结合共同证明内皮细胞的发生。
本实验通过将内皮细胞标志物CD31 的启动子构建在带有GFP 和萤光素酶的表达载体中,将载体转染目的细胞,通过荧光和萤光素酶的有无来鉴别目的细胞是否具有内皮细胞的特征性标志物,从而起到分选鉴别内皮细胞的作用。利用这种方法可极大地提高实验效率,只须构建含有内皮细胞标志物启动子的荧光和萤光素酶表达载体,再转染目的细胞,即可初步筛选出内皮细胞。此研究为鉴定血管内细胞提供了新的思路。
