重组人表皮生长因子包涵体的表达、纯化及复性
2018-04-10王强段云飞徐燕张超冷晓燕
王强,段云飞,徐燕,张超,冷晓燕
江苏迈健生物科技发展股份有限公司,江苏 无锡214000
表皮生长因子(epidermal growth factor,EGF)是人体内的一种活性多肽,由53 个氨基酸残基组成,相对分子质量约为6.2×103。EGF 的最大特点是能够促进细胞的增殖分化,从而以新生的细胞代替衰老和死亡的细胞[1]。EGF 还能止血,并具有加速皮肤和黏膜创伤愈合、消炎镇痛、防止溃疡的功效。20 世纪80年代以来,随着基因重组技术的发展,人们开始进行重组人EGF(recombi⁃nant human EGF,rhEGF)的大规模生产尝试[2]。迄今,hEGF 基因已被克隆并在多种系统中得到表达,但表达量偏低,生物活性普遍不高,难以实现大规模工业化生产[3-4]。我们通过改变hEGF 基因的cDNA 结构,同义密码子置换核苷酸序列中个别基因的碱基,选择一种密码子偏好性最优的rhEGF 优化序列构建原核表达载体,使其在大肠杆菌宿主中能够得到高水平的表达。这对于hEGF 产业化高效制备及应用具有重要意义。
1 材料与方法
1.1 材料
BALB/c3T3 细胞购自中国科学院细胞库;大肠杆菌BL21(DE3)购自天根生化科技(北京)有限公司;表达载体pET30a 由军事医学研究院放射与辐射研究所馈赠;hEGF 标准品购自上海普欣生物技术有限公司;胰蛋白胨、酵母提取物购自Oxoid 公司;MTT 购自北京索莱宝科技有限公司;亲和色谱填料购自常州天地人和生物科技有限公司;其他生化试剂均为国产分析纯产品。
1.2 rhEGF基因序列优化
根据密码子的兼并性,在hEGF 活性肽氨基酸排列顺序不变的情况下,采用生物软件Vector NTI Suitor 7.0 分 析hEGF核酸序列(GenBank,ID1950),对hEGF 进行基因改造优化,将hEGF 原基因序列中大肠杆菌稀有密码子改成偏好密码子,以提高目的基因在大肠杆菌中的高水平表达,同时5′端加人PelBL 信号肽序列,有助于提高蛋白表达量和可溶性,3′端融合His 标签,可方便后期纯化,设计合成hEGF 全长序列。
1.3 rhEGF基因克隆与诱导表达
对合成的含rhEGF 全序列的载体pUC-rhEGF用限制性内切酶NdeⅠ/XhoⅠ于37℃酶切过夜,琼脂糖胶回收酶切后的小片段,与同样经双酶切的表达载体pET-30a 在T4DNA 连接酶的作用下于16℃过夜连接,连接产物转化感受态大肠杆菌DH5α 后,挑选阳性克隆,提取质粒,送上海生工公司测序,取测序结果同预期结果完全一致的菌落保存。将携带hEGF 序列的原核表达载体命名为pET-30a-rhEGF。
将测序正确的质粒转化大肠杆菌BL21(DE3),挑选阳性克隆,将构建好的工程菌接种到加有卡那霉素的LB 培养基中,于摇床中37℃过夜培养,次日以1∶100 的比例接种到200 mL 新鲜的含卡那霉素的LB 培养基中,4~5 h 后菌液的D600nm值达0.6 以后,加入诱导剂IPTG 至终浓度为0.5 mmol/L,37℃诱导4 h,离心,收集菌体沉淀,重悬于30 mL 含1 g/L 溶菌酶的PBS 中,混匀后4℃过夜酶解,超声波破碎,离心,收集沉淀和上清,进行15% SDS-PAGE,分析目的蛋白在原核系统内的表达量和表达形式。
1.4 rhEGF包涵体的纯化和复性
电泳鉴定rhEGF 以包涵体形式存在。收集包涵体沉淀,用1% Triton X-100 洗涤3 次,4℃、12 000 r/min 离心收集沉淀,用含尿素的缓冲液(8 mol/L 尿素,0.1 mol/L Tris-HCl,0.1 mol/L Na2HPO4,pH8.0)于4℃溶解过夜,保证沉淀得到最大程度地溶解。取溶解后的上清过Ni 亲和层析柱,先用平衡缓冲液(8 mol/L 尿 素,0.1 mol/L Tris-HCl,0.1 mol/L Na2HPO4,pH8.0)平衡Ni 柱,上样结束后用洗涤缓冲液(8 mol/L 尿素,0.1 mol/L Tris-HCl,0.1 mol/L Na2HPO4,pH6.3)洗涤Ni 柱,最后用洗脱缓冲液(8 mol/L 尿素,0.1 mol /L Tris-HCl,0.1 mol/L Na2HPO4,pH4.0)洗脱样品。将Ni 柱纯化的rhEGF 加入复性液(0.1 mol/L Tris-HCl,0.1 mol /L Na2HPO4,3 mmol/L 还原型谷胱甘肽,0.3 mmol/L 氧化型谷胱甘肽,5%甘油,pH8.0)至终浓度约为0.1 g/L,此时尿素浓度为0.8 mol/L,在4℃条件下复性并不断搅拌,复性16 h,复性完成后复性液用G25 凝胶柱脱盐,并洗脱至PBS 缓冲液中,用超滤浓缩管进行超滤浓缩获得最终样品。
1.5 rhEGF的相对分子质量、纯度与活性检测
参照2015年版《中国药典》,用还原型SDSPAGE 测定相对分子质量,分离胶浓度为17.5%,加样量不低于1 μg(考马斯亮蓝R250 染色法)。经扫描仪扫描,相对分子质量应与对照品相近。
参照2015年版《中国药典》,用非还原型SDS-PAGE 测定纯度,分离胶浓度为17.5%,加样量不低于10 μg(考马斯亮蓝R250 染色法)。经扫描仪扫描,计算得纯度。
参照2015年版《中国药典》,用高效液相色谱法测定纯度,使用C18柱,以A 相(三氟乙酸-水溶液:量取1 mL 三氟乙酸加水至1 L)、B 相(三氟乙酸-乙腈溶液:量取1 mL 三氟乙酸加入色谱纯乙腈至1 L)为流动相,在室温条件下进行梯度洗脱(0~70% B 相),上样量不低于10 μg,在波长280 nm 处检测,以hEGF 色谱峰计算的理论塔板数不低于500,按面积归一化法计算纯度。
参照2015年版《中国药典》,用BALB/c3T3 细胞增殖/MTT 比色法测定活性。BALB/c3T3 细胞用RPM1640 培养基培养,将对数生长期的细胞按5×103/孔加入96 孔细胞培养板,24 h 后更换成含0.4%胎牛血清的RPM1640 培养基继续培养24 h,依次加入用维持培养液稀释的不同浓度的EGF样品,做8 个浓度梯度,梯度之间1/4 稀释,每浓度梯度做3 个平行孔,37℃、5% CO2条件培养72 h,MTT 法检测各孔的D570nm和D630nm值,采用四参数回归计算法计算rhEGF 的活性。
2 结果
2.1 rhEGF表达载体构建
用NdeⅠ/XhoⅠ双酶切含rhEGF 全序列的载体pUC-rhEGF,回收酶切后的小片段,通过连接酶克隆到表达载体pET-30a 中,筛选阳性克隆,提取质粒pET-30a-rhEGF,经NdeⅠ/XhoⅠ双酶切鉴定,10 g/L 琼脂糖电泳结果显示酶切后生成的条带约为250 bp(图1)。将重组质粒测序,结果证明所构建的表达载体基因的核苷酸序列与设计序列一致(图2)。
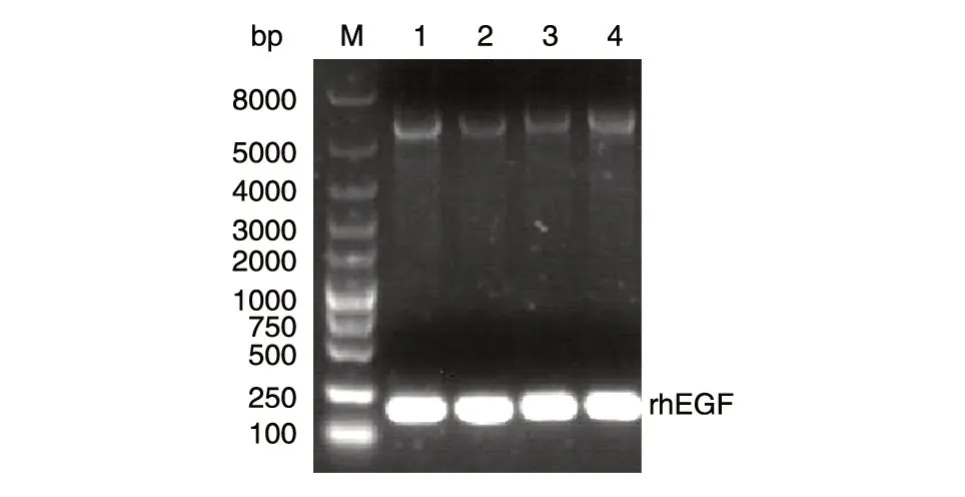
图1 pET-30a-rhEGF 双酶切产物的琼脂糖电泳

图2 基因测序图谱分析
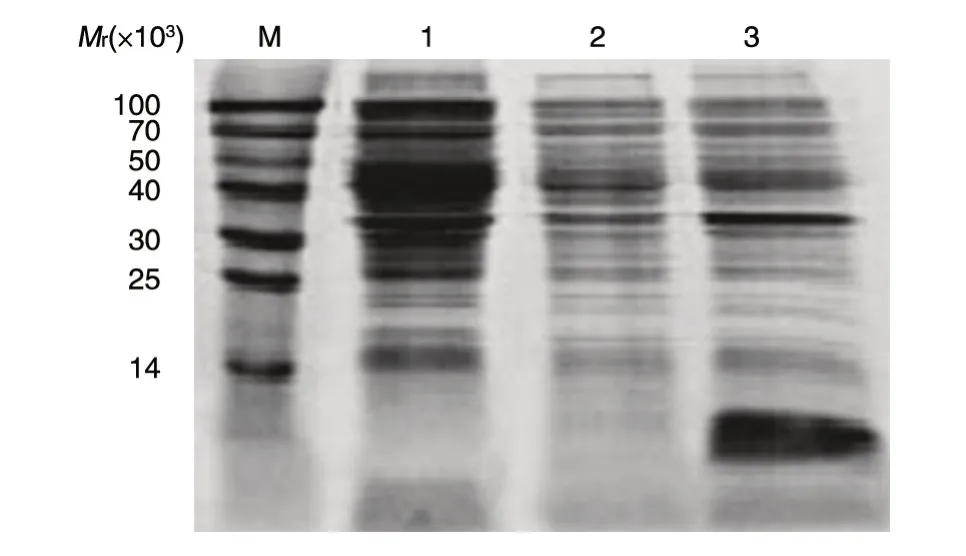
图3 rhEGF 原核表达形式的SDS-PAGE 分析

图4 rhEGF 纯化后SDS-PAGE 分析
2.2 rhEGF的原核表达
取测序正确的质粒转化大肠杆菌BL21(DE3),将重组菌接种至含卡那霉素的LB 培养基中,37℃振荡培养,菌液D600nm值约为0.6 时加入IPTG 诱导表达4 h,离心收集沉淀,超声波破碎,15% SDS-PAGE 分析目的蛋白的表达量和表达形式,结果如图3。诱导后rhEGF 明显表达,且基本以包涵体的形式存在于超声波破碎后的菌体沉淀中,增加信号肽并没有显著提高rhEGF 的可溶性,但由于信号肽在表达过程中被切除,未对rhEGF 的相对分子质量产生明显影响,而在后期的生物活性鉴定中表现出高于对照品的较高的活性,所以仍保留了信号肽序列。
2.3 包涵体蛋白的纯化和复性
用Triton X-100 洗涤包涵体,除去脂类和降解的核酸,然后用8 mol/L 尿素溶解。取变性后的上清液过Ni 亲和层析柱,由图4 可以看到,经Ni 柱纯化后,杂蛋白基本被去除,只显示相对分子质量6.5×103左右的单一蛋白条带,一步纯化的纯度可达90%以上。对洗脱上清稀释复性,整个复性过程均没有沉淀产生。
2.4 电泳法测定rhEGF的相对分子质量
取最终浓缩的rhEGF 样品进行SDS-PAGE 检测,结果如图5。由于rhEGF 融合有His 标签,相对分子质量略大于对照品,约为6.5×103。
2.5 电泳法和高效液相色谱法测定rhEGF纯度
取最终浓缩的rhEGF 样品进行非还原SDSPAGE,结果如图6,经Image J 软件扫描纯度可达96.8%。取最终浓缩的rhEGF 样品,用高效液相色谱法测定纯度,按面积归一化法计算得纯度为92.8%(图7)。
2.6 MTT法测定rhEGF活性
按照药典附录XH,采用细胞增殖法/MTT 比色法测定活性。培养72 h 后去除上清,每孔加入100 μL DMSO,用酶标仪振荡96 孔板并测定D570nm和D630nm值,结果如表1。分别将rhEGF 标准品及样品蛋白浓度对各自的吸光值做图,在0~16 μg/L 浓度范围内进行四参数回归计算(图8)。标准品及样品的方程分别为y=(0.75021-0.53151)/[1+(x/0.05088)-0.34732]+0.53151、y=(0.67033-0.43905)/[1+(x/0.00171)-0.57661]+0.43905,相关系数(R2)分别为0.99407 和0.99310。采用四参数回归计算法处理数据,并按下式计算结果:

式中,Pr为标准品生物学活性,Ds为供试品预稀释率,Dr为标准品预稀释率,Es为供试品相当于标准品半效量的稀释率,Er为标准品半效量的稀释率。
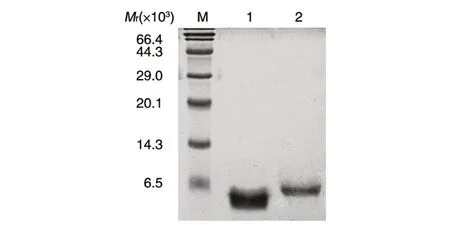
图5 电泳法测定rhEGF 的相对分子质量
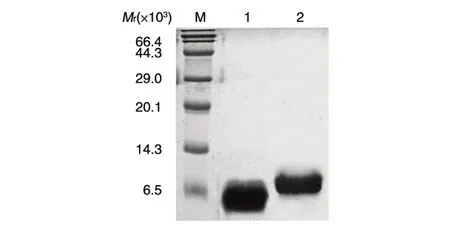
图6 电泳法测定rhEGF 的纯度
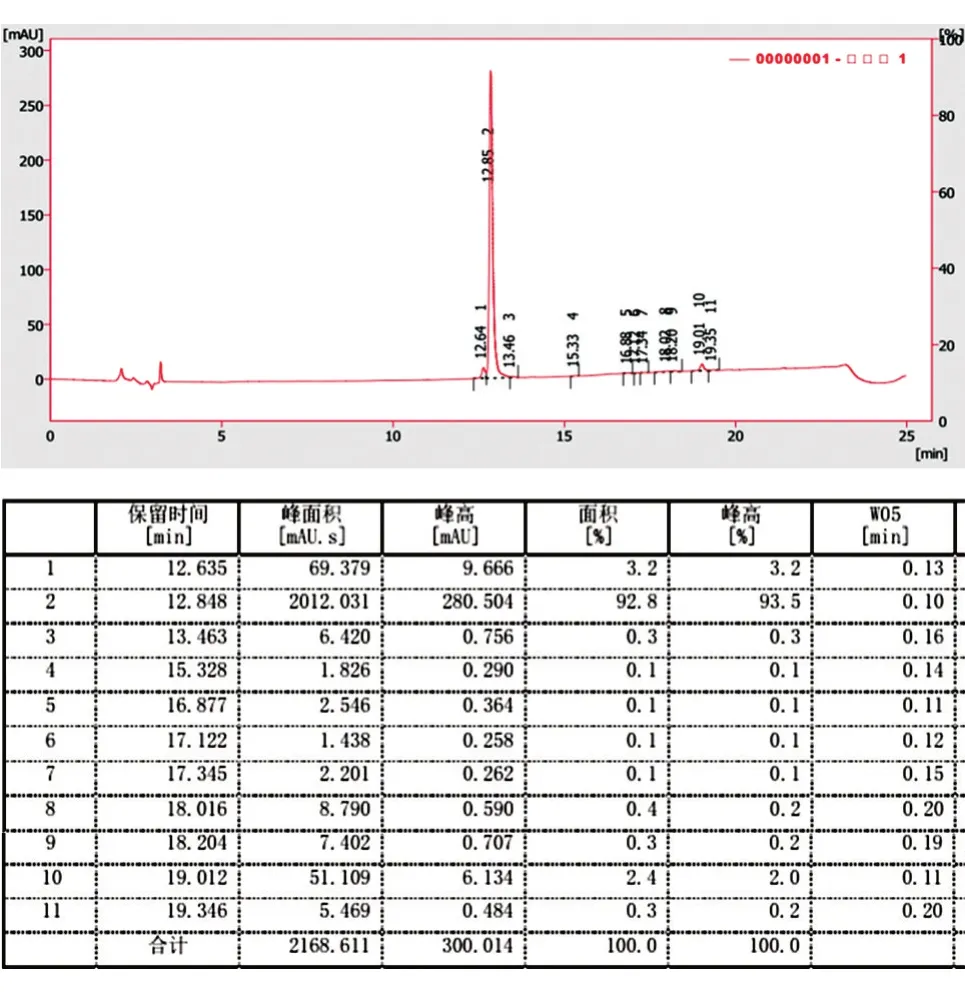
图7 高效液相色谱法测定rhEGF 的纯度
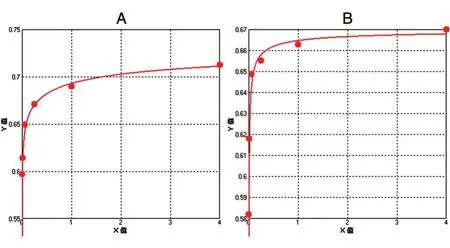
图8 rhEGF 标准品(A)与纯化样品(B)的四参数回归曲线

表1 rhEGF细胞活性MTT法检测结果统计
经计算,rhEGF 活性约为1.29×106IU/mL,比活性约为4.94×107IU/mg。本实验中使用的标准品生物活性为1×107IU/mg,制备获得的rhEGF 生物活性高于标准品。
3 讨论
EGF 的诸多生物学功能使其在创伤治疗和化妆品领域有着广泛的应用,随着研究的深入,人们发现它在抗肿瘤的临床应用方面也有广阔前景[5],因此,获得大量有生物活性的hEGF 尤为必要,然而hEGF 的应用始终受到其产量问题的制约[6]。我们根据原核表达系统的喜好,对rhEGF 的基因序列进行了同义置换,实现了其在原核表达系统内的优势表达,从而能够大量获得rhEGF 的包涵体,经Ni 柱纯化并稀释复性后可得到具有较高活性的rhEGF,相对分子质量约6.5×103,生物活性可达4.94×107IU/mg。这使得大量生产高纯度、高活性的rhEGF 成为可能,为后期大规模生产奠定了基础。
