TACE治疗肝癌伴门脉癌栓患者的预后分析
2018-03-29杜小丽刘庆文吴春苗刘西平
崔 鹏, 杜小丽, 周 瀚, 刘庆文, 郭 赟, 吴春苗, 刘西平
肝细胞癌(HCC)是在全球恶性肿瘤患者中日益上升[1],在中国发病率尤其突出。TACE已是一种成熟的治疗中晚期HCC的方法。而HCC极易侵犯门脉形成门脉癌栓(PVTT),它已经成为影响肝癌介入预后的主要因素[2]。根据巴塞罗那分期中晚期肝癌的治疗国内外推崇TACE治疗,中位生存期可达11个月[3-4]。本文对筛选出的46例患者进行多因素分析,探讨患者的预后及生存期。
1 材料与方法
1.1 患者选取
收集2010年1月—2016年3月接受TACE治疗的HCC伴PVTT的患者,HCC诊断由各类临床生化检查、MRI、CT及病理组织学检查来证实。HCC中无病理结果的均按照卫生部制定的原发性肝癌诊断依据[5],最终筛选出 46例患者。
1.2 方法
1.2.1 TACE技术 采用飞利浦DSA Allura Xper FD20平板数字减影机。采用Seldinger技术穿刺股动脉,成功后置入5 F动脉短鞘。沿鞘送入导管,将导管送入肠系膜上动脉,行间接门脉造影,再将肝管送入肝固有动脉行肝动脉造影,明确肿瘤范围及有无动静脉瘘。化疗灌注应用铂类药物,栓塞时用表柔比星与碘油的混合乳剂。栓塞完毕再次造影,观察肿瘤内碘油沉积情况。
1.2.2 疗效评价的方法与标准 定期随访患者,一般间隔4~6周复查肝脏增强CT或MRI以评价碘油沉积情况及增强病灶范围,根据mRECIST标准,TACE术后4周观察患者病灶内强化范围进行分类[6-9]。目前国内外尚无对单独癌栓的评价方式,所以此文只对肝脏肿瘤进行评价。
1.3 统计学分析
所有资料均应用SPSS16.0统计软件进行分析,用Kaplan-Meier法绘制生存曲线,用Log-Rank法对肝癌伴门脉癌栓患者生存预后因子进行分析,对单因素中有意义的影响因子建立Cox比例风险回归模型,进行多因素分析。生存率采用寿命表发推算。
2 结果
2.1 一般资料
患者共46例,其中男38例,女8例,年龄30~79岁,平均53岁。首发癌栓的患者29例,迟发癌栓的患者 17例,46例患者中,完全缓解(CR)1例(2.1%),部分缓解(PR)11 例(23.9%),稳定(SD)16例(34.8%),进展(PD)18例(39.2%)。患者临床资料情况见表1。
2.2 生存分析
46例患者6、12、18和24个月的生存率分别为51.2%、28.9%、23.4%和10.2%,中位生存时间为6.7个月。通过Log-Rank法分析局部肿瘤反应(P<0.001)、胆碱酯酶(CHE)(P=0.029)、动静脉瘘(P=0.005)、腹水(P=0.010)与患者生存期有密切关系。我们对34项潜在预后因子进行统计学分析,其中有10项因子在单因素分析中有统计学意义,有4项因子在多因素分析中有意义。总生存曲线及46例患者的局部肿瘤反应、CHE、动静脉瘘、腹水通过Log-Rank方法分析如图1~5、表2。

表1 入选患者的基本情况 n=46
2.3 Log-Rank分析
本研究假设首发癌栓与继发癌栓的生存率有差别,Log-Rank方法分析如图6所示。对不同位置的癌栓分型进行Log-Rank分析,结果如图7所示。
3 讨论

图1 46例肝癌伴门脉癌栓患者总生存曲线(Kaplan-Meier法)

图2 对TACE不同反应肝癌患者的生存曲线

图3 不同CHE肝癌患者的生存曲线

图4 有无动静脉瘘肝癌患者的生存曲线

图5 不同腹水量肝癌患者的生存曲线
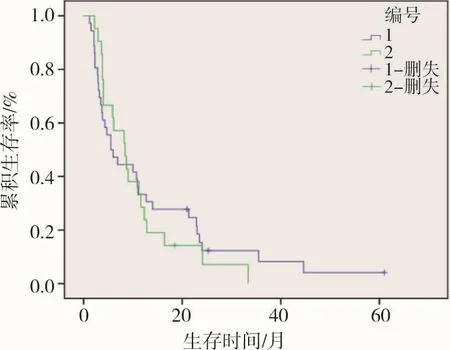
图6 首发癌栓(29例)与继发癌栓(17例)患者的生存率比较(Log-Rank法),P=0.748

图7 46例患者癌栓分型的生存分析(Log-Rank法),P=0.571表明无意义
HCC门脉癌栓发生机制较复杂,肝脏由肝动脉及门静脉双重供血,回心血流入肝静脉,肝动脉和门静脉小分支存在广泛的吻合,动、门脉血流在肝血窦内压力保持平衡。肝脏肿瘤会使肝血窦阻力增高时促使肝动脉自动调节增加流速流量,导致这些吻合支增多扩大在小分支近端[10-13]。肝细胞与肝血窦间无严密屏障,肝癌癌栓结构又疏松,故癌组织极易通过肝血窦间结构进入肝血窦,而部分癌块可将肝静脉小分支阻塞,造成肝脏肿瘤的出瘤血管成为门静脉,肝脏肿瘤可突破肝包膜向外浸润生长,而门脉血管壁较薄极易受侵犯,肝静脉壁薄压力小极易被肿瘤压闭,再加上肝脏肿瘤内与门脉内的压力差,癌细胞会向门脉里逆行生长,在有包膜包绕的肿瘤内这种情况更加明显,国外学者于肝动脉造影时发现PVTT显影,以此推断门脉癌栓亦是由肝动脉供血,门脉小血管变为出瘤血管,以此可以给TACE治疗肝癌伴门脉癌栓一个依据。而部分学者在尸检中发现,门脉癌栓周围细小动脉分支延伸至瘤栓内对其有血液供应,更加充分证明TACE治疗可对门脉癌栓产生积极影响[14-16]。

表2 46名肝癌伴门脉癌栓患者的单因素及多因素分析
CHE是一种催化酰基胆碱水解的酶类,CHE下降程度与患者的生存期成明显正相关,其中,CHE<2 000 IU/mL的患者中位生存期仅为(2.20±0.14)个月。该结果显示CHE是此类患者重要的预后因子,监测血液中CHE活性简单、快捷、廉价,可在临床工作中对医师的诊断、治疗及判断预后占据重要位置[17-19]。
在对有动静脉瘘患者的TACE治疗时我们要注意化疗药的用量,碘油的应用及栓塞方式的选择,对于该类患者我们通常先将瘘口堵塞,造影确认后选择更低计量的化疗药及碘油,以免引起呕吐至消化道出血,肝功能下降及胆红素升高等并发症。据报道,动静脉瘘导致肝内肿瘤血流动力学改变,导致碘油于肿瘤内沉积不良较快冲刷掉,所以部分患者应用明胶海绵颗粒混合栓塞[20-23]。动静脉瘘同时可以加速肿瘤在肝内及血液内的转移与播散,无动静脉瘘与有动静脉瘘患者的中位生存时间分别为(6.7±1.6)、(2.5±0.7)个月(P=0.005)。
TACE治疗后局部肿瘤的反应是患者的又一个重要的预后因子,本研究结果表明在单因素及多因素分析中其均是HCC伴PVTT患者评价生存预后的重要指标(P均<0.001)。根据mRECIST评价标准,完全缓解者(CR)1 例(2.1%),部分缓解者(PR)11 例(23.9%),稳定者(SD)16 例(34.8%),进展者(PD)18 例(39.2%),46 位患者 6、12、18、24 个月的生存率分别为51.2%、28.9%、23.4%、10.2%,中位生存时间为6.7个月。从前认为HCC伴PVTT是TACE的禁忌证,后经过大量医者证明后经过TACE治疗的患者比未接受TACE治疗的患者生存期长[24]。因此TACE治疗后局部肿瘤的反应对于患者生存时间有重要意义。
2004年程树群等[25]提出了癌栓的分型。有学者指出对于不同类型的PVTT患者,PVTT侵犯程度越轻,患者的生存情况越好,对于肿瘤局限且全身状态良好的患者,PVTT不应作为TACE治疗的禁忌证[26-28],而本文研究结果TACE对不同癌栓分型治疗上无统计学差异,我们考虑可能是由于本研究样本量小,患者的生存期整体偏短所致,希望将来继续扩大样本量令结果更加信服。
总之,本研究证明了TACE治疗HCC伴PVTT与患者生存期有着密切关系,并不能将PVTT作为TACE的禁忌证。各项预后因子中对生存期具有独立影响因子的有:局部肿瘤反应、CHE、动静脉瘘、腹水,在临床工作中我们对于肝功能里的CHE可多观察,而TACE治疗在首发癌栓与迟发癌栓患者中生存率无明显差别。
[1] 姚雪松,闫 东,曾辉英,等.TACE联合索拉非尼治疗不能手术切除肝细胞癌50例[J].介入放射学杂志,2013,22:381-386.
[2] Yoon SM, Lim YS, Won HJ, etal.Radiotherapyplus transarterial chemo-embolization for hepatocellular carcinoma invading the portal vein: long-term patient outcomes[J].Int J Radiat Oncol Biol Phys, 2012, 82: 2004-2011.
[3] Nakamoto Y, Mizukoshi E, Kitahara M, et al.Prolonged recurrencefree survival following OK 432-stimulated dendritic cell transfer into hepatocelluar carcinoma during transarterial embolizationg[J].Clin Exp Immunol, 2011, 163: 165-177.
[4] Chok KS, Cheung TT, Chan SC, et al.Surgical outcomes in hepatocelluar carcinoma patients with portal vein tumor thrombosis[J].World J Surg, 2014, 38: 490-496.
[5] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].实用癌症杂志, 2011, 16: 929-946.
[6] 余文昌,张孔志,陈示光,等.实体瘤反应评价标准、欧洲肝病学会和改良实体瘤反应评价标准评价原发性肝癌化疗栓塞效果一致性的比较[J].中华放射学杂志,2011,45:78-79.
[7] El-Serag HB.Epidemiology of viral hepatitis and hepatocellular carcinoma[J].Gastroenterology, 2012, 142: 1264-1273.
[8] 李海伟,魏 宏,罗娅红,等.奥沙利铂介入栓塞并留管灌注联合替吉奥口服治疗胃癌术后肝转移的近期疗效[J].山东医药,2014,54:64-65.
[9] Kudo M, Arizumi T, Ushima K, Assessment for retreatment(ART) score for repeated transarterial chemoembolization in patients with hepatocellular carcinoma[J].Hepatology, 2014,59:2424-2425.
[10] Zhang XB,Wang JH,Yan ZP,et al.Hepatocellular carcinoma with main portal vein tumor thrombus:treatment with 3-dimensional conformal radiotherapy after portal vein stenting and transarterial chemoembolization[J].Cancer, 2010, 115: 1245-1252.
[11] Liu S, Guo W, Shi J, et al.MicroRNA-135a contributes to the developmentofportalvein tumorthrombusby promoting metastasis in hepatocellular carcinoma[J].J Hepatol, 2012, 56:389-396.
[12] Raoul JL, Gilabert M, Piana G.How to define transarterial chemoembolizationfailureorrefractoriness:aEuropeanperspective[J].Liver Cancer, 2014, 3: 119-124.
[13] Murphy TP.Society of Interventional Radiology 2012 presidential address[J].J Vasc Interv Radiol, 2012, 23: 987-988.
[14]刘 崎,贾雨辰,贺 隹,等.肝癌合并门脉癌栓的化疗栓塞治疗[J].中华放射学杂志, 2010, 29: 239.
[15] Edeline J, Boucher E, Rolland Y, et al.Comparison of tumor response by Response Evaluation Criteria in Solid Tumors(RECIST) and modified RECIST in patientstreated with sorafenib for hepatocellular carcinoma[J].Cancer, 2012, 118:147-156.
[16] Lencioni R, Llovet JM.Modified RECIST(mRECIST) assessment for hepatocellular carcinoma[J].Semin Liver Dis, 2010, 30:52-60.
[17] Shim JH,Lee HC,Kim SO,et al.Which response criteria best help predict survival of patients with hepatocellular carcinoma following chemoembolization?A validation study of old and new models[J].Radiology, 2012, 262: 708-718.
[18]吴建华,夏先考.动态监测血清胆碱酯酶活性判断慢性肝病预后[J].广东医学, 2004, 25: 292-293.
[19] Sano T,Sasako M,Kinoshita T,et al.Recurrence of early gastric cancer.Follow up of 1475 patients and review of the Japanese literature[J].Cancer, 2011, 72: 3174-3178.
[20] Roayaie S, Jibara G, Tabrizian P, et al.The role of hepatic resection in the treatment of hepatocellular cancer[J].Hepatology,2015,62:440-451.
[21] Vogl TJ, Nour-Eldin NE, Emad-Eldin S, et al.Portal vein thrombosis and arterio-portal shunts:effects on tumor response after chemoembolization of hepatocellular carcinoma[J].World J Gastroenterol, 2011, 17: 1267-1275.
[22]刘 昕,吕维富.影像学评价TACE治疗肝癌的疗效[J].中国介入影像与治疗学,2012,9:136-138.
[23] Lencioni R.Chemoembolization in patients with hepatocellular carcinoma[J].Liver Cancer, 2012, 1: 41-50.
[24] Xu C, Lü PH, Huang XE, et al.Efficacy of transarterial chemoembolization combined with radiofrequency ablation in treatment of hepatocellular carcinoma[J].Asian Pac J Cancer Prev, 2015, 16: 6159-6162.
[25]程树群,吴孟超,陈 汉,等.癌栓分型对肝细胞性肝癌合并门静脉癌栓治疗及预后的指导意义[J].中华医学杂志,2004,84:3-5.
[26]张 磊,陆骊工,李 勇,等.门静脉支架联合肝动脉化疗栓塞治疗肝癌伴门静脉癌栓的临床研究[J].介入放射学杂志,2011, 20:968-973.
[27]贾 佳,祁兴顺,韩国宏.肝动脉化疗栓塞在肝细胞肝癌合并门静脉癌栓患者中的应用[J].介入放射学杂志,2014,23:352-356.
[28]毛晓楠,卢再鸣,郭启勇.门静脉支架联合125I粒子条植入治疗门脉癌栓12例[J].介入放射学杂志,2016,25:1058-1064.
