高效液相色谱法测定车前草中大车前苷和车前苷的含量
2018-03-27朱冰张勇
朱冰 张勇
关键词:车前草;大车前苷;车前苷;高效液相色谱
中图分类号:R917
文献标识码:A
车前草药源丰富,价格低廉,具有清热利尿、祛痰、凉血、解毒等功效,为车前科植物车前(Planttago asiatica)或平车前(P. depressa)的干燥全草。《中华人民共和国药典》规定车前草的专属性成分大车前苷为其主要药用有效成分及其含量标准。大车前苷为苯乙醇苷类化合物,药理研究表明苯乙醇苷类化合物具有利尿、抗炎、解痉等功效,与车前草的功效吻合。迄今为止,从车前草中分离鉴定的化合物还包括黄酮类、环烯醚萜类、三萜类、多糖等。黄酮类化合物是车前草中另一主要活性成分,已建立了高效液相色谱法分析车前草中槲皮素、木犀草素、黄芩素等黄酮苷元的含量。车前苷具有抗氧化、蛋白激酶抑制等活性,是从车前草中分离并鉴定的一个黄酮类化合物,但尚未见其含量测定的研究报道。鉴于苯乙醇苷类和黄酮类化合物对车前草质量评价和后继开发利用的重要性,应建立高效液相色谱法测定车前草中大车前苷和车前苷的含量,为车前草药材及其临床产品的质量标准提供参考,为车前草的进一步合理开发提供依据。
一、实验部分
1. 仪器与试剂
安捷伦1260高效液相色谱仪(Agilent Technologies,Santa Clara,CA),包括四元泵、自动进样器、恒温箱和二极管阵列检测器。
车前草购于本地药店,大车前苷标准品购自上海同田生物有限公司,车前苷标准品购自南京安美科技有限公司。色谱纯甲醇和醋酸购自美国Fisher公司,其他分析纯试剂均购自国药集团化学试剂有限公司,水为超纯水。
2.色谱条件
色谱柱:Waters Symmetry C18色谱
柱(250 mm × 4.6 mm i.d.);预柱:菲
罗门C18 (4.0 mm×3.0 mm,Phenomenex,
Torrance,CA)。流动相:溶剂A(0.4%醋酸水溶液)和溶剂B(甲醇),梯度洗脱过程为0~30 min,35%~45% B;流速:0.7 mL/min;柱溫:25℃;检测波长:330 nm;进样量:20 μL。
3.车前草提取物溶液的制备
将车前草粉碎,精密称取样品100.00 g至圆底烧瓶中,用100 mL 70%的乙醇85℃回流提取三次,每次2 h,合并滤液过滤后旋转蒸发仪减压浓缩成浸膏,得到7.40 g粗提物。精密称取0.5 g 粗提物,用甲醇溶解并定容至10 mL容量瓶中,用0.45 μm滤膜过滤得供试品溶液(50.0 mg/mL)。
二、 结果与讨论
1.色谱条件的选择及优化
大车前苷为苯乙醇苷类化合物,其紫外扫描最大吸收波长为254,300sh,330 nm;车前苷为黄酮类化合物,其紫外扫描最大吸收波长为285,332 nm。为了同时灵敏地检测大车前苷和车前苷,选择检测波长为330 nm。
在测定大车前苷和车前苷时,考虑到两种目标化合物为多酚类化合物,在流动相中加入醋酸抑制酚羟基的离解。以甲醇–0.4%醋酸水、乙腈–0.4%醋酸水作为流动相,在不同梯度洗脱程序下的HPLC谱图发现,以乙腈–0.4%醋酸水作为流动相梯度洗脱时,目标化合物与相邻物质基本分开,且目标化合物峰形对称性高。因此,在流速为0.7 mL/min时,选用0.4%醋酸水溶液(A)和甲醇溶液(B)为流动相进行梯度洗脱: 0~30 min,35~45% B。色谱图见下图。通过与标准品的保留时间对比分析,主要化合物1和2被鉴定为大车前苷和车前苷。

2. 方法的线性范围与检出限
将大车前苷和车前苷的混合对照品储备液用甲醇稀释成5个浓度系列的混合对照品标准工作液,在上述色谱条件下进行HPLC分析,记录峰面积,以对照品浓度X (μg/mL)对其峰面积的平均积分值(Y)进行线性回归,得回归方程、线性范围、相关系数以及检出限(S/N =3)(表1)。结果表明:大车前苷和车前苷因在5.0~250.0 μg/mL范围内线性关系良好。

3. 方法的精密度、稳定性、重现性和回收率
对同一混合对照品溶液重复测定6次,每次进样20 μL,测定峰面积,然后得大车前苷和车前苷的RSD分别为0.29 %、0.45 %,表明精密度良好;连续重复测定3天,大车前苷和车前苷峰面积的RSD分别为0.93 %、0.78 %,这说明对照品溶液在3天内稳定性良好;对同批样品分别制备混合对照品,测定大车前苷和车前苷峰面积的RSD分别为0.38 %和0.41%,这表明同批次样品重现性良好。
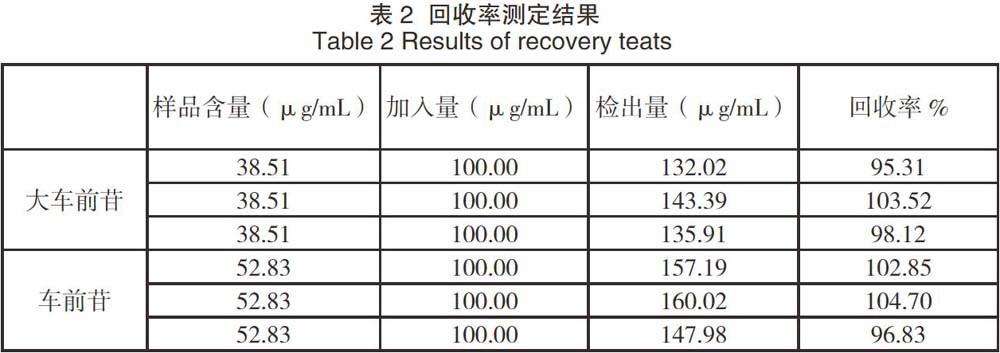
经过测定,取绿原酸和咖啡因含量分别为38.51 μg/mL和52.83 μg/mL的车前草溶液3份,每份各1 mL,分别加入浓度为200.00 μg/mL的混合对照品溶液1 mL,混合的2 mL溶液,分别进样20 μL(结果见表2),回收率95.31%~104.70%,说明加标回收率良好,准确度高。
4. 样品检测
测定样品3次,根据标准曲线计算出大车前苷和车前苷的含量分别为2.85 ± 0.11mg/g和3.91 ± 0.18 mg/g。
三、结论
本实验首次建立了HPLC法同时测定车前草中车前苷和车前苷含量的方法,所建立的测定方法简便、重复性好、精密度高,为车前草的质量控制提供了参考依据。
参考文献:
[1]国家药典委员会.中华人民共和国药典.一部[M].北京:中国医药科技出版社,2015.
[2]孙 虔,耿 放,程雪梅,等.车前草中大车前苷的定性和定量分析[J].中国中药杂志,2010(16).
[3]许兵兵,黄碧涛,曾金祥,等.车前子和车前草中毛蕊花糖苷和异毛蕊花糖苷的含量比较[J].中国实验方剂学杂志,2016(18).
[4]夏玲红,金冠钦,孙 黎,等.车前草的化学成分与药理作用研究进展[J].中国药师,2013(2).
[5]杨亚军,周秋贵,曾 红,等.车前草化学成分及新生物活性研究进展[J].中成药,2011(10).
[6]王锦军,张秀梅,王宏林.反相高效液相色谱法同时测定车前草中槲皮素、木犀草素、山柰酸、芹菜素的含量[J].中成药,2009(5):772-775.
[7]李明娟,劉 磊,傅春燕,等.高效液相色谱法分析车前草中的黄酮化合物[J]. 光谱实验室,2013(3):1437-1443.
[8]Panuccio MR,Fazio A,Papalia T,et al. Antioxidant Properties and Flavonoid profile in leaves of Calabrian Lavandula Multifida L.,an Autochthon Plant of Mediterranean Southern regions [J]. Chemistry & Biodiversity, 2016, 13(4).
[9] Baier A, Galicka A, Nazaruk J., et al. Selected flavonoid compounds as promising inhibitors of protein kinase CK2α and CK2α', the catalytic subunits of CK2 [J]. Phytochemistry, 2017(136): 39-45.
[10]张雪芹,曲 玮,梁敬钰.车前草化学成分和药理作用研究进展[J].海峡药学,2013(11):1-8.
[11]陆 萱.车前草研究述论[J].南阳师范学院学报, 2011(6).
[12]孔 阳,马养民,李彦军,等.车前草提取物抗菌活性的研究[J].中国酿造, 2010(10).
[13]夏道宗,刘杰尔,陈佩佩.车前草总黄酮清除自由基及对小鼠氧化损伤的保护作用[J].科技通报, 2009(6).
[14]肖怀秋,李玉珍.车前草粗多糖提取及抗氧化试验[J].氨基酸和生物资源, 2009(3).
[15] 张建民,肖小年,易 醒, 等.车前草可溶性膳食纤维的提取及其对自由基清除能力的研究[J].天然产物研究与开发,2007(4).
[16]邹盛勤.车前草中乌索酸和齐墩果酸含量的反相高效液相色谱法测定[J].时珍国医国药,2006(11).
[17]曾金祥,毕 莹,魏 娟,等.车前草提取物降低急性高尿酸血症小鼠血尿酸水平及机理研究[J].时珍国医国药,2013(9).
