热处理时间对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响
2018-03-26韩宛君张鸿超耿浩程建军侯俊财
韩宛君,张鸿超,耿浩,程建军,侯俊财
(1.东北农业大学,乳品科学教育部重点实验室,哈尔滨150030;2.东北农业大学食品学院,哈尔滨150030;3.齐齐哈尔食品药品检验检测中心,黑龙江齐齐哈尔161000)
0 引言
乳清作为干酪生产的重要副产物[1],其蛋白质主要为-乳球蛋白和-乳白蛋白[2]。WPC(蛋白质质量分数≥34%)[3]和W PI(蛋白质质量分数≥90%)[4]为乳清产品,因其较高营养价值和良好功能特性广泛应用于食品中[5-6]。菜自建等[7]证明WPC能减缓酸奶分层和乳清析出。Puvanenthiran等[8]发现添加乳清蛋白的酸奶的凝胶变得致密。乳清蛋白具有提高胶原蛋白和提高乳清蛋白功能特性,热聚合乳清蛋白具有更好的热稳定性[11]。但加热时间对热聚合乳清浓缩蛋白(PWPC)和热聚合乳清分离蛋白(PWPI)的游离巯基含量、乳化性、乳化稳定性等的影响鲜有报道。因此,本文研究了加热时间对PWPC与PWPI游离巯基含量、黏度、乳化性等性质的影响,旨在为乳清蛋白的应用提供参考依据。骨破坏力的功能[9]。物理改性、化学改性等方法[10]可
1 实验
1.1 原料与试剂
乳清浓缩蛋白(WPC,蛋白质质量分数≥80%),乳清分离蛋白(W PI,蛋白质质量分数≥92%),其余化学试剂均为分析纯级。
1.2 仪器与设备
恒温磁力搅拌器,TU-1800紫外-可见光分光光度计,F-4500荧光分光光度计,IKA-T 18型均质机,JEM-1200EX透射电子显微镜,DYY-6B型稳压稳流电泳仪,DYCZ-23A型电泳槽,Zeta电位分析仪,Brook field DVⅡ数字旋转黏度计。
1.3 方法
1.3.1热聚合乳清蛋白的制备
分别配制质量分数为10%的WPC和W PI溶液,在磁力搅拌器上搅拌30 min,在4℃环境下静置8 h,充分水合后分别将调节pH=7(浓度为1 m ol/L的N aOH),然后在85℃下分别处理15,30,45,60min和90min,并迅速将温度降温至室温,4℃备用。
1.3.2游离巯基的测定
游离巯基的测定参照并改进Beveridge等[12]方法。取样品0.3 mL加入到含有5 mL浓度为8 mol/L的尿素T ris-G ly缓冲溶液(浓度0.086m ol/L的T ris溶液,0.09 m o l/L甘氨酸,0.004 m o l/L乙二胺四乙酸,pH=8.0和浓度8 m o l/L尿素),加入20μL的DTNB试剂后震荡混匀,在室温下静置15 min显色,利用紫外分光光度计在412 nm波长下测定吸光值,用空白对照组进行调零。
游离巯基含量(μm o l/g)=(73.53×A412×D)/C,
式中:A412为样品在波长为412 nm下的吸光值;C为固形物质量浓度(g/L);D为稀释系数。
1.3.3Zeta-电位的测定
Zeta-电位参照O’Brien等[13]
的方法,用质量分数为0.02%的磷酸盐缓冲液(浓度为0.1 m o l/L,pH=7.0)稀释样品,利用Zeta电位分析仪测量其蛋白质表面电位。
1.3.4黏度的测定
黏度的测定参照Liu等[14]的方法。利用Brookfield旋转黏度仪测定样品的黏度。转子型号为s62,温度为(25±0.1)℃,转速为 30 r/min,总测量时间为1min,每隔5 s取一个数据点,最终的黏度值为测定的平均值。
1.3.5内源色氨酸荧光光谱
内源色氨酸的测定参考并改进Tang等[15]的方法。使用5 mmol/L磷酸缓冲液(pH=7.0)分别稀释天然和热处理蛋白溶液质量浓度至0.05 g/L。采用F-7000荧光分光光度计记录样品的荧光光谱,激发波长为295 nm,发射波长为280~400 nm,激发和发射狭缝宽均为5 nm,电压为700m V。
1.3.6乳化性和乳化稳定性的测定
乳化性和乳化稳定性的测定采用Pearce等[16]的方法。取1 m g/mL的样品稀释液3 mL,将其与1 mL大豆油混合,在10 000 r/min的速度下均质1 min,静置10min后取静置0min和10min时的试管底部的乳化液各50μL,加入到5 mL质量分数为0.1%的SDS溶液中,正当混匀后利用分光光度计于波长500 nm下测量其吸光值。乳化性(EAI)和乳化稳定性(ESI)计算公式为
式中:A500nm为波长500 nm处的吸光值;C为蛋白质质量浓度(g/mL);φ为油相所占体积分数(φ=1/4);A10为静置10 min时乳状液的吸光值;A0为静置0 min时乳状液的吸光值;n为稀释倍数为100。
1.4 统计方法
所有实验均重复3次,采用SPSS 19.0和Statistix 8.0软件分析数据,多重比较采用Duncan方法,P<0.05表示差异显著,采用Sigm a Plot 9.0和Excel软件作图。
2 结果与分析
2.1 不同热处理时间对WPC与W PI游离巯基含量的影响
不同热处理时间对WPC与W PI的游离巯基含量的影响由图1所示。由图1可以看出,PWPC的游离巯基含量显著低于未处理WPC的游离巯基含量(30.82μm ol/g±3.15μm ol/g)(P<0.05);PWPI的游离巯基含量显著低于未处理W PI的游离巯基含量(55.81μm ol/g±2.14μm ol/g)(P<0.05);PWPC和PWPI的游离巯基含量随热处理时间的增加呈先下降后上升的趋势;在热处理时间低于30 min时,PWPC和PWPI的游离巯基含量呈下降趋势,在热处理时间大于30 min时,PWPC和PWPI的游离巯基含量呈上升趋势;在整个热处理时间范围内(0~90 min),PWPI的游离巯基含量显著高于PWPC(P<0.05);PWPC和PWPI的游离巯基含量均在热处理时间为30min时达到最低值。
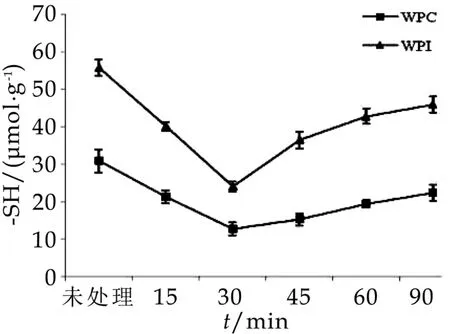
图1 不同热处理对WPC和WPI游离巯基含量的影响
2.2 不同热处理时间对WPC和W PI的Zeta-电位的影响
不同热处理时间对WPC与W PI的Zeta-电位的影响如图2所示。由图2可以看出,PWPC和PWPI的Zeta-电位随着热处理时间的增加呈先下降后上升的趋势;在热处理时间低于30 min时,PWPC和PWPI的Zeta-电位呈下降趋势,在热处理时间高于30 min时,PWPC和PWPI的Zeta-电位呈上升趋势;在热处理时间范围内,PWPI的Zeta-电位始终低于PWPC;且PWPC和PWPI的Zeta-电位值均在热处理时间为30min时达到最低值。
2.3 不同热处理时间对WPC和W PI黏度的影响
不同热处理时间对WPC与W PI的黏度的影响如图3所示。由图3可以看出,PWPC和PWPI的黏度随着热处理时间的增加呈上升趋势。随着热处理时间的延长,PWPC的黏度值由最初15 min的(33.43±1.62)m Pa·s上升至90 min的(81.47±1.53)m Pa·s,PWPI的黏度值由最初15 min的(52.47±7.70)m Pa·s上升至90min的(90.27±2.07)m Pa·s;在整个过程中,PWPI的黏度值始终高于PWPC的黏度值。

图2 不同热处理时间对WPC和WPI的Zeta-电位的影响
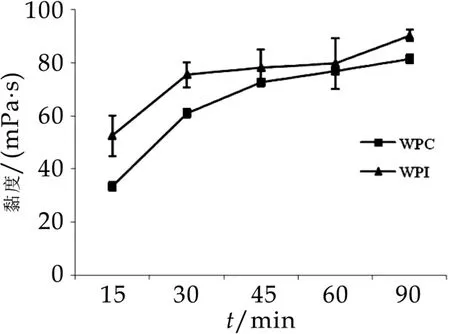
图3 不同热处理时间对WPC和WPI黏度的影响
2.4 不同热处理时间对WPC和W PI内源色氨酸荧光光谱的影响
不同热处理时间对WPC与W PI的内源色氨酸荧光光谱的影响如图4所示。由图4可以看出,未处理WPC和W PI的荧光峰在298.6 nm,经过不同的热处理时间后,PWPC和PWPI的最大发射波长与未处理WPC和W PI相比,没有变化,一直保持在298.6 nm,但是热聚合产物PWPC和PWPI的荧光强度与未处理WPC和W PI的荧光强度相比均有增加;PWPC的最大发射波长与PWPI之间不存在差异,二者的荧光峰均出现在298.6 nm处;PWPC和PWPI的荧光强度随热处理时间的增加呈先上升后下降的趋势,PWPC和PWPI的荧光值在热处理时间为30 min时达到最大值。
2.5 不同热处理时间对WPC和W PI乳化性和乳化稳定性的影响
不同热处理时间对WPC的乳化性和乳化稳定性的影响如图5所示。由图5可以看出,在乳化活性方面,PWPC的乳化活性显著低于未处理的WPC(P<0.05),在热处理时间低于30 min时,PWPC的乳化活性随时间的增加而增加,在热处理时间大于30 min时,PWPC的乳化活性随时间的增加而降低;在乳化稳定性方面,PWPC的乳化稳定性大于未处理WPC的乳化稳定性;而PWPC的乳化稳定性随着热处理时间的增加呈先上升后降低的趋势,在热处理时间为30min时达到最大值。
不同热处理时间对W PI的乳化性和乳化稳定性的影响如图6所示。由图6可以看出,在乳化活性方面,PWPI的乳化活性显著低于未处理的W PI(P<0.05);PWPI的乳化活性随热处理时间的增加呈先上升后降低的趋势,PWPI的乳化活性在热处理时间为30 min时达到最大值;在乳化稳定性方面,PWPI的乳化活性显著高于未处理的WPI(P<0.05),PWPI的乳化稳定性随着热处理时间的增加呈先上升后降低的趋势,PWPC的乳化性在热处理时间为30min时达到最大值。
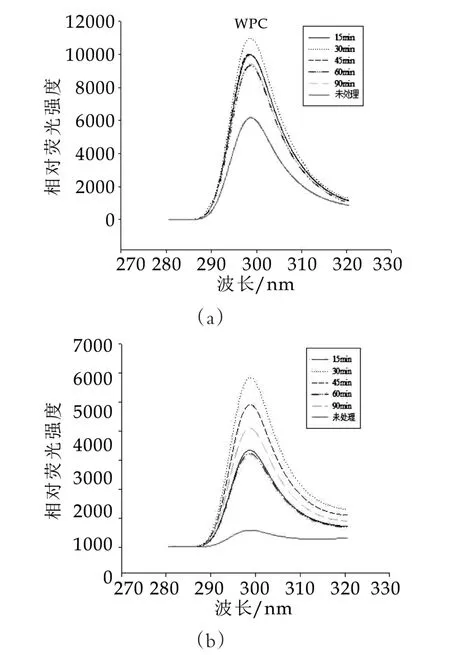
图4 不同热处理对WPC和WPI内源荧光色氨酸光谱的影响
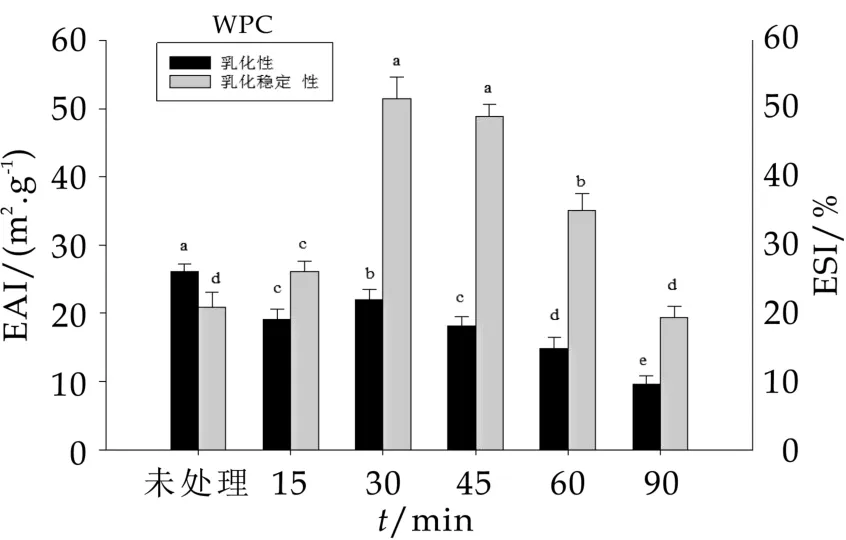
图5 不同热处理时间对WPC的乳化性和乳化稳定性的影响

图6 不同热处理时间对WPI的乳化性和乳化稳定性的影响
3 讨论
乳清蛋白热变性过程是低聚物发生聚集形成多化合物从而导致蛋白质的溶解性降低[18],乳球蛋白要经历蛋白的展开和凝集[19]。影响乳清蛋白热聚合的主要因素有热处理时间、蛋白质浓度和pH值等[11]。
本研究中,未处理WPC和W PI的游离巯基含量高于85℃热聚合PWPC和PWPI的游离巯基含量,这主要是由于β-乳球蛋白在温度升高至75℃以上时开始变性,随着加热温度的继续升高,部分α-乳白蛋白也开始发生变性,它能够与β-乳球蛋白相互作用[20]。变性可以促使β-乳球蛋白内的游离巯基转换成二硫键,进而发生聚合反应,最终使得β-乳球蛋白聚集生成大分子聚合物[21]。加热可以使得展开的α-乳白蛋白和β-乳球蛋白将带二硫键的氨基酸片段和非极性端也暴露于水相中,这些活性氨基酸的暴露促进了蛋白质之间的疏水作用和二硫键作用,导致聚合[22]。吴丹阳等[23]报道随热处理时间的延长,乳清蛋白的变异程度及乳清蛋白-酪蛋白结合程度出现明显增大,游离巯基含量增加,本实验结果与其报道一致。在整个热处理时间范围内(0~90 min),PWPI的游离巯基含量高于PWPC的,说明热处理时间会对聚合物中游离巯基的含量产生影响。
张铁华等[24]通过研究发现,热处理乳清蛋白的Zeta-电位低于未处理的乳清蛋白,与本试验结果一致。在加热时间大于30 min时,PWPC和PWPI的Zeta-电位随加热时间的增加而增加,与Jean等[25]的研究结果一致;在加热时间小于30 min时,PWPC和PWPI的Zeta-电位随加热时间的增加而减小,这可能是由于加热时间过短未能引起乳清蛋白Zeta-电位的变化。本研究还发现相同条件下PWPI的Zeta-电位显著低于PWPC(P<0.05),这种结果可能与蛋白质的聚合程度以及方式有关。
本研究中,PWPC和PWPI的黏度随着热处理时间的增加而增加,这可能是由于在加热促使蛋白质分子链发生热运动,使得分子链内部的疏水基团逐渐显露出来,疏水性基团通过疏水键和二硫键作用,发生聚集,增加了蛋白质的黏度。在整个热处理时间范围内(0~90 min),PWPC的黏度高于PWPI,可能是由于W PI中含有的β-乳球蛋白高于WPC中的β-乳球蛋白的含量,在相同条件下,W PI的变性程度大于WPC。
内源色氨酸荧光光谱可以间接反应蛋白质的结构变化。本试验结果表明,未处理WPC和W PI与PWPC和PWPI相比,二者在最大发射波长上没有差别,而在荧光强度上前者要弱于后者,这可能是由于后者经过热处理后色氨酸被暴露出来。PWPC和PWPI的荧光值在热处理时间为30 min时达到最大值。
用来评价蛋白质乳化性能的指标主要包括常用乳化活性指数(EAI)和乳化稳定性指数(ESI),其中EAI代表了蛋白质吸附在脂肪球表面的能力[26]。本试验结果表明,WPC和W PI经热诱导后生成聚合乳清蛋白的乳化稳定性显著升高,与先前报道结果一致[27]。刘翠平等[28]研究发现乳清蛋白的变性温度为75℃~90℃,在此温度区间内乳清蛋白热稳定性会随热处理时间的逐渐增加而减弱。本试验的热处理温度为85℃,在30min前PWPC和PWPI的乳化性和乳化稳定性随热处理时间的增加而增加,与刘翠平的试验结果一致。但在30 min后乳清蛋白的乳化性和乳化稳定随热处理时间的增加而减小,这可能是由于加热时间过长破坏了乳清蛋白的结构。相同条件下PWPI的乳化性和乳化稳定性显著高于PWPC(P<0.05),这可能是由于在未处理条件下,乳清蛋白具有良好的乳化性,热处理会导致乳清蛋白变性及溶解度降低,通过控制热处理的条件可以提高乳清蛋白的乳化性能。
参考文献:
[1]FOX P F.The milk protein system.In P.F.Fox(Ed.),Developments in dairy chemistry(pp.1-53).New York:Elsevier,1989.
[2]RABIEY L,BRITTEN M.Effect of protein composition on the rheological properties of acid-induced whey protein gels.Food Hydrocolloids,2009,23(3):973-979.
[3]郭本恒.乳粉[M].北京:化学工业出版社,2003:10-11.
[4]SMITHERSGW.Whey and whey proteins-From‘gutter-to-gold’.International Dairy Journal,2008,18:695-704.
[5]DEWIT JN.Nutritional and functional characteristics of whey proteinsin food products.Journal of Dairy Science,1998(81):597-608.
[6]ALVAR G,MALIKA R,MARIANELA C,et al.Effect of dynamic high pressure on whey protein aggregation:A comparison with the effect of continuous short-time thermal treatments[J].Food Hydrocolloids,2008(22):1014-1032.
[7]蔡自建,刘鲁蜀,陈炼红.强化乳清浓缩蛋白对酸奶品质影响的研究[J].西南民族大学学报·自然科学版,2012,38(2):242-246.
[8]PUVANETHIRAN A,WILLIAMSR P,AUGUSTIN M A.Structure and visco-clastic properties of set yoghurt with altered casein to whey protein ratios[J].International Dairy Journal,2002,12:383-391.
[9]TAKADA Y,MATSUYAMA H,KATO K,et al.Milk whey protein enhances the bone breaking force in ovariectomized rats.Nutrition Research,1997,97:177-182.
[10]高金明,葛珊,GAO JIN-minG等.乳清蛋白改性的研究进展[J].食品工业科技,2009,30(7):382-384.
[11]耿浩,刘悦,梁新婷等.热诱导对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响[J].中国食品学报,2016,16(8):71-77.
[12]BEVERIDGE T,TOMA S,NAKAI S.Determination of SH-and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science,1974,39(1):49-51.
[13]O’BRIEN R W,CANNON D W,ROWLANDSW N.Electroacoustic determination of particle size and zeta potential[J].Journal of Colloid and Interface Science,1995,173(2):406-418.
[14]LIU G,LIY,CAO J,et al.Changes of microbiological and physicochemical properties in Chinese infant formula caused by high heat treatment applied on concentrated m ilk.Dairy Science&Technology,2012,92(6):719-733.
[15]TANG C,YANG X Q,CHEN Z,et al.Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J].Journal of Food Biochemistry,2005,29(4):402-421.
[16]PEARCE K N,KINSELLA JE.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[17]MOTOIH,FUKUDOME S,URABE I.Continuous production of wheat gluten peptide with foaming properties using immobilized enzymes[J].European Food Research and Technology,2004,219(5):522-528.
[18]CHENJS,MOSCHAKIST,PUGNALONILA.Surface topography of heat-set whey protein gels by confocal laser scanningm icroscopy[J].Food Hydrocolloids,2006,20(4):468-474.
[19]VASBINDER A J,VELDE F,KRUIF C G.Gelation of casein-whey protein mixtures[J].Journal of dairy science,2004,87(5):1167-1176.
[20]AGYARE K K,DAMODARAN S.pH-stability and thermal properties of microbial transglutaminase-treated whey protein isolate[J].Journal of agricultural and food chemistry,2010,58(3):1946-1953.
[21]STǍNCIUC N,R PEANU G,BAHR IM G,et al.pH and heat-induced structural changes of bovine apo-α-lactalbumin[J].Food Chem is try,2012,131(3):956-963.
[22]KIM H J,DECKER EA,MCCLEMENTSD J.Role of postadsorption conformation changes ofβ-lactoglobulin on its ability to stabilize oil droplets against flocculation during heating at neutral pH[J].Langmuir,2002,18(20):7577-7583.
[23]吴丹阳,曹笛,钱方.不同热处理条件对乳蛋白影响的研究[A].中国食品科学技术学会第十二届年会暨第八届中美食品业高层论坛论文摘要集,2015:1.
[24]张铁华,姜楠,刘迪茹等.乳清蛋白基质脂肪替代物的制备及其在低脂液态奶中的应用效果[J].吉林大学学报(工学版),2015,45(3):1024-1028.
[25]JEAN K,RENAN M,FAMELART M H,et al.Structure and surface properties of the serum heat-induced protein aggregates isolated from heated skim milk[J].International dairy journal,2006,16(4):303-315.
[26]DYBOWSKA B E.Whey protein-stabilized emulsion properties in relation to thermal modification of the continuous phase[J].Journal of Food Engineering,2011,104(1):81-88.
[27]LIU F,TANG C H.Cold,gel-like whey protein emulsions by microfluidisation emulsification:Rheological properties and microstructures[J].Food Chemistry,2011,127(4):1641-1647.
[28]刘翠平,苏米亚,杜凌.粒径分析法研究影响乳清蛋白热稳定性的因素[J].乳业科学与技术,2009,32(6):268-270.1
