戊巴比妥钠及速眠新Ⅱ麻醉对新西兰兔心电图的影响
2018-03-19石慧丽牛升梅钟光珍
石慧丽,牛升梅,钟光珍
(首都医科大学附属北京朝阳医院,北京100020)
新西兰兔是心血管疾病研究常用实验动物,而该类模型研究,需在麻醉下实施。不同麻醉药物对心电影响不同。因此,了解麻醉药物本身对兔心电影响是必要的。戊巴比妥钠起效快,作用稳定,可持续性静脉应用,适合用于长期麻醉[1,2]。速眠新为肌内注射麻醉药物,小剂量即可达到镇痛、镇静、催眠的效果[3]。目前已有研究[4~7]这两种麻醉药物对兔心电图的影响,但是尚不全面,且对心电图表现的差异性对比,目前未见相关报道。2016年11月~2017年2月本研究使用戊巴比妥钠和速眠新Ⅱ对同一批新西兰兔先后进行麻醉,分析两种情况下心电图变化,以期进一步明确心电图各波段时长和振幅及两种麻醉药物在心电图表现上的差异。
1 材料与方法
1.1 材料 选用成年新西兰兔20只,体质量2.8~3.5 kg,雌雄各半,购自北京隆安实验动物养殖中心[SCXK(京)2014-0003]。实验操作在首都医科大学大动物实验室进行[SYXK(京)2014-0018]。新西兰兔自由进食饮水,饲养温度在18~26 ℃,氨浓度≤14 mg/m3,充分保障五项基本福利。本研究实施前已通过首都医科大学动物福利委员会的批准(伦理批准号AEEI-2014-041),所有操作均符合动物伦理要求。戊巴比妥钠:5 g/瓶,批号:P3761(sigma公司)。速眠新Ⅱ注射液[(2010)兽药GMP证字170号(吉林省敦化市圣达动物药品有限公司)]:1.5 mL/支,含量规格为1.5 mL∶0.03 g。动物心电图机:ECG-101A型(深圳邦健公司)。
1.2 麻醉方法 3%戊巴比妥钠配制:微量天平称取3 g的药品,用双蒸水溶解定容至100 mL,使用无菌滤膜在无菌厨中过滤后5 ℃保存,有效期约为1个月。速眠新Ⅱ在室温下保存,抽取原液进行麻醉。取20只新西兰兔分别称重,应用3 %的戊巴比妥钠按1.3 mL/kg的剂量进行耳缘静脉注射,约2 min角膜反射消失,无夹趾反射,四肢肌张力减低后,仰卧固定采集心电图[8]。同一批新西兰兔休息1周后在后肢股部肌注速眠新Ⅱ 0.2 mL/kg,约5 min后肌张力减低,角膜反射迟钝后,再次记录心电图[9]。
1.3 心电图检查 本研究在衡紫微等[10]和Giannico等[11]采集心电图方法的基础上稍加改良,新西兰兔麻醉后仰卧固定在兔台上,四肢局部及右胸部剪去浮毛,涂抹洗发膏后用刀片剃净细毛,贴上电极片(V1导联的位置大致位于胸骨右缘第4肋间,与人类相似),与扣试电极导线相连,采集6个肢体导联及V1导联的心电信号。该方法能避免多数文献中使用的带针的导线刺入皮下而给动物带来的不适感。心电图机的定准电压调为20 mm/mV,走纸速度为50 mm/s,记录心电图。
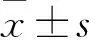
2 结果
2.1 两种麻醉药物分别作用下心电图总体特征比较 戊巴比妥钠麻醉后新西兰兔的心率(324.9±36.73)次/min,明显大于速眠新Ⅱ麻醉后心率(145.8±31.86)次/min(P<0.05)。速眠新Ⅱ麻醉后50 %的兔出现窦性心律不齐,戊巴比妥钠麻醉无此现象。速眠新Ⅱ麻醉后,心电图整体的基线水平比使用戊巴比妥钠平稳。
2.2 两种麻醉药物分别作用下P波、PR间期及PR间期离散度的比较 P波的形态和方向,在两种麻醉药物作用下表现基本一致,呈钝圆形或稍尖,在Ⅰ、Ⅱ、Ⅲ、AVF导联向上,AVR导联向下。V1导联可向上或双向,以向上居多。在戊巴比妥钠麻醉作用下,Ⅰ导联上的P波时长偏短且振幅偏低、不稳定,V1导联P波时长波动较大。戊巴比妥钠麻醉后P波时长小于速眠新Ⅱ[(0.032±0.010) s vs (0.036±0.007) s,P<0.05]。戊巴比妥钠麻醉后P波波幅大于速眠新Ⅱ[(0.081±0.043)mV vs(0.059±0.021)mV,P<0.05]。戊巴比妥钠麻醉和速眠新Ⅱ麻醉状态下,P波离散度无统计学差异(0.015±0.013 s vs 0.015±0.008 s,P>0.05)。戊巴比妥钠麻醉后的PR间期小于速眠新Ⅱ[(0.058±0.007)s vs (0.075±0.008)s,P<0.05]。在戊巴比妥钠麻醉和速眠新Ⅱ麻醉状态下,PR间期的离散度分别为(0.013±0.006)s和(0.011±0.006)s,差异无统计学意义(P>0.05)。
2.3 两种麻醉药物分别作用下QRS波、QT间期及QT间期离散度的比较 两种麻醉药物分别作用前后,QRS波的类型基本一致,波幅稍有变化,在各导联中QRS主波可向上或者向下。AVR导联上的QRS波主要表现为Qr、qR或rS,主波大多向下,主波向上时一般以q波为起始。V1导联以rS为主,没有出现Q或q波。在戊巴比妥钠作用下QRS波时长为(0.037±0.006)s,速眠新Ⅱ作用下为(0.038±0.007)s,差异无统计学意义(P>0.05)。戊巴比妥钠麻醉后QT 间期为(0.116±0.019)s小于速眠新Ⅱ(0.169±0.024)s(P<0.05)。戊巴比妥钠麻醉后QT间期离散度小于速眠新Ⅱ[(0.009±0.006)s vs (0.018±0.012) s,P<0.05]。
2.4 两种麻醉药物作用下ST段及T波的比较 两种麻醉药物使用前后ST段大部分均与基线持平,T波方向前后表现一致。T波在Ⅰ、Ⅱ、Ⅲ、AVF、V1导联均向上,在AVR导联向下,在AVL导联中向下多于向上。T波大多升支长且缓,降支短且急,在速眠新Ⅱ麻醉状态下,这种表现更明显。T波大部分与QRS主波方向一致,振幅及时长在不同新西兰兔的心电图中波动较大。戊巴比妥钠麻醉后ST段较短,有部分斜行直接与T波相连,T波波幅为(0.071±0.034)mV,而速眠新Ⅱ麻醉后ST段较长且平缓,T波波幅(0.122±0.064)mV,差异有统计学意义(P<0.05)。速眠新Ⅱ麻醉后心电图的T波时长明显长于戊巴比妥钠[(0.100±0.030)s vs (0.050±0.018)s],差异有统计学意义(P<0.05)。
3 讨论
新西兰兔是心血管疾病研究中常用实验动物,对其麻醉后进行心电图的监测,是常用的实验室手段。然而实验室常用麻醉药物戊巴比妥钠和速眠新Ⅱ对新西兰兔心电图影响的对比,目前无相关报导。本研究对同一批新西兰兔先后进行戊巴比妥钠和速眠新Ⅱ麻醉后采集心电图,戊巴比妥钠麻醉后测得心率比速眠新Ⅱ麻醉后快约123%。在两种麻醉药物作用下,P波在Ⅱ、Ⅲ、AVF导联均向上,AVR导联均向下,提示均为窦性心律,与人的窦性心律表现一致,故在窦性心律评判方面两者无明显差异。本研究中用戊巴比妥钠麻醉测得的心率为(324.9±36.73)次/min,比张嘉宁等[6]使用该麻醉药物得到的(285.5±16.64)次/min偏快。有研究[12]提示随着麻醉药物代谢动物的心率可减慢,推测本研究与张嘉宁等测得的心率不同,在于本研究是在兔麻醉10 min左右测心电图,而张嘉宁等是在麻醉后20 min做心电图所致。我们使用速眠新Ⅱ麻醉得到的心率为(145.8±31.86)次/min,与之前学者使用速眠新麻醉后家兔心率平均为115次/min[4]结果相近。根据我们的结果分析,与戊巴比妥钠相比,速眠新Ⅱ麻醉后使心率慢的主要原因可能为速眠新Ⅱ可以使QT间期延长和T波时限延长,心室肌复极化延长。我们先后使用两种麻醉药物麻醉发现,戊巴比妥钠麻醉后心律正常,而速眠新Ⅱ麻醉出现窦性心律不齐,故我们推测速眠新Ⅱ对窦房结有影响。
我们研究发现戊巴比妥钠麻醉后P波时长小于速眠新Ⅱ麻醉后,而振幅大于速眠新Ⅱ麻醉,从形态上表现为,戊巴比妥钠麻醉后P波高窄,速眠新Ⅱ麻醉后P波低长,提示速眠新Ⅱ可能减弱心房的除极,表现为心房除极波P波的时限延长及振幅偏低。心房非均质性电活动增加,会导致P波离散度的增大,它是预测心律失常、房颤的一个指标。新西兰兔是制备房颤相关模型的主要动物之一,了解正常的P波离散度,对模型的评估至关重要,目前未见相关报导。本实验得出戊巴比妥钠和速眠新Ⅱ两种麻醉状态下,P波离散度差异不明显。
QRS波在两种麻醉药物作用下,主波方向会有变化,但是波形的构成基本不变。AVR导联QRS主波大部分向上,小部分向下,与衡紫薇总结的日本大耳白的QRS波改变相似[10],与人类的QRS波AVR主波向下不一致。
QT间期离散度是评估室性心律失常和心肌梗死预后的重要标准[13]。心肌细胞复极过程不同步,会导致心肌细胞不应期的不均一,就会在心电图上显示出QT间期长短不一,QT间期离散度偏大,因此QT间期离散度可反应不同部位心室肌复极均一性和电稳定性。我们的研究显示,速眠新Ⅱ应用下的QT间期离散度明显大于戊巴比妥钠麻醉后QT间期离散度。此前学者研究表明速眠新Ⅱ可以使磷酸激酶及其同工酶升高,对心肌产生抑制作用[5],本研究发现的QT间期离散度增大可能源于速眠新对心肌的影响。
新西兰兔广泛应用于心房颤动、心肌梗死和心肌肥厚等动物模型中[8,14,15]。我们研究发现戊巴比妥钠麻醉后可快速进入麻醉状态,不会导致心律失常,并且作用时间长。根据我们的研究结果,推荐在心脏电生理方面研究,如房颤、心肌肥厚性心律失常等相关模型,为保证结果的稳定准确,应避免使用易致心律失常的麻醉药物,戊巴比妥钠是该类研究较好的选择。孙安会等[12]对比了水合氯醛、戊巴比妥钠、乌拉坦和异氟烷在模型心血管系统的影响,也证明了戊巴比妥钠对心电图影响较小,可用于心血管病的动物实验研究。单独使用速眠新Ⅱ小剂量肌注,操作方便,麻醉不深入,大部分新西兰兔角膜反射不能完全消失,夹趾反射存在,四肢肌张力降低,恢复快。故单独使用速眠新Ⅱ时,由于麻醉深度不够,不能用于长时间的创伤性操作,而在采血、备皮、彩超检测等短时小操作时,该药是很好的选择。速眠新麻醉后心电图ST段较平稳,故在监测心电图中,以观察ST-T改变为研究重点的模型,可适当加用速眠新Ⅱ。
[1] 姜龙,张晓燕,姜平.动物麻醉方法和麻醉药物研究现状[J].动物医学进展,2014,35(2):119-123.
[2] 孙婷婷,王宏坤.一种家兔持续静脉麻醉方法[J].中国比较医学杂志,2011,21(3):56-58.
[3] 吴曙光,钱宁.速眠新在实验动物麻醉中的应用[J].贵阳中医学院学报,2007,29(1):58-60.
[4] 杨柳,叶宝宏,樊新宇.四种麻醉剂对家兔心电图的影响[J].榆林学院学报,2009,19(4):9-11.
[5] 张立永,尹秀玲,蒋禄峰.水合氯醛、速眠新Ⅱ、二甲苯胺噻唑对家兔心电图、呼吸率和血压的影响[J].中国畜牧兽医,2011,38(4):70-73.
[6] 张嘉宁,顾为望,吴清洪,等.SPF新西兰兔心电图测定[J].动物医学进展,2005,26(9):116-117
[7 ] 陈亮,潘永明,陈民利,等.麻醉状态下WHBE免的心电图观测[J].实验动物与比较医学,2009,29(6):419-423.
[8] Yuan Y, Jiang Z, He Y, et al. Continuous vagal nerve stimulation affects atrial neural remodeling and reduces atrial fibrillation inducibility in rabbits[J]. Cardiovasc Pathol, 2015,24(6):395-398.
[9] Jiang HJ, Lu HZ, Wang YM, et al. Experimental study on angiogenesis in a rabbit VX2 early liver tumour by perfusion computed tomography[J]. J Int Med Res, 2010,38(3):929-939.
[10] 衡紫微,闫书妹,常超,等.正常日本大耳白兔同步12导联心电图分析[J].中国比较医学杂志,2016,26(12):20-26.
[11] Giannico AT, Garcia DAA, Lima L, et al. Determination of Normal Echocardiographic, Electrocardiographic, and Radiographic Cardiac Parameters in the Conscious New Zealand White Rabbit[J]. J Exot Pet Med, 2015, 24(2):223-234.
[12] 孙安会,谷捷,吴涛,等.四种常用实验麻醉药物对大鼠心血管系统的影响[J].中国实验动物学报,2016,24(2):120-126.
[13] 陆叶,殷泉忠,崔俊友.QT离散度在预测急性心肌梗死患者室性心律失常的临床分析及应用价值[J].中国医药导刊,2013(9):1380-1381.
[14] Tan MY, Xia B, Xiao Z, et al. Development of a new model for acute myocardial infarction in rabbits[J]. J Vet Med Sci, 2017,79(3):467-473.
[15] Meedech P, Saengklub N, Limprasutr V, et al. Transmural dispersion of repolarization and cardiac remodeling in ventricles of rabbit with right ventricular hypertrophy[J]. J Pharmacol Toxicol Methods, 2015,71:129-136.
