晋藜1号种子及幼苗对叠氮化钠诱变的响应
2018-03-12,,,
,,,
(1.山西大同大学生命科学学院,山西 大同 037009; 2.山西省农业科学院玉米研究所,山西 忻州 034000)
藜麦(ChenopodiumquinoaWilld)是藜科双子叶植物,营养价值高,蛋白质含量高达16%~22%,是稻米的2~3倍,易被人体吸收,受到国内外营养学家和农学家的重视[1-3]。研究表明,长时间食用藜麦,对心脏病、高血压、高血糖等疾病有很好的治疗效果,此外藜麦还有增强机体免疫力、补充营养及减肥等功效[4]。因藜麦在营养价值和营养安全等方面的突出作用,联合国大会宣布2013年为“国际藜麦年”[5]。21 世纪以来,随着发达国家藜麦主食化和多样化的发展,藜麦的国际市场需求日益强烈,极大地促进了藜麦的生产加工[2]。目前,藜麦在我国陕西西安、山西、青海、四川等地区多有种植[5],由于我国藜麦产业发展历史较短,藜麦生产加工企业数量不多,缺乏专业的生产加工设备和技术,加工产品种类少,加之,藜麦的种植技术还不成熟、产量低、质量差,所以提高黎麦质量、产量与品种的抗逆性,是我国农业育种研究的主要课题之一[6]。
叠氮化钠(NaN3)作为一种化学诱变剂,具有效率高、无毒、价格便宜及使用安全等特点[7]。在pH=3的溶液中产生HN3分子,表现为中性,由于细胞膜不能将其截留,能透过细胞膜进入到细胞质中,从而通过碱基替换的方式影响DNA的正常合成,导致了点突变的产生[8-10]。
目前有关叠氮化钠在作物诱变方面研究实例较多。曹欣等指出,不同种类的大麦在叠氮化钠的诱变作用下,结果有明显的差异,初步阐述了叠氮化钠诱变育种的机理,为育种工作提供了理论依据[11]。M.Afsar Awan等研究结果表明,在水稻遗传学和育种诱变中,叠氮化钠不仅是诱发叶绿体缺失的强诱变剂,而且能有效诱发出水稻利于存活的生理和形态突变体[12]。李明飞等对小麦进行了叠氮化钠诱变,结果表明,普通小麦在10 mmol/L的叠氮化钠的诱变作用下,可产生良好的诱变效果,并且通过M2代性状的田间鉴定,取得58个可遗传突变体系[13]。但这些研究大多集中于构建M1代、M2代突变体库,针对在苗期,叠氮化钠诱变对藜麦幼苗抗氧化系统的影响以及抗逆性的研究鲜有报道。
本实验以适宜山西静乐种植,生物性状比较优异的晋藜1号种子为材料,通过叠氮化钠诱变,探寻时间与浓度的适宜诱变组合,以及晋藜1号幼苗抗氧化系统对叠氮化钠诱变的响应,为藜麦种质创新和突变体库的构建奠定基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料
实验材料为大小均匀、颗粒饱满的晋藜1号种子(由山西省农业科学院玉米研究所提供)。
1.1.2 化学诱变剂
叠氮化钠(NaN3)购买自天津市登峰化学试剂厂,诱变液为含有叠氮化钠的磷酸缓冲液(0.1 mol/L,pH=3)。
1.2 试验方法
1.2.1 种子处理
用10%次氯酸钠处理晋藜1号种子10 min后,以清水浸泡1 h,然后将其表面水分沥干,待用。实验设置4个诱变时间:0,2.5,5,7.5 h,6个诱变浓度:0,5,10,15,20,25 mmol/L,每组3次重复。按要求进行诱变,每个烧杯中放入150粒晋藜1号种子,加入15 mL各浓度的叠氮化钠,放入全温振荡培养箱中培养(设25 ℃,188 r/h)到规定时间取出。用硫代硫酸钠(0.1 mol/L)溶液终止反应,并清洗3~5遍,之后用无菌水冲洗3遍,沥干种子,转入玻璃培养皿中,在每个培养皿中加入等量的无菌水,以将滤纸润湿不会有多余的浸出为标准,然后用镊子将种子均匀摆放,防止种子粘连在一起影响种子萌发,置于恒温培养箱中培养(设为25 ℃),每天加入一定量的蒸馏水,记录每天的发芽率[14],发芽率(%)=每天发芽的种子数/供试种子总数×100%。
1.2.2 砂土混合培养
将发芽后的种子移入花盆中,砂和土的比例为1∶1,待植株长出后进入4叶期,对相关生理指标进行测定。
1.3 指标测定
MDA含量、SOD活性、CAT活性及脯氨酸含量测定方法参考高俊凤版《植物生理学实验指导》[15]。
1.4 数据处理
采用SPSS 22对数据进行分析。对不同处理的发芽率、相对发芽率、SOD、CAT、MDA、脯氨酸等指标的变化做单因素方差分析。采用Excel作图。
2 结果与分析
2.1 不同时间、不同浓度叠氮化钠处理对晋藜1号种子发芽率的影响
由表1可知:在相同诱变时间内,随着诱变剂浓度的增加,种子发芽率呈降低趋势,说明种子萌发受到抑制;在同一诱变浓度下,诱变时间的增加也会导致发芽率的降低,说明诱变时间越长,晋藜1号种子受损坏越严重。原因可能是叠氮化钠的诱变使植物细胞中产生点突变,合成氨基酸类似物,干扰机体正常功能导致种子发芽率降低[7]。由数据可知:用10 mmol/L的诱变剂对黎麦种子处理7.5 h,发芽率为53%,接近半致死率。
2.2 不同时间、不同浓度叠氮化钠处理对晋藜1号幼苗中MDA含量的影响
由图1可知:同一处理时间,随着叠氮化钠处理浓度的增加,晋藜1号幼苗中MDA含量均呈升高的趋势。当处理时间为2.5 h时,诱变浓度低于10 mmol/L的叠氮化钠对MDA的含量影响无显著差异。诱变时间为5,7.5 h时,各处理浓度对MDA含量都有显著性差异。同一处理浓度时,诱变时间的延长,幼苗中MDA含量也会有所升高,且长时间诱变与短时间诱变相比幼苗MDA含量变化增幅较大。

表1 用叠氮化钠诱变剂处理后的晋藜1号种子第7天的发芽率、相对发芽率
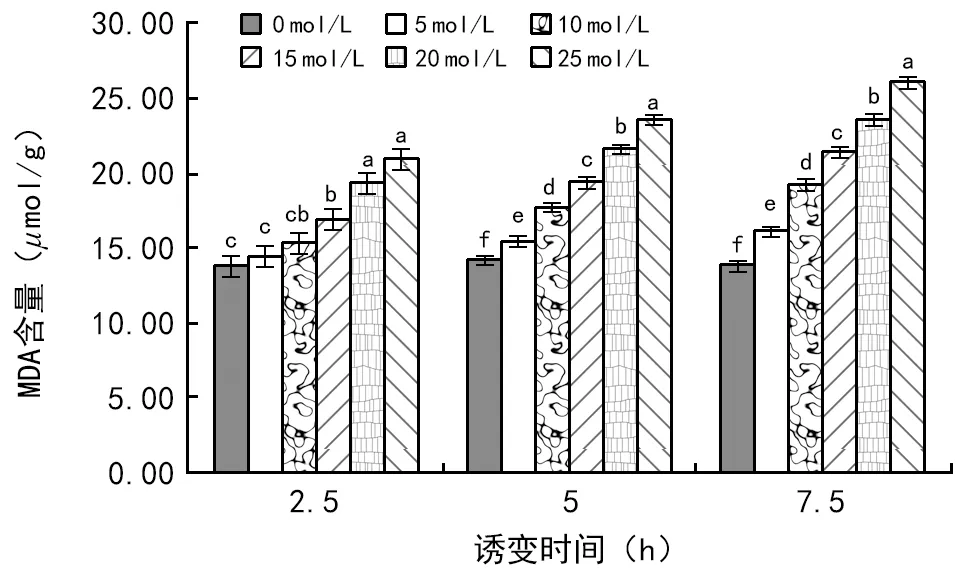
图1 在5,10,15,20,25 mmol/L叠氮化钠浓度下处理2.5,5,7.5 h时MDA含量变化(p=0.05)
2.3 不同时间、不同叠氮化钠浓度处理对晋藜1号幼苗叶片SOD活性的影响
由图2可知:相同诱变时间,不同浓度的叠氮化钠对晋藜1号叶片SOD活性相对于对照均有显著的提高。诱变时间为2.5 h时,SOD活性随着诱变浓度的增加而升高。当诱变时间为5,7.5 h时,SOD活性呈先升高后降低的趋势。从图2可以看出,随着诱变时间的延长,叶片SOD活性的最大值会向低浓度偏移。在相同诱变浓度下,诱变时间越长,SOD活性越高。

图2 在5,10,15,20,25 mmol/L叠氮化钠浓度下处理2.5,5,7.5 h时SOD活性变化(p=0.05)
2.4 不同时间、不同叠氮化钠浓度处理对晋藜1号幼苗叶片CAT活性的影响
如图3,相同诱变时间,叠氮化钠诱变浓度越大,晋藜1号叶片中CAT活性越高。有所不同的是,诱变时间为2.5 h时,叶片CAT活性升高与诱变浓度增加呈线性关系。当诱变时间为5 h时,CAT活性的增幅随叠氮化钠浓度的增加而降低。诱变时间为7.5 h时,CAT活性的增幅则随叠氮化钠浓度的增加而升高。同一叠氮化钠浓度,诱变时间越长,叶片CAT活性越高。

图3 在5,10,15,20,25 mmol/L叠氮化钠浓度下处理2.5,5,7.5 h时CAT活性变化(p=0.05)
2.5 不同时间、不同叠氮化钠浓度处理后,晋藜1号幼苗叶片脯氨酸含量的变化
由图4可知:在相同诱变时间,诱变浓度的升高导致脯氨酸的含量上升;在同一处理浓度下,诱变时间的增加也导致脯氨酸的含量增加;当诱变时间为5 h时,处理浓度低于10 mmol/L时,脯氨酸增长趋势较为平缓,当处理时间高于5 h,处理浓度大于10 mmol/L时,脯氨酸含量急剧升高。不同时间及不同浓度的叠氮化钠对晋藜1号叶片脯氨酸含量的影响总体趋势与对MDA含量影响相同。说明叠氮化钠诱变剂干扰晋藜1号内部代谢较为严重。由叠氮化钠诱变机理可知:NH3分子进入植物细胞,造成植物细胞氨中毒,而脯氨酸含量相对增加在一定程度上可以缓解氨中毒。所以在处理时间较短,诱变浓度较低时脯氨酸的含量增加较缓慢,诱变时间越大,浓度越大,脯氨酸增长的幅度也越大。

图4 在5,10,15,20,25 mmol/L叠氮化钠浓度下处理2.5,5,7.5 h时脯氨酸含量的变化(p=0.05)
3 讨论与结论
叠氮化钠对种子发芽及幼苗生长的影响与逆境环境对种子的影响相似,抗氧化酶活性的变化与幼苗在逆境条件下的应对反应也相一致。植物器官在受逆境胁迫时机体内自由基含量会增加,致使细胞膜不饱和脂肪酸发生氧化,其中MDA为脂肪酸氧化分解的主要产物,MDA能与膜中蛋白质和酶发生聚合作用,产生不溶物,并不断沉积,从而对机体造成损伤[15]。植物在正常生长情况下,可以清除体内自由基,而经叠氮化钠处理后,机体内活性氧自由基产生较多且不断累积,抗氧化系统无法将其全部清除,导致机体受到损伤。抗氧化系统包括抗氧化剂如脯氨酸等,以及抗氧化酶类如CAT和SOD等。经短时间、低浓度叠氮化钠诱变处理,植物体内抗氧化系统受到刺激,大量酶和相关物质被合成,清除自由基,避免机体损伤,表现为SOD、CAT酶活性均升高[16]。随着叠氮化钠浓度的增加、浸种时间的延长,抗氧化系统的功能受到损伤,多种酶之间活性比不平衡[17],人们通过在实验模拟现实存在的各种逆境,测定植物体内的保护酶活性变化,来确定植物对该逆境胁迫的承受上限和耐受范围,同时这些酶活性的变化也可以作为植物抗逆性强弱的指标。
本实验以晋藜1号种子为材料,通过叠氮化钠诱变,探寻时间和浓度的适宜诱变组合,以及晋藜1号幼苗抗氧化系统对叠氮化钠诱变的响应。结果表明,叠氮化钠浓度增加、诱变时间延长导致晋藜1号种子发芽率降低,浓度过高会使种子致死,不易发芽。当用10 mmol/L的诱变剂对晋藜1号种子处理7.5 h,发芽率为53%,接近半致死浓度。通过MDA含量的测定结果可知,相比于对照组MDA含量总体在上升,诱变浓度越大,MDA含量上升幅度越大,趋势越明显,表明植物细胞膜脂受到损伤程度越大[18]。而从抗氧化酶CAT、SOD的活性测定可以看出,在低浓度(<15 mmol/L),短时间(≤5 h)时含量明显升高,之后CAT活性变化趋于平缓,原因可能是晋藜1号对低浓度叠氮化钠的适应,长时间(>5 h),高浓度(≥15 mmol/L)的叠氮化钠诱变时CAT活性持续升高,这说明高浓度的叠氮化钠对晋藜1号植株的毒害作用已经超出其自身抗氧化系统的清除范围;在低浓度的叠氮化钠处理时,SOD活性上升,高浓度处理时出现下降,说明低浓度的叠氮化钠刺激了SOD酶系统,使SOD产量增多,活性增强。高浓度的叠氮化钠使晋藜1号抗氧化系统受到抑制,SOD的活性降低。经诱变后,脯氨酸含量呈上升趋势,低浓度时增加平缓,高浓度时急剧上升。
[1]朱玉红.通渭县藜麦高产高效栽培技术[J].农业科技与信息,2016,31:32.
[2]任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015(5):1-5.
[3]张紫薇.等渗NaCl和PEG胁迫及复水处理对藜麦种子萌发及幼苗生长的影响[J].作物杂志,2017(1):119-126.
[4]Bhargava A,Shukla S,Ohri D.Chenopodium quinoa-An Indian perspective[J].Industrial Crops and Products,2006,23(1):73-87.
[5]王晨静,赵习武,陆国权,等.藜麦特性及开发利用研究进展[J].浙江农林大学学报,2014,31(2):296-301.
[6]俞涵译,蒋玉蓉,毛泽阳,等.藜麦愈伤组织诱导体系优化研究[J].江苏农业科学,2015,43(3):26-30.
[7]程志锋.小麦近等基因系TcLr10,TcLr21和TcLr44的诱变研究[D].河北农业大学,2008.
[8]徐明,路铁钢.植物诱变技术的研究进展[J].生物技术进展,2011,1(2):90-97.
[9]常金华,李玉华.诱变技术在植物遗传改良中的应用[J].河北农业大学学报,2002(5):14-16.
[10]钮力亚,于亮,付晶,等.叠氮化钠在农作物育种中的应用[J].河北农业科学,2010,14(12):52-53,57.
[11]曹欣,杨煜峰,钱强华,等.叠氮化钠对不同大麦品种的诱变效应[J].浙江农业学报,1991,3(3):143-146.
[12]M.Afsar Awan,童渭渔,王彩莲,等.叠氮化钠对水稻的诱变效应[J].童渭渔、王彩莲译自《crop science》,1980,20(5):663-668.
[13]李明飞,谢彦周,刘录祥.叠氮化钠诱变普通小麦陕农33突变体库的构建和初步评估[J].麦类作物学报,2015,35(1):22-29.
[14]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[15]张美艳,薛世明,钟声,等.酸性条件下鸭茅种子萌发对铝胁迫的耐受响应[J].中国草地学报,2013,35(3):99-104.
[16]吴克莉,邹婧,邹金华.镉福胁迫对玉米幼苗抗氧化酶系统及矿质元素吸收的影响[J].农业环境科学学报,2010,29(6):1 050-1 056.
[17]马文丽,金小弟,王转花.铅胁迫对乌麦种子萌发及幼苗生长的影响[J].山西大学学报,2004,27(2):202-204.
[18]蔡琪敏,陈洁,张志祥,等.铜胁迫对两种苔藓植物生理生化的影响[J].浙江林业科技,2008,28(6):27-30.

各类文献规范数据选项表
注:“√”为必备项,“0”为任选项,“*”为有则加项,“-”为不要求项。
