慢病毒介导环状RNA mmu-circ-0001033过表达抑制低氧性小鼠肺动脉平滑肌细胞增殖的实验研究
2018-03-12王坚胡明冬唐晓丹葛海燕彭正羽宋元林夏世金
王坚 胡明冬 唐晓丹 葛海燕 彭正羽 宋元林 夏世金
低氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)是极高致死率和极高致残率的病理生理综合征,被冠以“假恶性”肿瘤之称[1],严重危害人们的健康,尚没有根治的方法。低氧性肺血管结构重建(hypoxic pulmonary vascular structural remodeling, HPVSR)是HPH形成的基本病理生理特征之一[2-3]。平滑肌细胞是组成肺血管壁最重要的细胞,低氧所致的肺平滑肌细胞结构与功能异常是HPH形成的一种主要病理生理机制。肺动脉平滑肌细胞(pulmonary arterial smooth muscular cells, PASMC)是组成肺动脉结构的主要细胞之一,在HPH形成中的作用至关重要。低氧能导致PASMC异常增殖,促进HPVSR,加速HPH发生与发展[2,4-6]。基于PASMC结构异常在HPH发生和发展中的关键作用,抑制PASMC异常增殖已成为HPH靶向治疗的研究热点。
近年来备受关注的环状RNA(circular RNA, circRNA)有可能为阐明HPH的机制提供新方法。circRNA通过与疾病关联的miRNA相互作用在疾病中发挥着重要的调控作用,为阐明疾病发生机制、干预靶点和新型诊断标志物提供了新手段和新策略[7-9]。
我们前期的研究发现,对HPH模型小鼠肺组织进行circRNA芯片筛选和qRT-PCR验证,结果表明HPH模型组(与常氧组比较)小鼠肺组织中环状RNA mmu-circ-0001033表达显著下调[10],由此推测环状RNA mmu-circ-0001033可能参与HPH发生机制。为了阐明 mmu-circ-0001033在HPH形成中的作用,我们进行环状RNA mmu-circ-0001033过表达对低氧性PASMC增殖的影响实验。本实验通过慢病毒介导mmu-circ-0001033转染体外培养的小鼠PASMC,观察增强mmu-circ-0001033表达对低氧性PASMC增殖的影响,为进一步研究mmu-circ-0001033在调节HPH中的作用与机制提供实验依据。
材料与方法
一、材料及主要试剂
10只健康雄性C57BL/6小鼠(购自上海杰思捷动物有限公司)。CCK-8(Cell Counting Kit)试剂盒(上海碧云天)、DMEM高糖培养基(Gibco,USA)、0.25%胰蛋白酶(Gibco,USA)、胎牛血清(Gibco,USA)、细胞培养板和培养瓶(Corning,USA)、二甲基亚砜(DMSO,Sigma,USA);Nanovue的分光光度计(美国GE公司);自动常压缺氧孵箱(德国贺氏公司)。其余试剂是国产分析纯。
二、实验方法
1. 原代PASMC的培养与分组: 采用贴块法培养细胞。取健康雄性C57BL/6小鼠,10%乌拉坦腹腔注射麻醉后,在无菌条件下打开小鼠胸腔取出肺动脉干和左右肺动脉,纵向剪开血管壁,用眼科弯镊钝性刮除残余的血管内膜,用含有抗菌素的PBS反复冲洗,将中膜剪成1 mm×1 mm大小,用弯头滴管移入到培养瓶内,组织块之间距为0.5 cm左右。将植块面翻转,置于培养箱中。2 h后轻轻翻转并加入含20%胎牛血清的DMEM培养液,组织块浸泡在培养液,静置1周。1周后观察及换液。用含10%胎牛血清的DMEM培养液培养细胞。当细胞生长至铺满瓶底80%左右时,用0.25%胰蛋白酶消化传代。细胞在光镜下呈典型的峰-谷状表现,免疫细胞化学染色观察抗α-平滑肌肌动蛋白抗体染色阳性,鉴定细胞。取3~5代细胞用于本实验。低氧处理:置入自动常压缺氧孵箱(德国贺氏公司)进行低氧处理。氧浓度:常氧21% O2,低氧2.5% O2。实验分4组:常氧组、低氧组、mmu-circ-0001033过表达慢病毒转染+低氧组、空白载体慢病毒转染+低氧组。
2. mmu-circ-0001033过表达慢病毒构建
(1)慢病毒包装:制备慢病毒穿梭质粒及其辅助包装原件载体质粒,使用质粒载体进行高纯度无内毒素抽提,共转染293T细胞,转染后6 h更换为完全培养基,培养48 h和72 h后,收集富含慢病毒颗粒的细胞上清液,4 ℃,2 000×g,离心10 min,去除细胞碎片,然后收集病毒上清液,再行超离。4 ℃,82 700×g,离心120 min,对其超离,最后得到高滴度的慢病毒超离液。
(2)滴度检测:①细胞准备:将生长状态良好的293T细胞消化计数后稀释至1×105/ml,加入96孔板,100 μl/孔,为每个病毒准备6个孔。放入37 ℃,5% CO2培养箱中培养; ②加病毒:第2天,准备6个1.5 ml EP管,第一个EP管中加入10 μl病毒液,然后做3倍梯度稀释,共6个稀释度; ③追加培养液:第3天,有需要加嘌呤霉素筛选的孔,先吸去100 ml含病毒培养基,加入100 μl含1.5 μg/ml 嘌呤霉素的10% FBS完全培养基; ④观察结果并计算滴度:第5天,在荧光显微镜下观察结果,在观察结果前6 h需更换新鲜10%胎牛血清的完全培养基,从孔中吸出80 μl培养基,然后加入80 μl新鲜10%胎牛血清的完全培养基,放入37 ℃,5% CO2培养箱中培养。6 h后荧光显微镜下观察结果,荧光百分比在10~30%的孔计算病毒滴度。滴度(TU/ml)=细胞数×荧光百分比×MOI×病毒稀释倍数×103。
3. 慢病毒载体转染: 取PASMC铺于96孔培养板,每组设3个重复孔。mmu-circ-0001033过表达慢病毒经扩增、鉴定、纯化后用于本实验。待细胞长至80%时,培养24 h后弃培养液,然后吸出培养液,加入mmu-circ-0001033过表达慢病毒或空白载体慢病毒转染液,在37 ℃、5% CO2细胞孵箱培养1 h后弃转染液。未转染组不加慢病毒转染液,其余同转染组。后续在常氧(21% O2)和低氧(2.5% O2)条件下进行相应指标检测,重复实验3次。
4. qRT-PCR技术检测细胞mmu-circ-0001033的表达水平: 采用Trizol法分别提取各组细胞的总RNA。用Nanovue的分光光度计测定各组RNA浓度。运用Takara逆转录试剂盒将RNA逆转录为cDNA以用于后续的qRT-PCR检测。应用Bio-Rad公司的PCR仪进行qRT-PCR检测。引物序列如下:GAPDH-F: 5′-GTTGTCTCCTGCGACTTCA-3′;GAPDH-R:5′-GCCCCTCCTGTTATTATGG-3′;mmu-circ-0001033-F: 5′-CTGTCCCAACTGTAAAGAAGGTG-3′;mmu-circ-0001033-R:5′-CATCGGTTTGGTGCTCCTC-3′。
5. CCK-8法检测细胞增殖: 主要操作步骤:①在96孔板中配置100 μl的细胞悬液。将培养板放在培养箱预培养24 h(37 ℃,5% CO2);②向培养板加入10 μl不同浓度的待测物质;③将培养板在培养箱孵育所设定的时间;④向每孔加入10 μl CCK-8溶液;⑤将培养板在培养箱内孵育1~4 h;⑥用酶标仪测定在450 nm处的吸光度。
三、统计学方法

结 果
一、 低氧下调PASMC中mmu-circ-0001033的表达
低氧诱导PASMC中mmu-circ-0001033的表达明显下调,且呈时间依赖性。见图1。

图1 低氧诱导PASMC中mmu-circ-0001033的表达下调;与Control组比较,*P<0.05,**P<0.01,n=3
二、 mmu-circ-0001033过表达慢病毒转染结果
与对照组比较,慢病毒转染组中mmu-circ-0001033表达显著上调(P<0.05),提示mmu-circ-0001033过表达慢病毒成功转染入PASMC,且并高效表达,见图2。
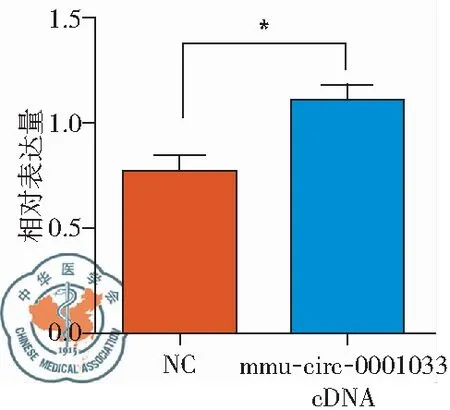
图2 mmu-circ-0001033过表达慢病毒成功转染PASMC;与Control组比较,*P<0.05,n=3
三、 CCK-8法检测细胞增殖结果
与常氧组比较,低氧组和空白载体慢病毒转染+低氧组PASMC增殖明显增多(P<0.05),而mmu-circ-0001033过表达慢病毒转染+低氧组PASMC增殖显著下降。说明过表达的mmu-circ-0001033 显著抑制低氧所诱导的PASMC的增殖,见图3。
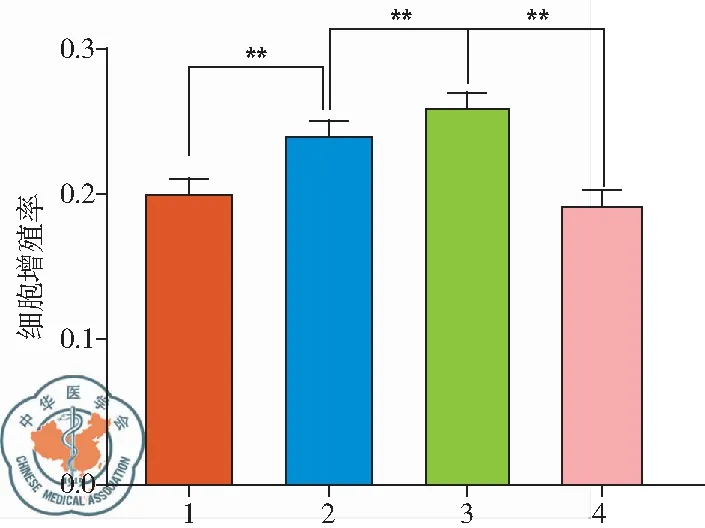
图3 细胞增殖检测结果;注:1~4:常氧组、低氧组、空白载体慢病毒转染+低氧组、mmu-circ-0001033过表达慢病毒转染+低氧组;与Control组比较,**P<0.01,n=3
讨 论
本实验研究首次发现,低氧可导致PASMC异常增殖和mmu-circ-0001033的表达明显下调,而慢病毒介导的mmu-circ-0001033过表达能显著抑制低氧所诱导的PASMC的增殖,提示增强mmu-circ-0001033表达可抑制PASMC的增殖,这为mmu-circ-0001033过表达改善HPVSR,从为而防治HPH提供了实验依据。
circRNA作为RNA家族成员,具有特征性的共价闭合环结构的特征性。circRNA具有种属、组织、疾病及发育阶段等的特异性,与多种疾病,尤其是恶性肿瘤的发生发展密切相关。circRNA的主要功能是通过海绵吸附miRNA发挥生物学功能,同时还具有调控转录和转录后过程、可变剪接、编码蛋白以及充当蛋白诱饵等作用。目前多种预测方法被提出用于发现circRNA[8]。
目前认为,circRNA是存在于生物中具有共价闭合环结构特征的非编码RNA[11]。circRNA曾经被认为是RNA剪切所形成的错误产物而轻视为“垃圾”[12-13]。然而,科学家们应用高通量测序确认circRNA是细胞基因表达的一种形式[14]。研究还发现circRNA具有保守性、稳定性、多样性和丰富性,参与调节胞内其他RNA的功能,在恶性肿瘤、心血管疾病、神经精神性疾病、先兆子痫以及2型糖尿病等发生发展中发挥着关键的作用[8]。
circRNA在心血管疾病发生和发展过程中发挥了重要作用。Burd等[15]发现,在动脉粥样硬化性血管疾病中来自INK4A/ARF位点的环状RNA(cANRIL)的表达量与INK4A/ARF的转录以及动脉粥样硬化性血管病发生风险密切相关,其机制可能是cANRIL募集PcG复合物导致INK4A/ARF的沉默,增加了动脉粥样硬化性血管病发生的易感性。Wang等[16]发现,环状RNA(HRCR)能够海绵吸附miR-223,抑制miR-223的活性,促进ARC蛋白表达上调,进而抑制心肌肥厚和心衰的发生。Foxo3 circular RNA能够抑制抗衰老和抗应激相关蛋白,促进阿霉素诱导的心肌病的发生[17]。 Geng等[18]发现环状RNA(Cdr1as)能够海绵吸附miR-7a上调PARP和SP1蛋白的表达,进而增加心梗的面积,提示Cdr1as有望作为心梗的治疗靶点。本研究提示,环状RNA mmu-circ-0001033在肺动脉高压发生中可能具有重要作用。
慢病毒载体是指以人类免疫缺陷病毒-1 (human immunodeficiency virus-1,HIV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染和稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。慢病毒载体可以将外源基因有效地整合到宿主染色体上,携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。体外和体内实验中慢病毒己经成为表达外源基因的常用载体之一, 且正在获得越来越广泛的应用。基于慢病毒载体的优势,本研究构建了mmu-circ-0001033过表达慢病毒载体,实现了mmu-circ-0001033在PASMC中进行稳定且高效的表达,为研究mmu-circ-0001033的生物学功能提供强有力的手段。
然而,本研究仅仅观察到低氧下调PASMC mmu-circ-0001033表达,以及慢病毒介导的mmu-circ-0001033过表达能显著抑制低氧所诱导的PASMC的增殖,但对其机制尚不清楚;此外,本研究的结论也需要进行动物实验,更需要用HPH临床样本进行验证。
1 McLaughlin VV, Archer SL, Badesch DB, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association[J]. J Am Coll Cardiol, 2009, 53(17): 1573-1619.
2 Xia S, Tai X, Wang Y, et al. Involvement of Gax gene in hypoxia-induced pulmonary hypertension, proliferation, and apoptosis of arterial smooth muscle cells[J]. Am J Respir Cell Mol Biol, 2011, 44(1): 66-73.
3 夏世金, 吴俊珍, 胡明冬. 低氧致炎与低氧性肺动脉高压[J/CD]. 中华肺部疾病杂志(电子版), 2014, 7(5): 72-74.
4 夏世金, 钱桂生, 胡明冬, 等. 低氧对大鼠肺动脉平滑肌细胞中Gax基因表达及细胞增殖的影响[J]. 第三军医大学学报, 2006, 28(3): 195-197.
5 钱频, 王关嵩, 蒙伟宗, 等. 低氧对大鼠肺动脉平滑肌细胞表达信号转导及转录激活因子基因表达的影响[J]. 第三军医大学学报, 2003, 25(2): 107-109.
6 冯恩志, 戴胜归, 杨生岳. 低氧性肺动脉高压研究进展[J/CD]. 中华肺部疾病杂志(电子版), 2014, 7(3): 84-87.
7 Liu L, Wang J, Khanabdali R, et al. Circular RNAs: Isolation, characterization and their potential role in diseases[J]. RNA Biol, 2017, 14(12): 1715-1721.
8 王坚, 黄嘉楠, 宋元林, 等. 环状RNA的研究新进展[J]. 生命科学, 2017, 29(11): 1141-1148.
9 夏世金, 高文, 胡明冬, 等. 环状RNA的研究现状及展望[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(6): 55-58.
10 夏世金, 邰先桃, 李炳, 等. 低氧性肺动脉高压小鼠肺的环状RNA表达谱研究[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(1): 40-44.
11 Szabo L, Salzman J. Detecting circular RNAs: bioinformatic and experimental challenges[J]. Nat Rev Genet, 2016, 17(11): 679-692.
12 Cocquerelle C, Mascrez B, Hétuin D, et al. Mis-splicing yields circular RNA molecules[J]. FASEB J, 1993, 7(1): 155-160.
13 Pasman Z, Been MD, Garcia-Blanco MA. Exon circularization in mammalian nuclear extracts[J]. RNA,1996, 2(6): 603-610.
14 Salzman J, Gawad C, Wang PL, et al. Circular RNAs are the predominant transcript isoform from hundreds of human genes in diverse cell types[J]. PLoS One, 2012, 7(2):e30733.
15 Burd CE, Jeck WR, Liu Y, et al. Expression of linear and novel circular forms of an INK4/ARF-associated non-coding RNA correlates with atherosclerosis risk[J]. PLoS Genet, 2010, 6(12): e1001233.
16 Wang K, Long B, Liu F, et al. A circular RNA protects the heart from pathological hypertrophy and heart failure by targeting miR-223[J]. Eur Heart J, 2016, 37(33): 2602-2611.
17 Du WW, Yang W, Chen Y, et al. Foxo3 circular RNA promotes cardiac senescence by modulating multiple factors associated with stress and senescence responses[J]. Eur Heart J, 2017, 66: 1402-1412.
18 Geng HH, Li R, Su YM, et al. The Circular RNA Cdr1as Promotes Myocardial Infarction by Mediating the Regulation of miR-7a on Its Target Genes Expression[J]. PLoS One, 2016, 11(3): e151753.
