脓毒症患者连续性血液净化后炎性反应和免疫功能指标变化分析
2018-03-07李晓峰赵延辉梁彦平
郝 鹏 ,李 旭 ,李晓峰 ,赵延辉 ,梁彦平
脓毒症是由感染引起的全身炎性反应综合征,是烧伤、创伤、休克及外科手术后常见并发症,致死率较高[1-3]。早期液体复苏、有效控制感染、活化血管是治疗的关键。连续性血液净化(continuous blood purification, CBP)是一种连续性的缓慢清除水分和溶质的治疗方式,通过清除患者体内的炎性介质,为体内重要脏器提供功能支持,尽量避免多器官功能衰竭(multiple organ failure,MOF)的发生[4-6],具有平衡电解质、平衡酸碱、维持内环境稳定的作用[7],但目前临床关于其对细胞免疫功能作用的研究较少。本研究选取新疆石河子大学医学院第一附属医院84例脓毒症患者临床资料,分别采用常规治疗和CBP治疗,临床效果差异显著,现报道如下。
1 资料和方法
1.1 资料 收集2016-05至2017-05在我院接受治疗并符合本研究目的的脓毒症患者临床资料,根据资料筛选标准选取84例资料完整者的临床资料,按照治疗方法的不同将所选资料分为观察组(n=42)和对照组(n=42)。其中,进行常规治疗者为对照组,在常规治疗基础上联合CBP治疗者为观察组。
1.2 资料筛选标准 纳入标准:(1)所有患者资料均符合脓毒症诊断标准[6];(2)无心脏病史。排除标准:(1)年龄<18岁;(2)口腔内严重出血者;(3)伴有急性严重颅脑损伤,格拉斯哥昏迷评分法(Glasgow Coma Scale,GCS)<5 分[8];(4)合并有严重的慢性心、肝、肾功能疾病;(5)免疫功能低下或长期应用免疫制剂者;(6)不可复苏的临终状态者。
1.3 方法
1.3.1 对照组 依据2012年脓毒症治疗指南中早期目标指导性治疗原则进行常规及原发病的治疗[9],主要措施包括应用抗生素、补液、纠正酸中毒、祛除感染源,必要时给予患者营养及呼吸支持。
1.3.2 观察组 在对照组治疗基础上联合CBP治疗。采用CBP机在连续性静脉-静脉血液滤过模式下,根据患者实际情况由颈内静脉或股静脉放置单针双腔透析导管。先以50~80 ml/(kg·h)速率输入置换液,其基本配方为0.9%氯化钠注射液(国药准字H1993836,新疆世华丹药业有限公司)3 000 ml,灭菌注射用水1 000 ml,10%硫酸镁(国药准字H12020994,天津金耀药业有限公司)8 ml,5%氯化钙(国药准字H37022034,瑞阳制药有限公司)20 ml,15%氯化钾(国药准字H20053710,中国大冢制药有限公司)8 ml,5%碳酸氢钠[国药准字H36020283,回音必集团(江西)东亚制药有限公司] 200 ml,血液流速为180~220 ml/min,若患者有出血倾向或伴有凝血功能障碍则行无肝素化治疗,对于无出血倾向且未伴有凝血功能障碍者使用普通肝素(国药准字H12020505,天津生物化学制药有限公司)抗凝治疗,首剂量为0.4 mg/kg,后追加剂量为3~10 mg/h,密切监测患者是否有出血倾向。前3 d进行CBP治疗时,每次治疗7~12 h后更换1次血滤器及管路,治疗3 d后根据患者病情及血生化指标每天或隔天更换1次,保证CBP总治疗时间大于72 h。
1.4 观察指标 (1)分别于治疗前后监测患者体温(temperature,T)、心率(heart rate,HR)、呼吸频率(respiratory rate,RR),清晨抽取患者空腹状态下静脉血,应用颗粒计数仪(Beckman-Coulter,Z2),在试验温度下测定白细胞(white blood cell,WBC)数量,校准计数仪,选取孔径大小为100 μm,取0.08 ml患者血液样本加入到20 ml容量瓶中进行稀释,随后加入溶血素500 μl溶解红细胞,采用计数仪测定白细胞数量。(2)采用酶联免疫吸附试验检测两组的肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白介素-6(interleukins-6,IL-6)、白介素-10(interleukins-10,IL-10)水平。(3)采用流式细胞仪(Beckman-Coulter,EPICS-XL型),取患者100 μl新鲜的抗凝血标本加入到测定管中,并加入相应的荧光标记单克隆抗体,震荡均匀后在室温环境下避光孵育20 min,后加入500 μl溶血素,震荡均匀后于室温下静置溶血8 min,后再加入2 ml的缓冲液,以1 500 r/min(离心半径10 cm)的速度离心5 min后再加入1 ml缓冲液,后立即上流式细胞仪检测B细胞、T淋巴细胞亚群及自然杀伤(natural killer,NK)细胞水平。
1.5 统计学处理 应用 SPSS 19.0统计学软件对本研究数据进行处理,计数资料以频数和率表示,组间比较采用Pearson χ2检验;计量资料以±s表示,组内比较采用配对t检验,组间比较采用独立样本t检验,以双侧P<0.05为差异具有统计学意义。
2 结 果
2.1 一般资料 观察组年龄28~76岁;对照组年龄26~77岁,所选患者资料原发病类型包括重症急性胰腺炎、感染性休克、肺部感染合并感染性休克、严重创伤合并多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、肝脓肿、糖尿病合并肺部感染、严重烧伤。两组在年龄、性别、原发病类型方面比较,差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组脓毒症患者一般资料比较
2.2 两组治疗前后生命体征和炎性反应指标水平变化 与治疗前比较:(1)两组治疗3 d后生命体征指标(T、HR、RR)均显著降低,差异均具有统计学意义(P<0.05);两组治疗3 d后炎性因子TNF-α、IL-6及WBC均显著降低,差异均具有统计学意义(P<0.05);IL-10指标水平显著升高,差异均具有统计学意义(P<0.05)。(2)与对照组比较,观察组治疗3 d后生命体征、炎性因子TNF-α、IL-6和WBC均显著降低,IL-10显著升高,差异均具有统计学意义(P<0.05,表2)。
表2 两组脓毒症患者治疗前、治疗后3 d生命体征及炎性反应指标水平变化比较( ±s)
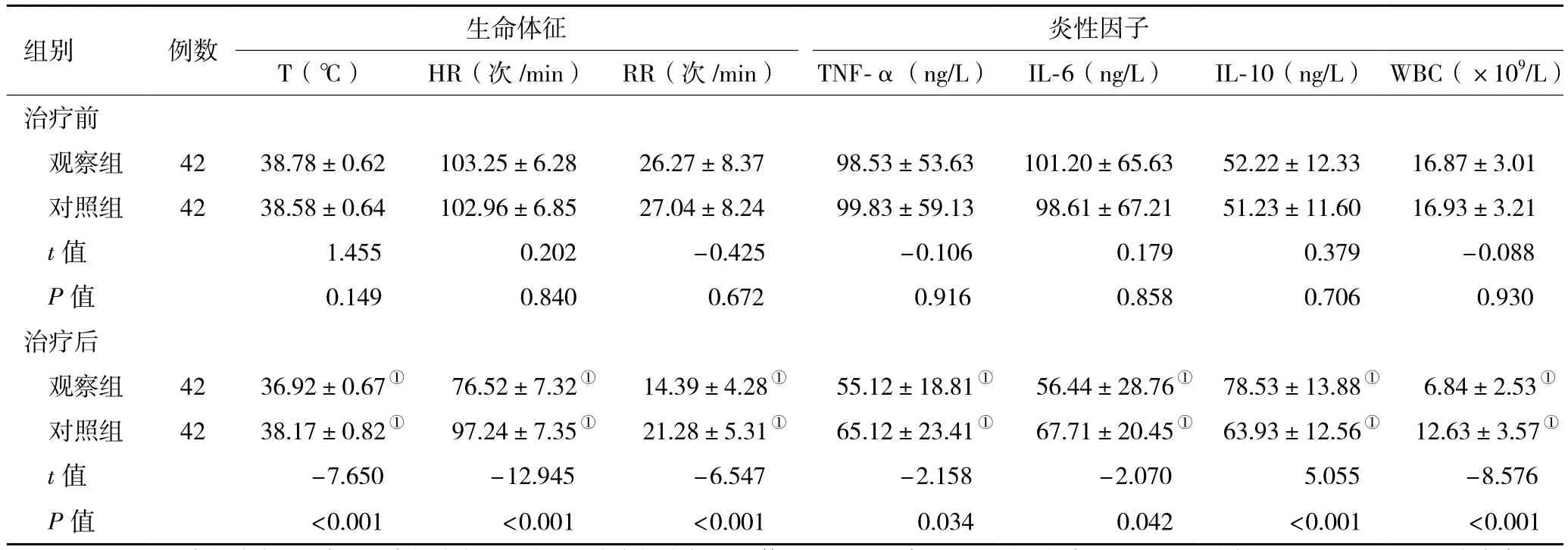
表2 两组脓毒症患者治疗前、治疗后3 d生命体征及炎性反应指标水平变化比较( ±s)
注:对照组,常规治疗;观察组,常规治疗+连续性血液净化治疗;T,体温;HR,心率;RR,呼吸频率;TNF-α,肿瘤坏死因子α;IL-6,白介素-6;IL-10,白介素-10;WBC,白细胞;与同组治疗前比较,①P<0.05
组别 例数 生命体征炎性因子T(℃) HR(次/min) RR(次/min) TNF-α(ng/L) IL-6(ng/L) IL-10(ng/L) WBC(×109/L)治疗前观察组 42 38.78±0.62 103.25±6.28 26.27±8.37 98.53±53.63 101.20±65.63 52.22±12.33 16.87±3.01对照组 42 38.58±0.64 102.96±6.85 27.04±8.24 99.83±59.13 98.61±67.21 51.23±11.60 16.93±3.21 t 值 1.455 0.202 -0.425 -0.106 0.179 0.379 -0.088 P值 0.149 0.840 0.672 0.916 0.858 0.706 0.930治疗后观察组 42 36.92±0.67① 76.52±7.32① 14.39±4.28① 55.12±18.81① 56.44±28.76① 78.53±13.88① 6.84±2.53①对照组 42 38.17±0.82① 97.24±7.35① 21.28±5.31① 65.12±23.41① 67.71±20.45① 63.93±12.56① 12.63±3.57①t 值 -7.650 -12.945 -6.547 -2.158 -2.070 5.055 -8.576 P 值 <0.001 <0.001 <0.001 0.034 0.042 <0.001 <0.001
2.3 两组治疗前后免疫功能指标变化 与治疗前比较,两组组治疗3 d后CD3+、CD4+、CD4+/CD8+、B细胞百分比均显著上升,NK细胞水平均显著降低,差异均具有统计学意义(P<0.05);与对照组比较,治疗3 d后观察组CD3+、CD4+、CD4+/CD8+、B细胞百分比均升高更为显著,NK细胞水平显著降低,差异均具有统计学意义(P<0.05,表3) 。
3 讨 论
脓毒症即感染引发全身炎性反应的同时伴有器官功能障碍和组织灌注不良,具有致死率高、治疗费用昂贵等特点,为患者及其家庭造成沉重负担[10]。脓毒症实质是机体释放过多的炎性因子和细胞因子,使许多生理及免疫通路被激活,导致炎性反应失控和免疫紊乱。研究报道,脓毒症治疗的关键是阻断炎性介质对组织细胞的损害,改善患者机体供血情况,而CBP能持续、稳定地控制患者电解质、水盐代谢稳定,有效清除血液中的毒素和中分子物质,且在清除过程中对血流动力学不会造成影响[11-14],并能根据患者需求为其提供营养及药物治疗,目前已成为临床救治脓毒症的一种主要手段[15-17]。
表3 两组脓毒症患者治疗前、治疗后3 d免疫功能指标变化(%,±s)
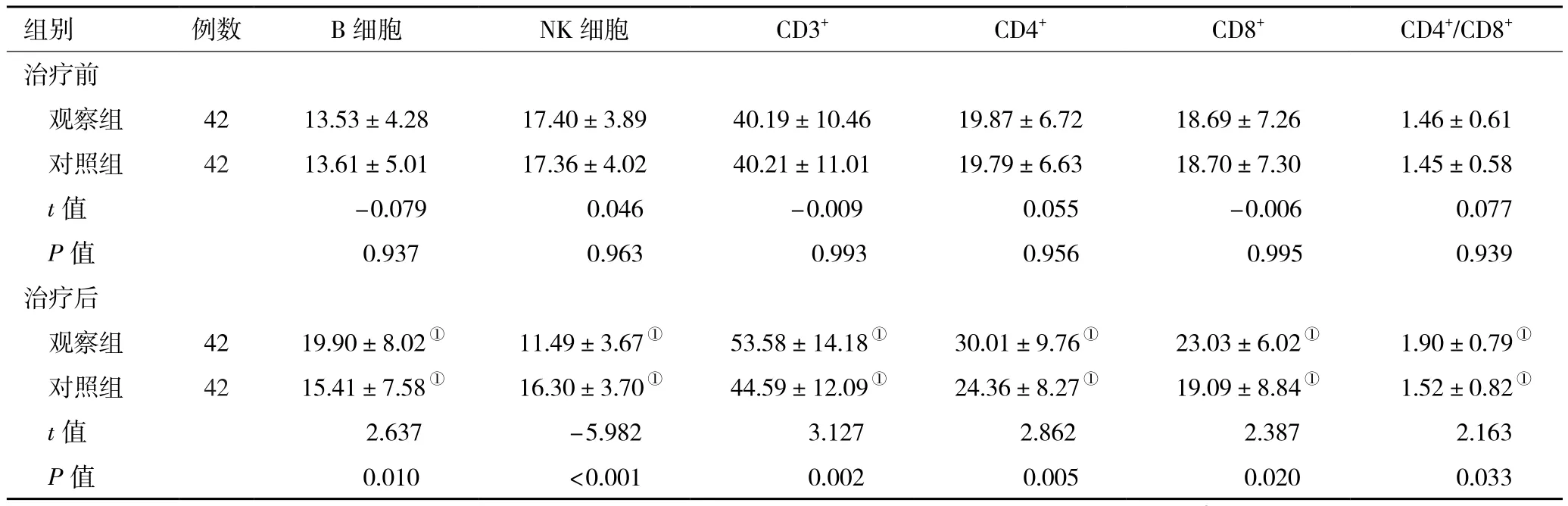
表3 两组脓毒症患者治疗前、治疗后3 d免疫功能指标变化(%,±s)
注:对照组,常规治疗;观察组,常规治疗+连续性血液净化治疗;NK细胞,自然杀伤细胞;与同组治疗前比较,①P<0.05
组别 例数 B细胞 NK细胞 CD3+ CD4+ CD8+ CD4+/CD8+治疗前观察组 42 13.53±4.28 17.40±3.89 40.19±10.46 19.87±6.72 18.69±7.26 1.46±0.61对照组 42 13.61±5.01 17.36±4.02 40.21±11.01 19.79±6.63 18.70±7.30 1.45±0.58 t值 -0.079 0.046 -0.009 0.055 -0.006 0.077 P值 0.937 0.963 0.993 0.956 0.995 0.939治疗后观察组 42 19.90±8.02① 11.49±3.67① 53.58±14.18① 30.01±9.76① 23.03±6.02① 1.90±0.79①对照组 42 15.41±7.58① 16.30±3.70① 44.59±12.09① 24.36±8.27① 19.09±8.84① 1.52±0.82①t 值 2.637 -5.982 3.127 2.862 2.387 2.163 P值 0.010 <0.001 0.002 0.005 0.020 0.033
研究表明,脓毒症患者血浆中IL-6、TNF-α水平与病情危重程度存在密切相关性[16]。血管内皮细胞和炎性细胞可被IL-6直接激活,具有使炎性、毒性反应催化和放大作用,致使组织细胞受损,启动抗炎反应后机体可被激发而产生大量的炎性因子,形成级联放大作用,最终发展为脓毒症。而抑制促炎因子的释放并降低其水平是脓毒症的防治重点。目前,临床经验表明,CBP可清除脓毒症患者体内中、大分子溶质以降低炎性因子水平,尤其在大量置换的情况下也能清除小分子溶质[18]。本研究显示,CBP治疗后患者血浆TNF-α、IL-6 、WBC水平均较对照组明显降低。另外,两组治疗3 d 后T、HR、RR及WBC较治疗前均显著降低,而观察组T、HR、RR、WBC水平较对照组明显好转。T升高,HR、RR加快,WBC水平升高是炎性活动的具体表现[19],以上结果均表明CBP能有效清除严重脓毒症患者循环中的炎性因子,降低其炎性反应水平。
随着研究的深入,临床发现机体免疫状态紊乱在脓毒症的发生与发展过程中起着重要作用,即脓毒症患者存在特异性免疫系统功能障碍使其体内感染不易控制,最终导致预后不佳[20-23]。在人体免疫系统中,T淋巴细胞亚群能反映人体细胞免疫功能的变化,CD3+为全血成熟T淋巴细胞;CD4+为辅助/诱导T淋巴细胞,CD8+为具有直接杀伤特异性抗原细胞作用的靶细胞,CD4+/CD8+降低反应患者机体免疫功能受到了抑制;B细胞即B淋巴细胞,也是重要的体液免疫细胞,B细胞在抗原刺激下可分化为浆细胞,浆细胞有合成和分泌抗体的作用;NK细胞是自然杀伤细胞,具有识别和杀死癌细胞或病毒感染细胞的作用[24]。因此,在免疫功能改善方面,本研究选取以上观察指标,经过研究发现,治疗3 d后观察组CD3+、CD4+、CD4+/CD8+、B细胞百分比较对照组显著升高,NK细胞水平较对照组显著降低,说明CBP的应用能通过滤过、吸附炎性介质改善脓毒症患者免疫功能紊乱状态,本研究结果进一步验证了上述文献观点。
总之,本研究发现,在常规治疗基础上联合CBP能高效清除患者机体内的炎性介质,降低全身炎性反应,有效控制感染,改善患者预后,提高其生活质量,值得临床推广应用。
[1]付素珍,孙 杰,董 云, 等.连续性血液净化对脓毒症患者免疫功能及预后的影响[J].实用医学杂志,2014, 18(17): 2731-2734. DOI: 10.3969/j.issn.1006-5725.2014.17.012.
[2]Sugimoto K, Adomi S, Koike H, et al. Procalcitonin as an indicator of urosepsis [J]. Res Rep Urol, 2013, 26(5):77-80. DOI: 10.2147/RRU.S42711.
[3]孟晓燕, 黄向阳, 谭鹤长, 等.持续低效血液透析联合血液灌流与连续性血液净化治疗脓毒症急性肾损伤的疗效对比[J].中国急救医学, 2014, 21(12): 1061-1064. DOI: 10.3969/j.issn.1002-1949.2014.12.002.
[4]宋 洁 , 李 辉 , 张晓东 , 等 .连续性血液净化对多发伤后并发脓毒症患者血清Ang-2、TNF-α、IL-18 水平及预后的影响[J].细胞与分子免疫学杂志, 2011,27(5): 557-558.
[5]胡 斌.连续性血液净化治疗顽固性心力衰竭的研究进展 [J].当代医学 , 2013, 19(15): 20-22. DOI:10.3969/j.issn.1009-4393.2013.15.009.
[6]林 涛, 黄国庆.心肺脑复苏与连续性血液净化技术[J].当代医学 , 2013, 19(17): 15-18. DOI: 10.3969/j.issn.1009-4393.2013.17.008.
[7]王瑜贵, 韦中余, 雷联会, 等. 连续性血液净化对脓毒症并感染性休克患者免疫功能及细胞因子的影响[J]. 医学理论与实践 , 2017, 30(9): 1258-1260. DOI:10.19381/j.issn.1001-7585.2017.09.004.
[8]誉铁鸥, 周立新, 黎文研, 等. 连续性血液净化对重度脓毒症患者血清炎性细胞因子水平的影响[J]. 山东医药 , 2010, 50(3): 38. DOI: 10.3969/j.issn.1002-266X.2010.03.050.
[9]杨洪光 , 李 峰 , 邹 颋 , 等 . 连续性血液净化对脓毒症患者免疫功能及预后的影响[J]. 当代医学, 2016,22(33): 54-55. DOI: 10.3969/j.issn.1009-4393.2016.33.035.
[10]Rimmelé T, Payen D, Cantaluppi V, et al. Immune cell phenotype and function in sepsis [J]. Shock, 2016, 45( 3):282-291. DOI: 10.1097/SHK.0000000000000495.
[11]Rimmelé T, Kaynar A M, Mclaughlin J N, et al.Leukocyte capture and modulation of cell-mediated immunity during human sepsis: an ex vivo study [J]. Crit Care, 2013, 17 (2): R59. DOI: 10.1186/cc12587.
[12]Ramesh V, Sanjay S, Kellum J A. Clinical review:Extracorporeal blood purification in severe sepsis [J].Critical Care, 2003, 7(2): 139.
[13]Liu H B, Zhang M, Zhang J X, et al. Application of bedside continuous blood purification in patients with multiple organ dysfunction syndromes [J]. World J Emerg Med, 2012, 3(1): 40-43. DOI: 10.5847/wjem.j.issn.1920-8642.2012.01.007.
[14]Renegar J. Complement depletion deteriorates clinical outcomes of severe abdominal sepsis: A conspirator of infection and coagulopathy in crime? [J]. PloS One, 2012,7(10): e47095. DOI: 10.1371/journal.pone.0047095.
[15]Luan Y Y, Dong N, Xie M, et al. The significance and regulatory mechanisms of innate immune cells in the development of sepsis [J]. J Interferon Cytokine Res,2013, 34(1): 2-15. DOI: 10.1089/jir.2013.0042.
[16]Markwart R, Condotta S A, Requardt R P, et al.Immunosuppression after sepsis: systemic inflammation and sepsis induce a loss of naïve T-Cells but no enduring Cell-Autonomous defects in T-Cell function [J]. PloS One, 2014, 9(12): e115094. DOI: 10.1371/journal.pone.0115094.
[17]Esteban E, Ferrer R, Alsina L, et al. Immunomodulation in sepsis: the role of endotoxin removal by polymyxin B-immobilized cartridge [J]. Mediators Inflamm, 2013,2013(6): 507539. DOI: 10.1155/2013/507539.
[18]彭登高 , 卿国忠 , 唐 卓 , 等 .连续性血液净化治疗对严重脓毒症患者血糖水平和胰岛素抵抗的影响研究 [J].中 国 全 科 医 学 , 2013, 16(23): 2706-2708.DOI: 10.3969/j.issn.1007-9572.2013.23.014.
[19]陈深泉, 黎鉴飞, 陈以明, 等.连续血液净化串联血液灌流治疗尿源性脓毒血症的效果分析[J].中国当代医药 , 2016, 23(13): 60-63.
[20]Peng Z Y, Zhang J, Rimmelé T, et al. Development of venovenous extracorporeal blood purification circuits in rodents for sepsis [J]. J Surg Res, 2013, 185(2): 790-796. DOI: 10.1016/j.jss.2013.07.020.
[21]富明民, 胡北平. 连续性血液净化治疗对脓毒症患者外周血炎性因子的影响[J].中国基层医药, 2014(19): 2977-2978. DOI: 10.3760/cma.j.issn.1008-6706.2014.19.040.
[22]Peng Z Y, Wang H Z, Carter M J, et al. Acute removal of common sepsis mediators does not explain the effects of extracorporeal blood purification in experimental sepsis[J]. Kidney Int, 2012, 81(4): 363-369. DOI: 10.1038/ki.2011.320.
[23]Liu LY, Zhu Y J, Li X L, et al. Blood hemoperfusion with resin adsorption combined continuous veno-venoushemofiltration for patients with multiple organ dysfunction syndrome [J]. World J Emerg Med, 2012, 3(1): 44-48. DOI: 10.5847/wjem.j.issn.1920-8642.2012.01.008.
[24]俸小飞 , 邓 琳 , 黄 华 . 连续性血液净化治疗重症脓毒症的微循环及免疫改善效果分析[J]. 标记免疫分析与临床 , 2017, 24(8): 925-928. DOI: 10.11748/bjmy.issn.1006-1703.2017.08.023.
