鸡鸭源性成分荧光LAMP检测方法的建立及应用
2018-03-01徐淑菲孔繁德林双庆
徐淑菲,孔繁德,苗 丽,林双庆
(1. 厦门出入境检验检疫局,福建厦门 361026;2. 河南出入境检验检疫局,河南郑州 450003)
肉和肉制品中的“掺杂使假”是食品质量控 制面临的主要挑战之一[1],也是消费者投诉的焦点之一。由于价格差异带来的利益诱惑,驱使一些不法商贩或企业在牛、羊、鹿等高价肉制品中掺杂一些低价值的肉原料,如猪肉、鸡肉、鸭肉,以及皮毛类动物肉,如狐狸、水貂、海狸鼠、貉等,甚至还用鼠肉充当羊肉,或者将低价肉经过香精处理后冒充高价肉[2-3]。这些“掺杂使假”行为不仅侵害了消费者权益,有时还涉及到民族问题或是宗教问题,从而造成恶劣的社会影响。如果问题产品出口到国外,则会损害我国食品企业的整体形象,从而影响出口贸易[4]。尽管国外食品生产有较严格的可追溯程序(即每份产品中的所有成分都可以追溯到来源养殖场,所有中间环节产品处理也可以追溯到相关供应商),但也有类似的肉类掺假报道,同样使人担忧。为了快速鉴别牛羊肉中是否掺杂了鸡肉、鸭肉等其他肉类,本文建立了比PCR和qPCR更为快速简便的荧光LAMP方法。
1 材料与方法
1.1 材料
1.1.1 样品的采集和处理 试验所用的鸡肉、鸭肉、猪肉、牛肉、犬血液、鸽子、鱿鱼、罗非鱼等:厦门出入境检验检疫局动物检疫实验室检验项目样品;山羊肉、绵羊肉:购自厦门市市场;鼠肉:来自实验用动物;狐狸肉:河南出入境检验检疫局提供;TaKaRa马核酸、TaKaRa兔核酸:宝生物工程(大连)有限公司产品。
1.1.2 主要试剂和仪器 组织DNA提取试剂盒:LabServ公司产品;IMM(Isothermal master mix)试剂:北京晟泰勃科技有限公司产品;2×Taq PCR MasterMix、DL 2000 DNA Marker:TaKaRa公司产品;Veriti 96孔型PCR仪:ABI公司;Genie II等温扩增荧光检测系统:OptiGene公司;Biophotometer plus型核酸蛋白测定仪:Eppendorf公司。
1.1.3 引物
1.1.3.1 LAMP引物序列 对不同动物的线粒体基因序列进行比对,选取鸡、鸭CytB基因作为鸡或鸭源性成分的检测基因,对应的GenBank号分别为AY029583.1、EU585609.1(表1)。
1.1.3.2 vLAMP扩增片段 红色粗字体为外引物猪F3序列和猪B3的颠倒互补序列,红色粗字体之间的基因序列为LAMP扩增片段(表2)。
1.1.3.3 PCR引物 根据文献[5]中的鸡鸭特异性引物序列合成引物。鸡扩增片段大小为256 bp,鸭扩增片段大小为292 bp(表3)。

表1 LAMP引物序列

表2 鸡、鸭CytB基因LAMP扩增片断
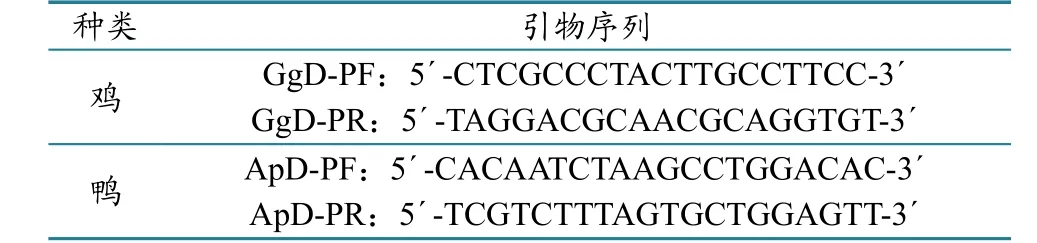
表3 PCR引物序列
1.1.3.4 引物浓度 鸡FIP、BIP,鸭FIP、BIP均为20 µmol/L;鸡F3、B3、LoopB、loopF,鸭F3、B3、LoopB、loopF均为10 µmol/L。PCR所有引物浓度均为10 µmol/L。
1.2 方法
1.2.1 DNA提取 按照LabServ公司生产的组织DNA提取试剂盒说明书,提取各样品DNA。经核酸蛋白测定仪测定,鸡肉、鸭肉提取的核酸浓度分别为2.2×102、8.3×102µg/mL。
1.2.2 LAMP方法的建立及优化 参考本课题组牛、羊、猪源性成分LAMP方法优化的过程及方案,将鸡、鸭源性成分LAMP检测的反应组分进行内外引物工作浓度比优化、引物工作浓度优化、Loop引物加速试验和反应温度优化等试验[6-7]。
1.2.3 溶解曲线 根据优化后的最佳反应体系和条件进行本试验。对鸡(或鸭)源性成分的LAMP检测进行2个重复,设置1个空白对照。
1.2.4 灵敏度试验 将鸡、鸭源性成分核酸分别进行10倍连续梯度稀释。稀释倍数依次为10-1、10-2、10-3、10-4、10-5、10-6。
1.2.4.1 LAMP方法 根据优化的最佳反应体系和条件进行。反应管内依次加入10-1、10-2、10-3、10-4、10-5、10-6倍稀释的对应鸡(或鸭)源性成分核酸1 µL,补充水至25 µL。
1.2.4.2 PCR方法 反应体系包括:2×Taq PCR MasterMix 12.5 µL,引物各1 µL,依次加入10-1、10-2、10-3、10-4、10-5、10-6倍稀释的鸡或鸭源性成分核酸各1 µL,补充水至25 µL。反应条件:94 ℃3 min;94 ℃ 30 s、54 ℃ 30 s、72 ℃ 30 s,30个循环;72 ℃ 3 min。
1.2.5 特异性试验 根据优化后的最佳反应体系和条件进行本试验。第1~15管依次加入鸡核酸、鸭核酸、猪核酸、绵羊核酸、鼠核酸、狐核酸、TaKaRa马核酸、罗非鱼核酸、鱿鱼核酸、鸽核酸、犬核酸、山羊核酸、牛核酸、TaKaRa兔核酸各1 µL,补充水至25 µL。
2 结果与分析
2.1 LAMP方法优化
鸡或鸭源性成分LAMP检测方法的内外引物最佳工作浓度比(FIP+BIP)∶(F3+B3)均为4∶1(图1);引物FIP、BIP、F3、B3的最佳工作浓度分别为1.6、1.6、0.4、0.4 µmol/L(图2)。对于鸡源性成分LAMP检测方法,63~68 ℃均可得到较好的试验结果;对于鸭源性成分LAMP检测方法,最佳反应温度范围为62~65 ℃(图3)。
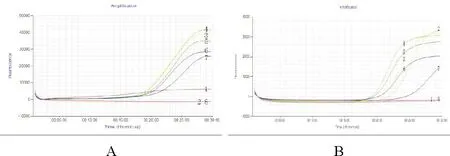
图1 内外引物工作浓度比的优化
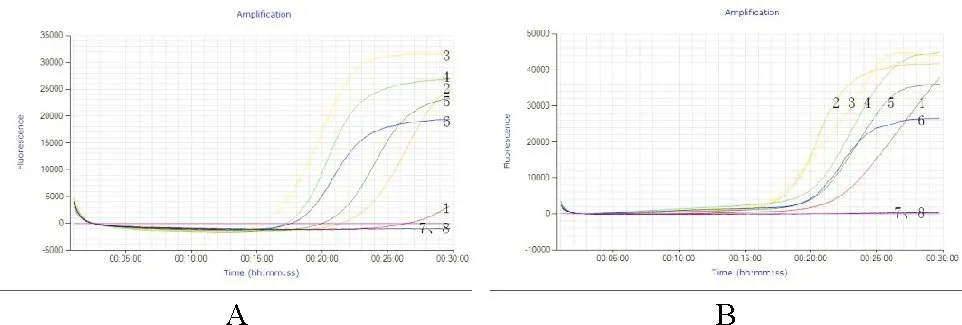
图2 引物FIP、BIP、F3、B3工作浓度优化
A. 鸡源性成分检测LAMP方法;B. 鸭源性成分检测LAMP方法;1. 工作浓度分别为0.4、0.4、0.1、0.1 µmol/L;2. 工作浓度分别为0.8、0.8、0.2、0.2 µmol/L;3. 工作浓度分别为1.6、1.6、0.4、0.4 µmol/L;4. 工作浓度分别为3.2、3.2、0.8、0.8 µmol/L;5. 工作浓度分别为6.4、6.4、1.6、1.6 µmol/L;6. 工作浓度分别为12.8、12.8、3.2、3.2 µmol/L;7、8. 空白对照
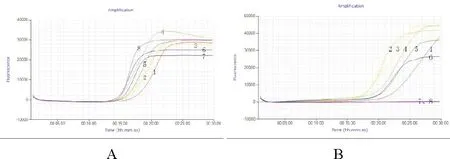
图3 方法反应条件优化
鸡或鸭源性成分LAMP检测方法的加速引物试验证明,加速双引物的加速作用强于加速单引物;两条加速单引物的加速作用相似;无加速引物的反应所需反应时间最久(图4)。加速引物的加速作用仅限于加快反应速度,缩短反应时间,并不会增加假阳性概率。加速单引物可以使反应时间缩短一半左右,反应时间应该适当缩短,可设置为20 min左右;加速双引物可以使反应时间缩短2/3左右,反应时间可设置为15 min左右。
LAMP方法中的溶解曲线是报告中的退火导数(Anneal derivative)。鸡、鸭LAMP的溶解曲线的峰值分别为87.1、85.2 ℃,均只有1个峰,且重复性良好,进一步佐证了鸡、鸭LAMP方法的可信度(图5)。
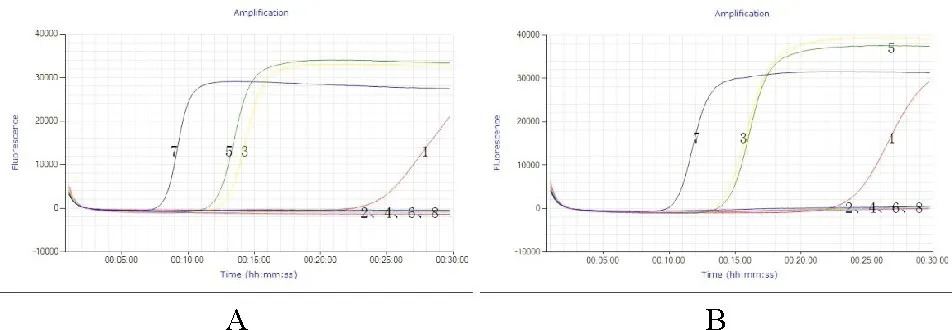
图4 Loop引物的加速结果
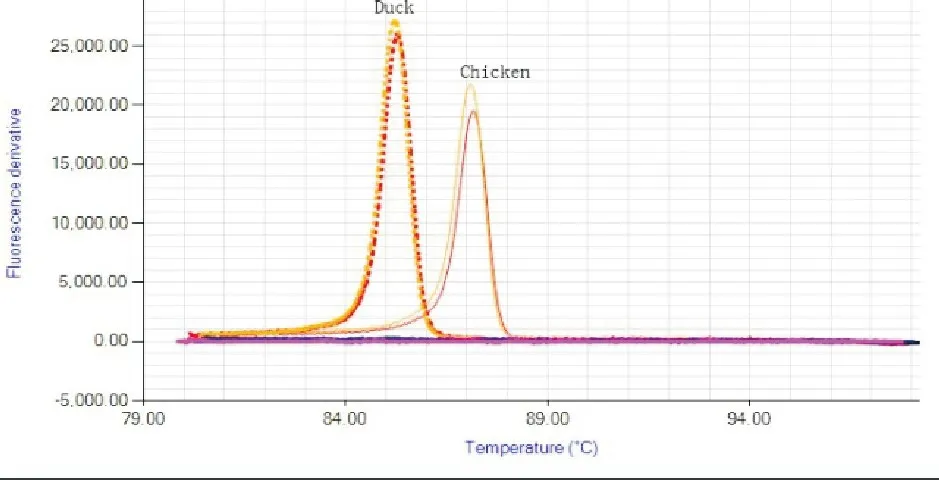
图5 溶解曲线
2.2 灵敏度
鸡鸭源性成分LAMP检测方法:10-1~10-4倍稀释的核酸孔均出现典型的扩增曲线,10-4倍稀释的核酸孔出现扩增曲线,30 min内未出现Ct值,延长时间会出现Ct值。鸡源性成分PCR检测方法:10-1~10-3倍稀释的核酸孔均出现清晰的256 bp的目的条带。两者LAMP方法的灵敏度比PCR方法高10倍。鸭源性成分LAMP检测方法:10-1~10-4倍稀释的核酸均出现典型的扩增曲线,30 min内均出现Ct值;鸭源性成分PCR检测方法:10-1~10-3倍稀释的核酸孔均出现清晰的292 bp的目的条带。鸭源性成分LAMP检测方法比PCR方法更灵敏(图6、表4)。
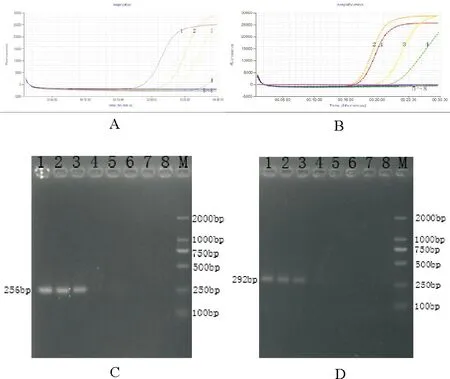
图6 灵敏度试验
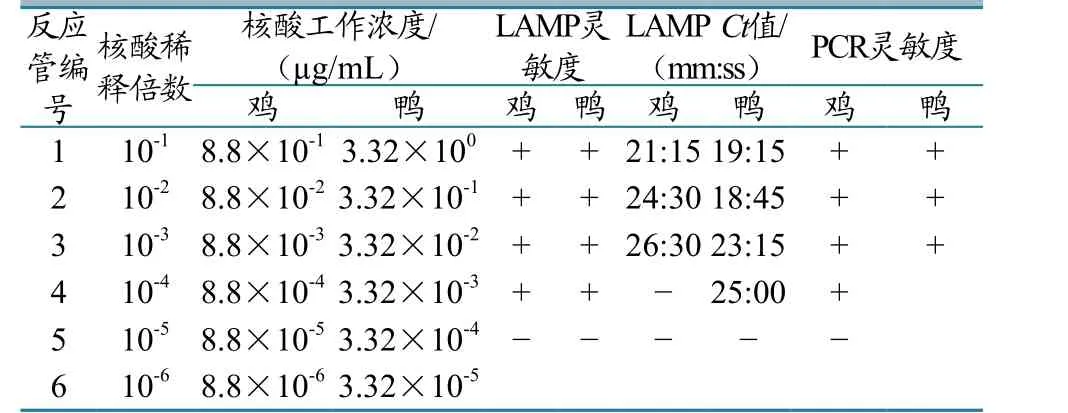
表4 灵敏度试验结果
2.3 特异性
鸡鸭源性成分LAMP检测方法只有相对应的反应孔有典型的扩增曲线,其他11种动物核酸均未出现扩增曲线(图7)。由此可见,本文建立的鸡鸭动物源性成分LAMP检测方法具有良好的特异性,结合溶解曲线只有1个峰值,说明该方法具有更高的可信度。
2.4 应用
对市场上50份牛肉、羊肉、鸡肉、鸭肉制品等进行了鸡鸭源性成分检测。在市场中的牛肉、羊肉制品中未发现鸡鸭源性成分;在鸡肉制品中检出鸡源性成分,鸭肉制品中检出鸭源性成分。应用结果说明该方法特异性较好,可以用于市场检测。而且本文建立的方法和PCR方法检测结果一致。
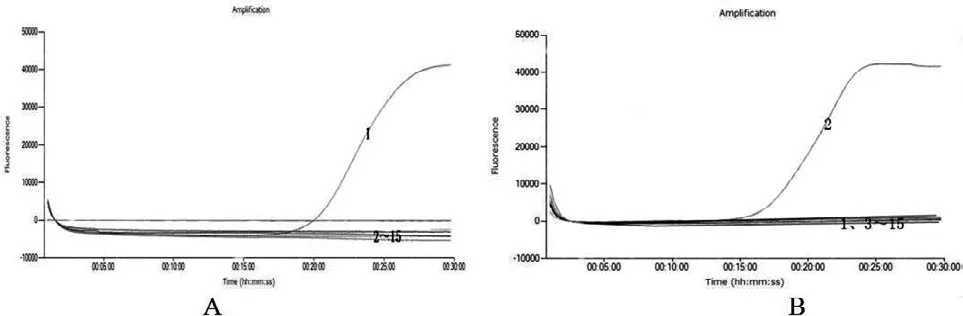
图7 LAMP检测方法特异性分析
3 讨论
传统的LAMP方法灵敏度高(比传统的PCR方法高2~5个数量级),反应时间短(30~60 min就能完成反应),临床使用不需要特殊的仪器,操作简单。但传统的LAMP方法也有缺点:(1)反应完毕开盖加荧光染料,易形成气溶胶污染,加上目前国内大多数实验室不能严格分区,使得假阳性问题较严重;(2)肉眼观察判定结果的主观性强,对于弱阳性试验,易出现错判;(3)引物设计要求高。
为了克服传统LAMP方法的缺点,本文建立了检测鸡鸭源性成分的荧光LAMP方法。这是在传统LAMP方法的基础上,通过等温扩增荧光检测系统完成的。核酸等温扩增技术与生物荧光检测技术相结合,通过对温度的精确控制,使核酸在恒温条件下进行快速扩增,扩增过程中荧光激发和检测系统完成对扩增过程的实时动态监控,通过实时扩增曲线和产物溶解曲线,判定阴阳性并分析实验结果。本方法也兼容多种荧光指示剂,如生物荧光,荧光染料,钙黄绿素和荧光探针等。
相对于传统的LAMP方法,本文建立的方法优点:(1)反应时间更短(最快仅需15~20 min;10 min左右就可进行实时初判);(2)通过实时扩增曲线和产物溶解曲线判定阴阳性并分析实验结果,更可靠;(3)反应前加入染料,不需二次开盖,减少了污染。其缺点和传统的LAMP一样,对引物设计要求高。
本文在建立了牛、羊、猪源性成分LAMP检测方法的基础上,进一步建立了鸡鸭源性成分LAMP检测方法。对照最佳反应体系发现,最佳内外引物工作浓度比(FIP+BIP)∶(F3+B3)均为4∶1,最佳引物FIP、BIP、F3、B3工作浓度均分别为1.6、1.6、0.4、0.4 µmol/L。牛、猪、鸡和鸭源性成分的最佳扩增反应温度范围分别为64~66、65~68、63~68、62~65 ℃,默认扩增反应温度是65 ℃。故这4种动物源性成分检测的LAMP方法均采用65 ℃作为扩增反应温度。羊最佳扩增反应温度范围为66~68 ℃,选择最接近默认扩增反应温度的66 ℃作为扩增反应温度。
为防止污染,本试验在操作过程中,将核酸样本加样区和其他试剂加样区分别设在2个PCR专用超净工作台。除核酸样本外的其他试剂加入到反应管后,盖好盖子,然后移至核酸样本加样区,打开盖子并加入对应的核酸样本后,立即盖紧盖子,再操作下一个核酸样本,避免交叉污染。核酸样本加样顺序为空白对照、阴性对照、各反应核酸样本、阳性对照。
[1] 李家鹏,乔晓玲,田寒友,等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学,2011,32(9):340-347.
[2] 李巧玲,刘景艳. 市场鲜猪肉掺假状况的调查监测[J].食品科学,2004 25(10):273-276.
[3] LÓPEZ-CALLEJA I,GONZÁLEZ I,FAJARDO V.Quantitative detection of goats' milk in sheep's milk by real-time PCR[J]. Food control,2007,8(11):1466-1473.
[4] 张彦明. 我国动物性食品安全存在的问题及控制对策[C]//中国畜牧兽医学会. 中国畜牧兽医学会2009学术年会论文集(上册). 北京:中国畜牧兽医学会,2009:10.
[5] HAUNSHI S,BASUMATARY R,GIRISH P S,et al.Identification of chicken,duck,pigeon and pig meat by species-specific markers of mitochondrial origin[J]. Meat science,2009,83:454-459.
[6] 徐淑菲,孔繁德,苗丽,等. 羊源性成分LAMP检测方法的建立[J]. 经济动物学报,2016,20(4):200-206.
[7] 徐淑菲,孔繁德,苗丽,等. 牛源性成分LAMP检测方法的建立[J]. 中国动物检疫,2016,33(12):94-99.
