Fgl2基因对H9C2心肌细胞凋亡的影响
2018-02-27仉慧颖邱一凡
仉慧颖 耿 威 陈 岩 赵 欣 邱一凡
(大庆油田总医院心脏无创科,黑龙江 大庆 163001)
研究表明,各种心肌疾病中均出现心肌细胞凋亡,而心肌细胞凋亡是引起各种慢性心力衰竭、心室重塑等的主要因素〔1〕。因此,治疗心肌疾病的关键措施是抑制心肌细胞的凋亡,改善心肌生存环境,减轻心脏重塑。纤维蛋白原样蛋白(Fgl)2主要在T细胞、内皮细胞、巨噬细胞中表达,是一种Ⅱ型跨膜糖蛋白,有免疫调节和凝血功能〔2〕。人Fgl2蛋白是纤维蛋白原家族的成员,与纤维样蛋白有类似的结构,可直接催化凝血酶原转化为凝血酶,将纤维蛋白原降解为不溶型纤维蛋白,最终形成血栓。目前以Fgl2为靶点的基因干预已成为治疗缺血性心脏病、心力衰竭等新的有效靶点〔3,4〕。本研究中通过沉默H9C2心肌细胞中Fgl2的表达,探讨其对细胞凋亡的影响其机制。
1 材料与方法
1.1细胞株 H9C2心肌细胞株购自中国科学院细胞库。
1.2主要试剂和仪器 胎牛血清、RPMI1640培养基均购自美国Gibco公司;阴性病毒和Fgl2 siRNA慢病毒购自上海吉凯基因化学技术有限公司;二喹啉甲酸(BCA)蛋白定量试剂盒和电化学发光(ECL)试剂盒购自美国Piece;细胞凋亡试剂盒购自江苏碧云天公司;酶切caspase3、Notch1、Hes1抗体均购自美国abcam公司;CO2细胞培养箱购自美国西盟公司;流式细胞仪购自美国Becton Dickinson公司;电泳凝胶图像分析系统、聚丙烯酰胺凝胶电泳仪均购自Bio-Rad公司。
1.3细胞培养 从-80℃冰箱取出装有H9C2心肌细胞的冻存管,即刻放入37℃水浴锅中解冻,期间轻轻摇动冻存管使其在1~2 min内溶解。将溶解后的细胞放在含有10%胎牛血清的RPMI1640细胞培养液中,37℃、5% CO2、95%饱和湿度的恒温培养箱中培养。第2天换液。根据实验需要传代,取对数生长期的细胞用于实验研究。
1.4细胞转染及转染效果检测 以1×105个/孔将生长至对数期的H9C2心肌细胞接种于6孔细胞培养板中,细胞生长密度达到60%时更换为新鲜的培养基,空白试剂、阴性病毒和Fgl2 siRNA慢病毒感染H9C2心肌细胞,分别为空白对照组,阴性对照组及Fgl2-siRNA组。取感染后48 h的细胞,加入PMSF和RIPA裂解液置于冰上反应30 min,4℃,12 000 r/min离心15 min,收集蛋白。取少量蛋白样品BCA试剂盒对蛋白进行定量。取50 μg蛋白样品于12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电泳结束后PVDF转膜、5%脱脂奶粉封闭,加入一抗(1∶400稀释的Fgl2和1∶1 000稀释的GAPDH),4℃孵育过夜,次日TBST洗膜3次,每次洗涤5 min,加入1∶1 000稀释的辣根过氧化物酶标记的羊抗鼠IgG,室温孵育1 h,TBST洗膜,ECL化学发光剂显色,室温避光环境中显影,定影。以GAPDH作为内参,分析Fgl2的蛋白表达水平。
1.5细胞凋亡检测 以1×105个/孔的浓度将各组转染后的细胞接种于96孔细胞培养板中,48 h后收集细胞,加入预冷的PBS洗涤细胞2次,250 μl的结合缓冲液重悬细胞,制成单细胞悬液,调整细胞浓度为1×106个/ml。按照凋亡试剂盒说明书操作,加入Annexin V-PE/7-AAD进行双标记,流式细胞术检测细胞凋亡情况,计算细胞凋亡率。
1.6Western印迹检测酶切caspase3、Notch1、Hes1蛋白表达 取转染后培养48 h的各组细胞,按照1.4方法提取细胞中的蛋白,BCA试剂盒检测蛋白浓度,检测酶切caspase3、Notch1、Hes1蛋白表达。
1.7统计学方法 应用SPSS21.0软件,计量资料组间差异比较采用单因素方差分析,两组比较采用t检验。
2 结 果
2.1各组Fgl2蛋白表达水平比较 空白对照组和阴性对照组Fgl2蛋白表达〔(0.447±0.052) vs (0.442±0.056)〕差异无统计学意义(P>0.05),Fgl2-siRNA组Fgl2蛋白表达(0.183±0.029)显著低于空白对照组(P<0.01)。见图1。
2.2各组H9C2细胞凋亡的比较 与空白对照组〔(1.26±0.28)%〕及阴性对照组〔(1.25±0.30)%〕比较,Fgl2-siRNA组H9C2细胞凋亡〔(5.77±0.58)%〕明显降低(P<0.01)。
2.3各组酶切caspase3、Notch1、Hes1蛋白表达情况比较 与空白对照组及阴性对照组比较,Fgl2-siRNA组酶切caspase3蛋白显著下调表达,Notch1、Hes1蛋白显著上调表达(P<0.01)。见图2,表1。
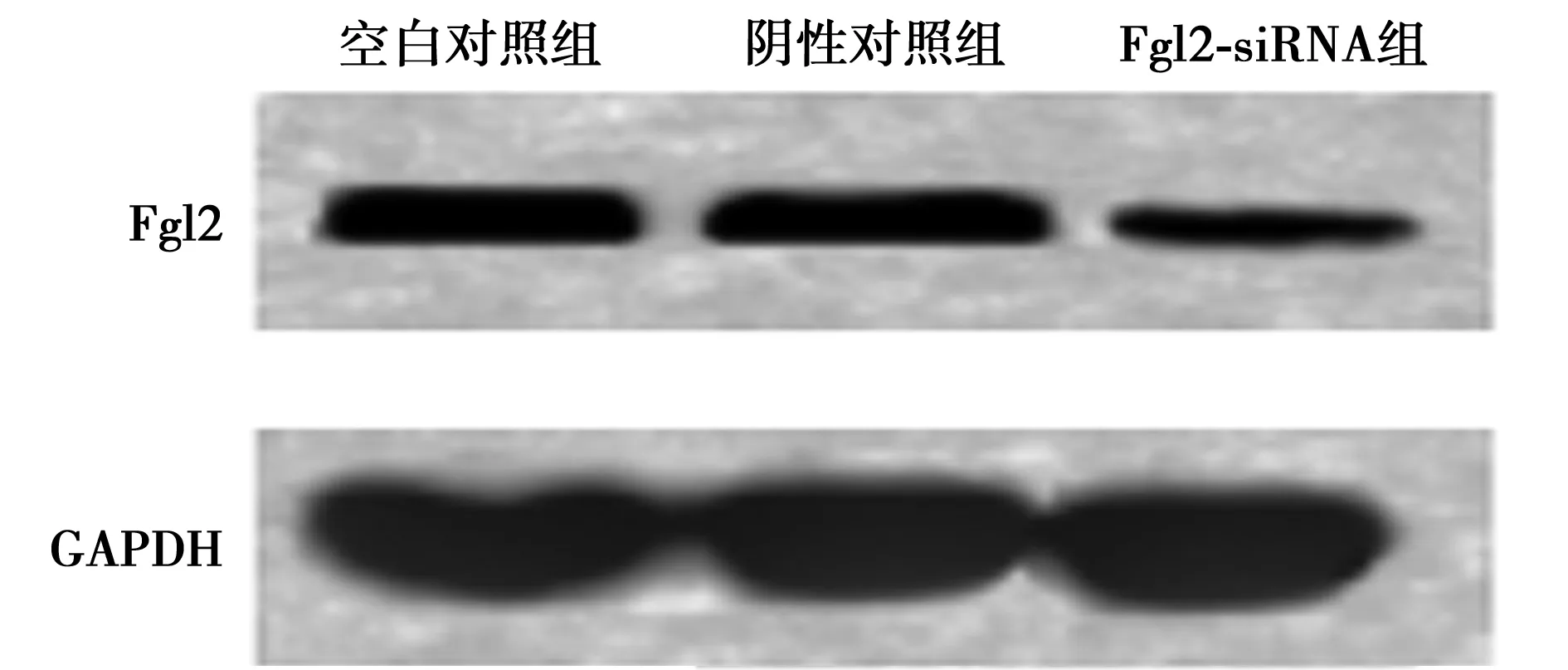
图1 各组Fgl2蛋白表达
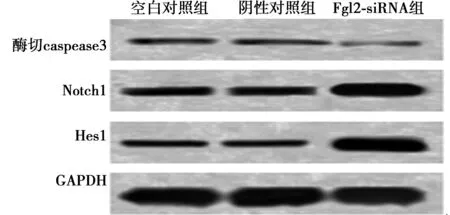
图2 各组酶切caspase3、Notch1、Hes1蛋白表达

组别酶切caspase3Notch1Hes1空白对照组0.061±0.0121)0.365±0.0361)0.194±0.0291)阴性对照组0.062±0.0131)0.361±0.0391)0.196±0.0311)Fgl2-siRNA组0.032±0.0090.798±0.0540.669±0.057
与Fgl2-siRNA组比较:1)P<0.01
3 讨 论
心血管疾病是严重危害人类健康的重要疾病,主要的发病机制是心肌缺血缺氧后引起的心肌细胞凋亡、心室扩张、心脏重塑,最终导致心力衰竭〔5〕。Fgl2是一种新的凝血因子,主要在内皮细胞、T细胞中表达。人Fgl2属于纤维蛋白原家族,参与自然性流产、爆发性肝炎等的病理过程,通过触发性炎症/血栓的形成,高表达于局部组织,启动凝血过程,导致微血栓形成、纤维蛋白沉积等,最终引起脏器的功能障碍〔6〕。研究显示,沉默Fgl2基因的表达可降低糖尿病大鼠的心脏功能,抑制心肌细胞的凋亡〔7〕。
细胞凋亡是细胞的一种程序性死亡过程,对细胞功能维持、组织器官的形态发展有重要的生理意义〔8〕。本研究结果显示,沉默Fgl2的表达后H9C2细胞的凋亡明显降低。caspase家族是细胞凋亡过程中的重要通路,caspase3是caspase家族的关键酶,是细胞凋亡过程中的关键执行者,是多种凋亡刺激信号的最终汇集点,其活性是凋亡进入不可逆阶段的标志,因此被称为“凋亡的执行者”〔9〕。有研究显示,下调caspase3的表达可降低心肌细胞的凋亡〔10〕。本研究结果说明沉默Fgl2表达可通过抑制酶切caspase3表达降低心肌细胞凋亡。
Notch信号通路是高度保守的信号转导通路,调控细胞的增殖、凋亡、分化、器官发育等过程,其活化与炎症、氧化应激等密切相关〔11〕。哺乳动物有4个Notch(Notch1~4)同源受体和5个同源配体。已有多项研究证实Notch1有抑制细胞凋亡的功能,Notch1信号通路的激活对心肌细胞的缺氧复氧有保护作用〔12〕。Hes1是Notch1信号通路最重要的靶基因,其表达是Notch1信号通路是否激活的重要标志。本研究沉默Fgl2表达后Notch1、Hes1蛋白表达均显著上调。
综上所述,沉默Fgl2表达可通过激活Notch1信号通路降低心肌细胞凋亡,为心血管疾病的分子靶向治疗提供了一定的理论基础。
1Jia Z,Wang J,Shi Q,etal.SOX6 and PDCD4 enhance cardiomyocyte apoptosis through LPS-induced miR-499 inhibition〔J〕.Apoptosis,2016;21(2):174-83.
2Bartczak A,Chruscinski A,Mendicino M,etal.Overexpression of fibrinogen-like protein 2 promotes tolerance in a fully mismatched murine model of heart transplantation〔J〕.Am J Transplant,2016;16(6):1739-50.
3Wu D,Wang H,Yan W,etal.A disparate subset of double-negative T cells contributes to the outcome of murine fulminant viral hepatitis via effector molecule fibrinogen-like protein 2〔J〕.Immunol Res,2016;64(2):518-30.
4Sherman S,Rabizadeh E,Moyal L,etal.Fibrinogen-like protein 2 activity as a potential biomarker for diagnosis of early mycosis fungoides〔J〕.Acta Derm Venereol,2017;97(3):370-2.
5Howlett JG,Chan M,Ezekowitz JA,etal.The Canadian cardiovascular society heart failure companion:bridging guidelines to your practice〔J〕.Can J Cardiol,2016;32(3):296-310.
6Cheng J,Chen Y,Xu B,etal.Association of soluble fibrinogen-like protein 2 with the severity of coronary artery disease〔J〕.Intern Med,2016;55(17):2343-50.
7Hirasawa M,Takubo K,Osada H,etal.Angiopoietin-like protein 2 is a multistep regulator of inflammatory neovascularization in a murine model of age-related macular degeneration〔J〕.J Biol Chem,2016;291(14):7373-85.
8Pushpavalli SN,Sarkar A,Ramaiah MJ,etal.Drosophila MOF regulates DIAP1 and induces apoptosis in a JNK dependent pathway〔J〕.Apoptosis,2016;21(3):269-82.
9韦家俊,李 浩,廖小明,等.肢体缺血后处理对局灶性脑缺血再灌注大鼠 Caspase-3 和细胞凋亡的影响〔J〕.中国老年学杂志,2017;37(4):804-6.
10Zhang N,Ye F,Zhu W,etal.Cardiac ankyrin repeat protein attenuates cardiomyocyte apoptosis by upregulation of Bcl-2 expression〔J〕.Biochim Biophys Acta,2016;1863(12):3040-9.
11Turkoz M,Townsend RR,Kopan R.The Notch intracellular domain has an RBPj-independent role during mouse hair follicular development〔J〕.J Invest Dermatol,2016;136(6):1106-15.
12Zhang C,Liu X,Zhang C,etal.Phosphorylated eEF2 is SUMOylated and induces cardiomyocyte apoptosis during myocardial ischemia reperfusion〔J〕.J Cardiol,2017;69(4):689-98.
