灌服饱和甲烷水对大鼠运动能力及改善力竭运动导致肝脏氧化应激的影响
2018-02-27胡静芸陈笑欢娄淑杰
胡静芸 辛 磊 陈笑欢 王 茜 娄淑杰
(上海体育学院运动科学学院,上海 200438)
力竭运动会造成肝脏氧化应激损伤,引起粗面内质网扩张、断裂及线粒体肿胀,并减少糖原的合成量〔1〕。近年来动物实验发现,吸入2.5%的甲烷(CH4)气体不仅能改善血液供应,还具有抗感染、抗氧化的生物学效应。而腹腔注射饱和甲烷水(0.99 mmol/L)能显著改善大鼠小肠、肝脏等组织器官的缺血再灌注损伤〔2~6〕。但CH4在国内外运动实践中的应用研究还未见相关报道。SD大鼠在运动前腹腔注射饱和甲烷水能提高其力竭运动中的血糖利用率,减少运动后的代谢产物堆积,同时减轻骨骼肌氧化应激损伤的程度,从而起到抗疲劳的作用,延长其运动时间〔7〕。但是注射会损伤皮肤和黏膜,而口服更便利经济。本实验拟探讨灌服饱和甲烷水对SD大鼠运动能力和肝脏氧化应激的影响。
1 材料与方法
1.1实验动物与分组 8周龄健康雄性SD大鼠18只,体重160~180 g,由上海西普尔-必凯实验动物有限公司提供(许可证批号:SCXK(沪)2013-0016)。按体重随机分为安静对照组(C组)、运动安慰剂组(EP组)和运动甲烷水组(EM组),每组6只。大鼠分笼喂养,每笼3只,自由进食饮水。光照时间8:00~18:00,室内温度22℃±3℃,相对湿度50%~60%。
1.2饱和甲烷水制备 参照Xin等〔8〕饱和甲烷水的制备方法,用注射器将充有2/3容积蒸馏水的医用注射液袋内的空气抽尽,再缓慢充满CH4气体(甲烷购自上海基量标准气体有限公司),将其置于0.4 MPa压力下加压5 h,使CH4气体溶于蒸馏水中达到饱和,使用前1 d制备,4℃贮存。
1.3运动方案 参照Huang等〔9〕的大鼠力竭运动模型并加以改进。大鼠适应性饲养1 w后,EP组和EM组进行3 d适应性跑台训练,10 min/d,跑速10 m/min,C组不运动。休息2 d后所有大鼠禁食过夜,EP组、EM组大鼠分别在运动前30 min灌服4 ml蒸馏水和饱和甲烷水,跑台坡度为0°,初始速度为10 m/min,10~20 min内逐渐将速度增至25 m/min,持续运动至力竭,并记录大鼠的运动时间。C组放于跑台旁边,不做任何干预。运动后期,大鼠跑步较前期明显吃力,不能坚持原跑速,由蹬地跑变为半卧位跑,腹部与跑道时有接触。运动末期,大鼠先后滞留跑台后1/3处达3次以上,各种刺激驱赶无效,停跑后表现为腹卧位,呼吸急促,神情倦怠,对刺激反应迟钝,捕捉时逃避反应明显减弱,判定为力竭。
1.4实验取材及指标检测 力竭运动后所有大鼠经腹腔注射10%水合氯醛(4 ml/kg体重)麻醉处死,下腔静脉取血5 ml于促凝采血管,室温静置30 min,3 000 r/min离心10 min后取血清,-80℃冰箱保存待测。速取肝脏组织,用0.9%生理盐水冲洗干净,锡箔纸包好,迅速放入液氮中,之后移入-80℃冰箱保存。化学比色法检测肝脏组织中的肝糖原、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-PX)水平,检测血清中血糖(GLU)、乳酸(LD)、尿素氮(BUN)、乳酸脱氢酶(LDH)、肌酸激酶(CK)水平,试剂盒均购自南京建成生物工程研究所。酶联免疫吸附(ELISA)法检测肝脏组织中3-硝基酪氨酸(NT)和8-羟基脱氧鸟苷(OHdG)含量,试剂盒均购自武汉华美生物工程有限公司。各指标的测定严格按试剂盒提供的步骤进行。
1.5统计学方法 应用SPSS17.0软件进行单因素方差分析、t检验。
2 结 果
2.1灌服饱和甲烷水对大鼠运动总时间的影响 运动前30 min给大鼠灌服饱和甲烷水后,EM组运动至力竭总时间〔(122.50±14.20)min〕显著长于EP组〔(88.50±9.77)min,P<0.01〕。
2.2灌服饱和甲烷水对大鼠GLU和肝糖原含量的影响 力竭运动后,EP组血清中GLU浓度〔(5.32±0.49)mmol/L〕和肝脏中肝糖原含量〔(1.36±0.49)mg/g〕均显著低于C组〔(6.75±0.24)mmol/L,(1.95±0.39)mg/g〕,而EM组〔(6.37±0.54)mmol/L、(1.94±0.48)mg/g〕均显著高于EP组(P<0.01,P<0.05)。
2.3灌服饱和甲烷水对大鼠血清中LD和BUN含量的影响 力竭运动后,EP组大鼠血清中LD和BUN含量〔(9.00±1.86)、(19.10±2.52)mmol/L〕均显著高于C组〔(6.40±0.74)、(14.58±1.27)mmol/L〕,而EM组〔(5.74±0.71)、(16.25±1.06)mmol/L〕均显著低于EP组(P<0.01,P<0.05)。
2.4灌服饱和甲烷水对大鼠血清中CK和LDH水平的影响 力竭运动后,EP组大鼠血清中CK浓度和LDH活性〔(2.17±0.39)U/ml、(4 201.76±523.63)U/K〕均显著高于C组〔(1.19±0.38)U/ml、(2 196.49±380.04)U/K〕(P<0.01),而EM组〔(1.80±0.32)U/ml、(3 794.74±564.46)U/K〕与EP组差异无统计学意义(P>0.05)。
2.5灌服饱和甲烷水对大鼠肝脏氧化应激的影响 力竭运动后,EP组3-NT、8-OHdG和MDA含量均显著高于C组(P<0.05,P<0.01);EM组3-NT和8-OHdG含量低于EP组,但差异无统计学意义(P>0.05),MDA含量显著低于EP组(P<0.05)。EP组SOD活性、GSH-PX活力低于C组,但差异无统计学意义(P>0.05),T-AOC水平显著低于C组(P<0.05);EM组SOD活性、GSH-PX活力和T-AOC水平均显著高于EP组(P<0.01)。见表1。
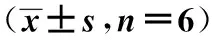
表1 灌服饱和甲烷水对大鼠肝脏氧化应激的影响
与C组比较:1)P<0.05,2)P<0.01;与EM组比较:3)P<0.05,4)P<0.01
3 讨 论
在运动实践中,GLU、肝糖原、LD、BUN、CK、LDH等指标可以反映运动能力,指标的变化可用于评价运动后身体功能的恢复情况〔10〕。GLU是维持运动的重要能量来源,长时间运动会导致GLU浓度下降,而为了维持GLU的动态平衡,肝脏会分解肝糖原释放葡萄糖入血〔11〕。本研究结果表明,力竭运动会使肝糖原储量明显减少,GLU浓度下降,从而引起糖供能水平下降,这可能是导致大鼠运动能力下降的重要原因之一。另外运动前灌服饱和甲烷水在大鼠力竭运动后能促进GLU和肝糖原的及时恢复,这可能是CH4改善了大鼠的血液供应,并提高了肝脏的糖异生水平,使非糖物质快速合成葡萄糖。
血液中LD是运动过程中糖酵解反应的代谢物,其浓度随运动强度的增大而上升〔12〕。LD浓度上升,会导致肌肉中H+浓度升高,pH下降,从而影响糖酵解、磷酸果糖激酶活性及Ca2+的释放,最终影响肌肉收缩。BUN是蛋白质代谢的主要终末产物,它是评定运动后功能状态的敏感指标,能反映运动后体内蛋白质的代谢情况〔13〕。本研究中EP组大鼠血清中LD水平显著升高,这可能是一次性力竭运动过程中糖酵解产生的LD不能及时得到清除造成的。长时间剧烈运动会导致肌糖原含量和GLU浓度下降,并引起蛋白质分解代谢加强,生成大量的BUN并在体内堆积。而EM组大鼠血清中LD、BUN水平显著低于EP组,这可能是因为CH4会加速血液循环,提高肝脏清除代谢产物的效率。此外,血清中CK水平在运动实践中是评价肌肉损伤、肌萎缩的重要生化指标〔24〕。正常状态下,CK主要存在于骨骼肌内,血清中活性很低。力竭运动会使机体产生大量的活性氧(ROS)和其他自由基,引起脂质过氧化反应,损伤肌细胞,造成肌细胞膜通透性改变,使得肌肉中的CK大量进入血液,引起血清中CK活性迅速升高〔10〕。此外,血清中LDH也是反映大强度运动后肌肉损伤的重要标志〔14〕。本研究结果表明,力竭运动引起了EP组和EM组大鼠骨骼肌受损,而EM组骨骼肌的损伤程度较轻。同时本研究还发现,EM组大鼠血清中的CK、LDH水平和肝脏中的3-NT、8-OHdG含量与EP组相比并没有显著性变化,这可能是4 ml的饱和CH4水灌服剂量不足或运动前灌服CH4水后的消化吸收时间较短等原因造成的。
大强度运动会导致体内氧化与抗氧化系统失衡,引起氧化应激,并对组织造成损伤。本研究结果表明,力竭运动引起了肝脏氧化应激。在运动前给大鼠灌服饱和甲烷水能提高大鼠肝脏抗氧化能力,调节肝脏氧化与抗氧化平衡,从而减轻力竭运动造成的肝脏氧化应激的程度,延长运动持续时间。本研究的结果提示,饱和甲烷水采用灌服的方式也能发挥较好的抗氧化作用,能促进力竭运动后身体功能的快速恢复,具有较大的潜在应用价值。
1Chen YM,Wei L,Chiu YS,etal.Lactobacillus plantarum TWK10 supplementation improves exercise performance and increases muscle mass in mice〔J〕.Nutrients,2016;8(4):205.
2Lima FD,Stamm DN,Dellapace ID,etal.Swimming training induces liver mitochondrial adaptations to oxidative stress in rats submitted to repeated exhaustive swimming bouts〔J〕.PLoS One,2013;8(2):e55668.
3Huang SC,Lee FT,Kuo TY,etal.Attenuation of long-term Rhodiola rosea supplementation on exhaustive swimming-evoked oxidative stress in the rat〔J〕.Chin J Physiol,2009;52(5):316-24.
4Huynh HT,Nkamga VD,Drancourt M,etal.Genetic variants of dental plaque Methanobrevibacter oralis〔J〕.Eur J Clin Microbiol Infect Dis,2015;34(6):1097-101.
5Wu J,Wang R,Ye Z,etal.Protective effects of methane-rich saline on diabetic retinopathy via anti-inflammation in a streptozotocin-induced diabetic rat model〔J〕.Biochem Biophys Res Commun,2015;466(2):155-61.
6Fan DF,Hu HJ,Sun Q,etal.Neuroprotective effects of exogenous methane in a rat model of acute carbon monoxide poisoning〔J〕.Brain Res,2015;1633(1):62-72.
7Boros M,Ghyczy M,Érces D,etal.The anti-inflammatory effects of methane〔J〕.Crit Care Med,2012;40(4):1269-78.
8Xin L,Sun X,Lou S.Effects of methane-rich saline on the capability of one-time exhaustive exercise in male sd rats〔J〕.PLoS One,2016;11(3):e0150925.
9Huang KC,Chiu YH,Liao KW,etal.Prophylactic acetylsalicylic acid attenuates the inflammatory response but fails to protect exercise-induced liver damage in exercised rats〔J〕.Eur J Pharmacol,2016;786:204-211.
10Huang WC,Lin C,Chiu CC,etal.Chicken essence improves exercise performance and ameliorates physical fatigue〔J〕.Nutrients,2014;6(7):2681-96.
11Suh SH,Paik IY,Jacobs K.Regulation of blood glucose homeostasis during prolonged exercise〔J〕.Mol Cells,2007;23(3):272-9.
12Cairns SP.Lactic acid and exercise performance〔J〕.Sports Med,2006;36(4):279-91.
13Brancaccio P,Maffulli N,Limongelli FM.Creatine kinase monitoring in sport medicine〔J〕.Br Med Bull,2007;81-82(1):209-30.
14Chang Q,Miao X,Ju X,etal.Effects of pulse current on endurance exercise and its anti-fatigue properties in the hepatic tissue of trained rats〔J〕.PLoS One,2013;8(10):e75093.
