犬细小病毒VP2基因乳酸菌表达载体的构建及蛋白检测
2018-02-18段欣强张洪亮周保琨杨瑞梅
段欣强,张洪亮,周保琨,杨瑞梅,单 虎
(1.青岛农业大学动物医学院 山东省预防兽医学重点实验室,山东 青岛 266109;2.山东省即墨区畜牧兽医局,山东 青岛 266200)
犬细小病毒病(CPD),是由犬细小病毒(CPV)感染犬的一种致死性、急性、高传染性疾病。CPV是细小病毒科,细小病毒属成员,该属成员有水貂肠炎病毒(Mink enteritis virus,MEV)等,相似性达到90%[1]。CPV形态呈六角形或圆形,呈等轴对称的二十面体结构,衣壳蛋白无囊膜。CPV为单股、负链、线性DNA病毒,基因组全长5.3 kb,VP2基因占90%,而VP1基因仅为10%。VP2是其衣壳蛋白的主要成分,基因全长1 755 bp,编码584个氨基酸。VP2是CPV的免疫原性蛋白,CPV的主要抗原决定簇,可诱导产生中和抗体,是制备CPV基因工程疫苗的关键保护性抗原[2]。
乳酸球菌是乳酸菌的典型代表,现已研究获得完整基因组序列[3],产出的外源目的蛋白可直接使用,使其与动物机体相互作用。乳酸球菌成为活载体疫苗意向菌株有突出优势[4]:(1)乳酸球菌为食品级菌种,无强抗原性,有别其他活疫苗载体菌,如:大肠杆菌、痘病毒和沙门菌等;(2)该菌种自身分泌蛋白较少,已知其分泌出的Usp 45是唯一可检测蛋白,减轻了菌种对外源重组蛋白的干预;(3)乳酸球菌不产任何蛋白酶到胞外,使外源重组蛋白不发生胞外降解。
活载体疫苗是以基因工程技术编码靶抗原或具有特殊生理功能的蛋白的DNA片段重组入病毒的共生菌或病原菌中,连接载体能够高效表达,后用载体疫苗免疫动物机体,有效激发动物机体的免疫应答,以防治动物病毒病为宗旨。鉴于此,对CPV VP2基因组进行分析研究,构建重组乳酸菌表达载体,通过乳酸菌表达系统表达VP2蛋白,为后续检测及构建CPV病毒样粒子口服疫苗提供理论依据。
1 材料与方法
1.1 毒株、细胞来源 CPV-2a株、乳酸球菌MG1363、表达载体 pMG36e均为本实验室收存;E.coli JM109感受态细胞,购自TaKaRa公司;犬细小病毒阳性血清,购自杭州格朗瑞生物科技有限公司。
1.2 主要试剂与仪器 DNAiso Reagent、dNTP、EX Taq、pMD TM19-T Vector Cloning Kit、T4 DNA Ligase、Quick Cut XbaⅠ、Quick Cut Hind Ⅲ、DL-5 000 DNA Marker,均购自TaKaRa公司;琼脂糖凝胶回收纯化试剂盒,购自OMEGA(美国);高纯度质粒提取试剂盒,购自TIANGEN生化科技;30%丙烯酰胺、4X蛋白上样缓冲液(含DTT)、兔抗狗IgG-HRP单抗,购自索莱宝科技有限公司;预染蛋白Marker(10-180 kD),购自赛默飞世尔科技(中国)有限公司;His-tag Protein Purification Kit,购自碧云天生物技术研究所;ProFlexTMPCR仪、紫外凝胶成像系统、SDSPAGE电泳仪、Western Blot膜转仪(Bio-RAD)、MicroPulserTMElectroporator电转仪。
1.3 引物的设计与合成 根据CPV-2a毒株VP2基因序列(GenBank登录号:JQ743906.1),使用Primer 5.0软件设计1对特异性引物。上游引物:5′-TGCTCTAGA ATGAGTGATGGAGCAGTTC-3′(下划线为XbaⅠ酶切位点);下游引物:5′-CCCAAGCT TATGGTGATGGTGATGATG ATATAATTTT CTAGGTGCTAGT-3′(单下划线为HindⅢ酶切位点,双下划线为6×His标签),预计扩增片段大小为1 755 bp。引物经上海生工生物工程技术服务有限公司合成,以ddH2O稀释到工作浓度,-20℃收存待用。
1.4 病毒DNA的制备 参考TaKaRa公司的DNAiso Reagent试剂说明书提取步骤对CPV-2a细胞病毒液进行DNA提取。制备成PCR扩增模板,装于1.5 mL离心管,-20℃收存备用。
1.5 目的基因片段的PCR扩增 以所提CPV-2a株DNA为模板,PCR扩增目的基因片段,PCR扩增体系 (25 μL):ddH2O 17 μL,10 × Ex Taq Buffer(Mg2+)2.5 μL,dNTP Mix ture 2 μL,上、下游引物(100 μmol/mL)各 0.5 μL,模板 DNA 2 μL,Ex Taq Polymerase 0.5 μL。 PCR 反应条件:94 ℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min 30 s,共30个循环;72℃终延伸10 min,最后PCR产物4℃收存。
取25 μL PCR扩增产物,同时设定阳性、阴性对照,经1%琼脂糖凝胶电泳,在紫外凝胶成像系统上成像并拍照。以胶回收试剂盒回收和纯化PCR产物凝胶。
1.6 CPV-VP2基因的克隆与测序 纯化的PCR目的产物连接pMDTM19-T simple载体,转化至大肠杆菌DH5α感受态,通过细菌培养、提取质粒进行PCR凝胶电泳鉴定,选出阳性质粒送上海生工生物工程技术服务有限公司测序。根据NCBI网站Blast程序对测序结果进行分析,鉴定TA克隆所得的CPV-VP2序列的基因型;与GenBank中登录的10株国内外CPV-2a分离株VP2基因进行比对,比对结果正确。
1.7 重组表达质粒的构建与鉴定 选取1个带CPV-2a序列的质粒,利用基因片段两端的酶切位点对阳性质粒双酶切,回收纯化后和同样酶切处理的乳酸菌表达载体pMG36e 16℃连接过夜,连接产物转化至大肠杆菌JM109感受态细胞,涂于红霉素抗性为(0.3 mg/mL)的LB固体培养基,37℃温箱培养过夜,挑取单菌落,接种于红霉素抗性(0.2 mg/mL)的LB液体培养基中,37℃,190 r/min震荡培养14 h,提取质粒,并通过菌液PCR及双酶切进行初步鉴定,取阳性质粒送上海生工生物工程技术服务有限公司测序,利用上述序列比对方法鉴定重组质粒,比对结果正确。
1.8 VP2蛋白的表达及SDS-PAGE、Western Blot-ting鉴定 构建的阳性质粒pMG36e-VP2经电转仪转化至乳酸菌MG1363感受态细胞并划线于带红霉素抗性的MRS平板,挑选单菌落,接种于含红霉素抗性的GM17液体培养基,30℃烛缸中静置孵育36 h,待浑后1∶100接种于10 mL MRS培养基,培养12 h至OD600值约为0.8,取10 mL该重组菌5 000 r/min离心5 min,用1 mL冰冷TES悬浮细胞,12 000 rpm/min(4℃)离心,弃上清。重复上述步骤,用140 μL含1 mg/mL溶菌酶的 TES重悬,37℃水浴30 min。加入60 μL 20%SDS混匀裂解菌体,加入60 μL 4X蛋白上样缓冲液(含DTT),吹打混匀后沸水浴10 min。然后将其放置冰盒冷却,取15 μL作为上样量,剩余放-20℃保存。
在类比推理中,始源S和目标T是两个具有特定结构的概念体系。用概念网络,可以将两个系统细致地描述出来。这个过程也是知识表达的过程。
30℃培养菌液,当菌液孵育OD600值=0.6~0.8时,加入NISIN诱导,参照现有文献[5],对重组菌株做3个浓度筛选,分别为:20 ng/mL、10 ng/mL、5 ng/mL,分别加入10 mL菌液中,30℃下静置培养8 h,此时测得菌液浓度分别为:2.35×107CFU/mL、1.97×107CFU/mL、1.44×107CFU/mL。 取3个浓度菌液10 mL按上述步骤做蛋白样品处理。
配制12%分离胶和5%浓缩胶,拼装电泳槽并放入电泳仪,上样后电压调至80 V 30min,后调至120 V 1 h,待电泳完成后凝胶经考马斯亮蓝染色液染色3~5 h。待染色反应完成后,加入脱色液进行脱色,观察结果。
通过Western Blot膜转仪将目的蛋白转至聚偏二氟乙烯膜(0.45 μm),清洗后放入封闭液中封闭。清洗后,加以CPV阳性血清作一抗进行孵育,清洗后,加兔抗狗IgG-HRP作二抗孵育,用增强型DAB显色液对膜显色。
2 结果
2.1 PCR扩增VP2目的基因 以CPV-2a细胞毒株全基因获取的VP2基因的PCR产物经1.0%琼脂糖凝胶电泳检测,结果表明,在1 755 bp左右处出现1条特异性条带,与预期目的片段大小一致(见图1)。
2.2 重组质粒pMG36e-VP2的鉴定及其酶切鉴定从大肠杆菌转化摇菌培养的菌液中提取pMG36e-VP2质粒,做琼脂糖凝胶电泳结果符合预期重组基因条带大小。经双酶切,可获得两条特异性条带,其中一条为目的基因片段,另一条为pMG36e载体片段,与预期结果一致,重组质粒送上海生工生物工程技术服务有限公司测序,分析测序结果正确。

图1 CPV-2a细胞毒株VP2全基因PCR扩增结果
将上述提取的重组质粒pMG36e-VP2-MG1363经Quick Cut XbaⅠ和Quick Cut HindⅢ双酶切,可获得两条特异性条带,其中一条长约1 755 bp的目的基因片段,另一条长约3 600 bp(pMG36e载体DNA片段),与预期结果一致(见图2)。
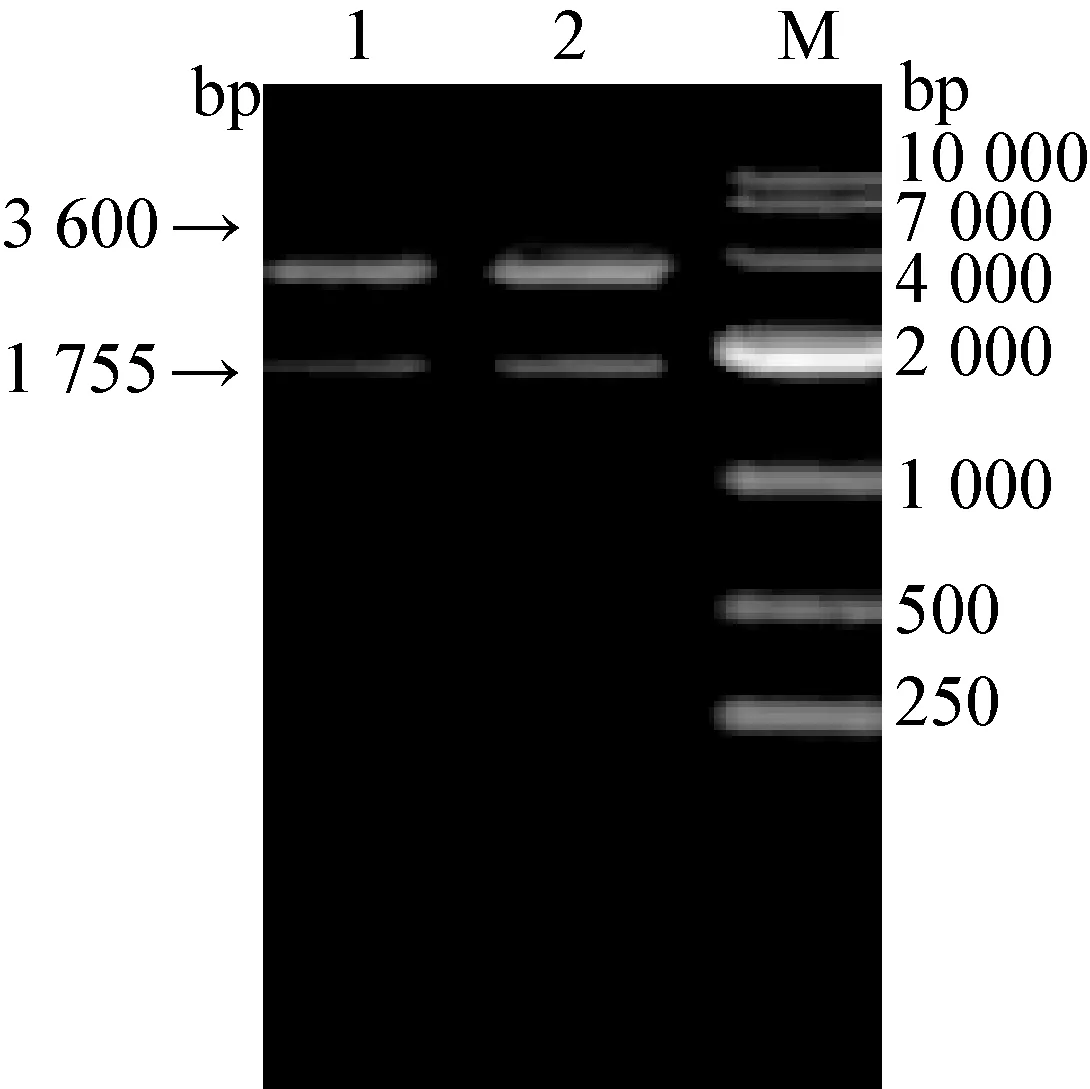
图2 重组质料pMG36e-M1-MG1363双酶切鉴定电泳图
2.4 SDS-PAGE电泳鉴定目的蛋白表达 将pMG36e-VP2-MG1363重组乳酸球菌液孵育至OD600值=0.6~0.8,加入诱导剂Nisin诱导,诱导完成后做上样处理,经SDS-PAGE电泳在65 kD左右出现一特异性蛋白条带,与预期蛋白大小基本一致,而空载体转化菌在其位置未出现特异条带(见图3)。下一步进行Western Blotting检测。
2.5 重组蛋白的Western Blot鉴定 结果显示,通过Nisin诱导后,在65 kD左右处出现明显特异性条带(见图4),表明该重组目的蛋白获得高效表达并与CPV阳性血清作的一抗进行特异性结合,具有良好免疫反应性。
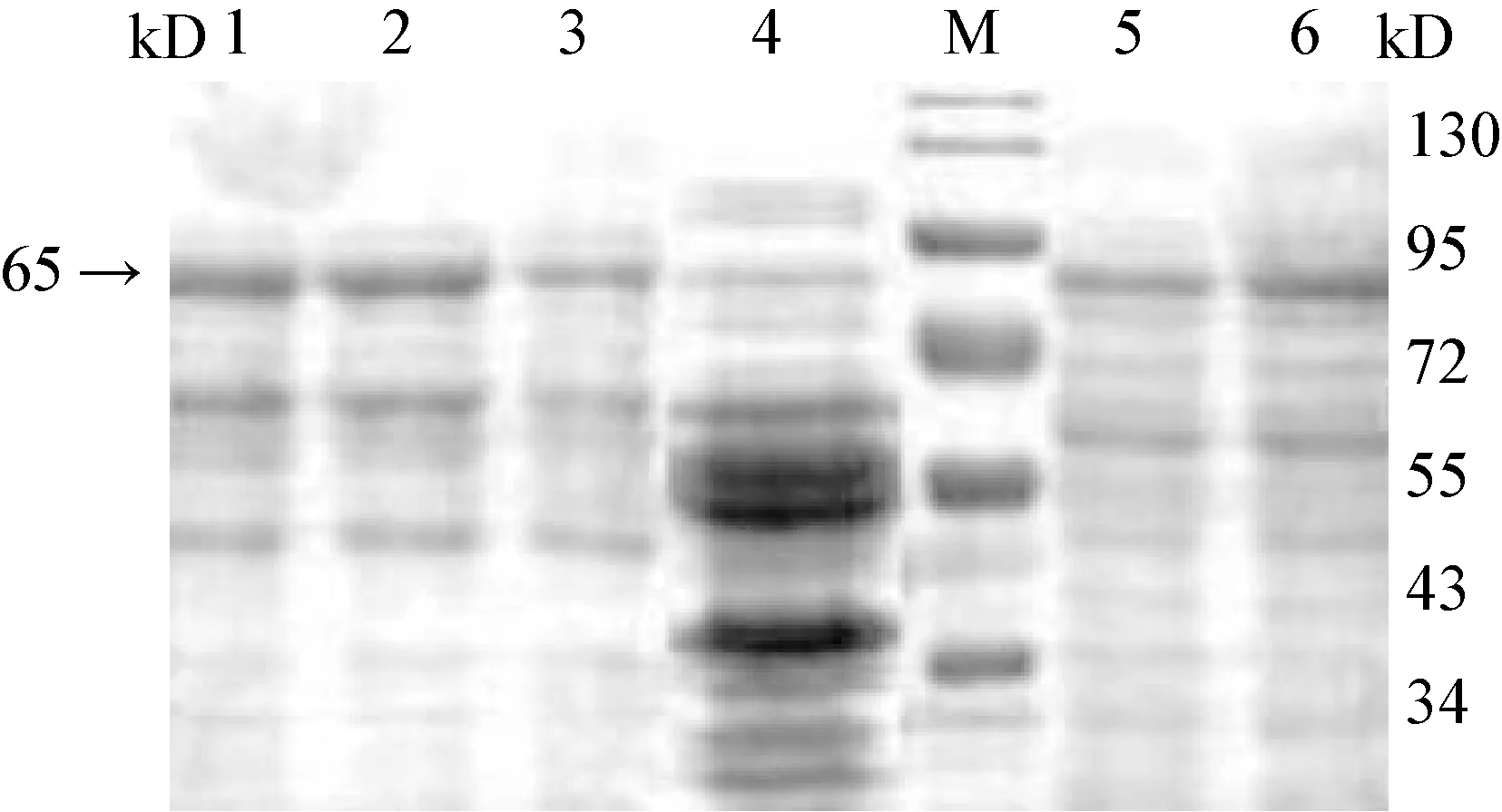
图3 pMG36e-VP2-MG1363重组蛋白的SDS-PAGE电泳鉴定

图4 重组蛋白的Western Blot鉴定
3 讨论
CPD具有发病急、病程短、传染性强、发病率和死亡率高的特点,且根据我国及地区性宠物传染病的流行病学形势来看,家庭宠物和毛皮动物养殖方面受犬细小病毒危害较大。目前犬细小病毒病的预防以注射疫苗为主,主要使用CPV弱毒苗及灭活疫苗,具有较好效果,但仍需注射,口服疫苗则简单易操作,且应用益生乳酸菌为载体可改善肠道环境。本研究进行了前期试验:以PCR扩增CPV VP2全基因,连接乳酸菌表达载体pMG36e进行重组,构建了pMG36e-VP2重组表达载体,电转化进乳酸乳球菌MG1363,经SDS-PAGE和Western Blotting鉴定目的蛋白成功表达。我们设计表达的重组蛋白在N端带有6XHis标签,标签分子量小,基本不改变蛋白生物结构和蛋白溶解性,便于纯化目的蛋白。重组目的蛋白经His标签蛋白纯化试剂盒纯化,SDSPAGE和Western Blotting结果均获得专一条带,获得蛋白纯度高,蛋白量大,避免了杂带影响,为体外自动组装CPV病毒样粒子提供科学支撑。
重组目的蛋白表达量不高时,引入诱导剂乳酸链球菌素。乳酸链球菌素(亦称乳链菌肽),简称Nisin,对食品腐败菌和致病菌包含的许多革兰阳性菌有强效的抑制作用。Nisin组成的NICE表达系统可根据需要把握外源蛋白的表达量,且诱导效率可为1 000倍以上[6]。因为载体pMG36e存在nisI基因,所以Nisin能够诱导pMG36e-VP2的蛋白表达。经SDS-PAGE电泳结果鉴定重组蛋白表达量大,根据Nisin梯度筛选的蛋白浓度分别表示为:0.224 mg/mL、0.212 mg/mL、0.133 mg/mL,且表达正确在约 65 kD处存在目的蛋白。进一步作Western Blotting检测,结果表明,目的蛋白能与CPV阳性血清产生特异反应,说明该重组蛋白具有良好免疫反应性。
CPV VP2蛋白外源重组表达一般有以下方式:真核表达系统主要是杆状病毒/昆虫表达系统、酵母表达系统等;原核表达系统主要是大肠杆菌表达系统、乳酸菌表达系统等。近年来,不少学者与研究人员已通过不同表达系统成功表达CPV VP2目的蛋白。Hongli Jin等人[7]研究出CPV VP2在杆状病毒表达系统中的高效表达的研究。贺英等人[8]研究出CPV结构蛋白VP2基因在毕赤酵母中的克隆和表达。王园园[9]研究CPV VP2基因连接表达载体pET-32a,于E.coli BL21菌诱导表达及鉴定。上述CPV结构蛋白VP2基因不同表达方式与本研究相比,目的蛋白多以包涵体形式表达,蛋白分子量多比天然VP2蛋白要大,且动物试验测定重组蛋白VP2生物学特征时,必进行注射处理,操作复杂、有误差。本研究使用乳酸菌表达系统,载体pMG36e本身不表达,表达的重组目的蛋白的分子组成、理化性质和生物学作用等因素与天然CPV病毒VP2蛋白更接近,乳酸菌安全、无内毒素,重组目的蛋白可直接同菌体一起灌服,避免试验操作误差。乳酸菌携带的重组蛋白不具包涵体,破菌后即可到胞外,乳酸菌本身分泌蛋白很少,试验操作便捷。
