顶复门原虫酰基CoA结合蛋白中的生物信息学分析及功能预测
2018-02-18周冰心
周冰心,傅 勇,刘 群,刘 晶
(中国农业大学动物医学院 国家动物寄生原虫实验室农业部动物流行病学重点实验室,北京 海淀 100193)
顶复门原虫是一类专性细胞内寄生原虫,包括弓形虫(Toxoplasma gondii)、隐孢子虫(Cryptosporidium spp.)、疟原虫(Plasmodium spp.)等,是人和动物的重要病原。这些顶复门原虫不仅能利用宿主细胞的脂肪酸,同时自身也存在脂肪酸代谢1]。尽管顶复门原虫的脂肪酸代谢途径在不同种属之间存在很大差异[2],如恶性疟原虫存在Ⅱ型脂肪酸代谢途径,隐孢子虫存在Ⅰ型脂肪酸合成途径,弓形虫同时存在两种途径[3],但游离的脂肪酸只有被CoA或酰基载体蛋白硫脂化形成脂酰CoA之后才能够参与细胞内的各种代谢途径。
脂酰CoA需要载体蛋白协助才能转运到各靶位点发挥作用。生物体内的脂肪酸载体蛋白主要有3种,分别为脂肪酸转运蛋白(Fatty acid transport proteins,FATPs)、脂肪酸结合蛋白(Fatty acid binding proteins,FABPs)和酰基CoA结合蛋白(Acyl coenzyme A-binding proteins,ACBPs)。其中ACBPs是一类保守性极强的家族蛋白,又称为安定结合抑制剂或地西泮结合抑制剂,广泛存在于真核生物中[4]。目前关于ACBP在植物、哺乳动物中的结构与功能研究相对深入,但对真核生物中顶复门原虫的ACBP研究鲜有文献报道,本研究以隐孢子虫已公布的ACBP为模板[5-6],从NCBI数据库中搜索到一些具有代表性的顶复门原虫的ACBPs氨基酸序列,包括隐孢子虫、新孢子虫、弓形虫、疟原虫、巴贝斯虫、艾美耳球虫,并利用 ToxoDB、CryptoDB、PlasmoDB等专属数据库对预测的部分虫种ACBPs进行核实。利用生物信息学软件对这些蛋白的氨基酸序列进行比对分析,对其理化性质、进化情况、蛋白结构和功能进行预测,归纳其异同点,为顶复门原虫脂肪酸代谢研究提供理论依据。
1 材料与方法
1.1 顶复门原虫ACBPs序列来源及比对数据库NCBI 数 据 库 (https://www.ncbi.nlm.nih.gov/);ToxoDB 数据库(http://toxodb.org/toxo/);CryptoDB 数据库(http://cryptodb.org/cryptodb/);PlasmoDB 数据库(http://plasmodb.org/plasmo/)。
1.2 理化性质分析 运用在线工具ExPASy-ProtParam(https://web.expasy.org/protparam/)分析顶复门原虫ACBPs的相对分子量、氨基酸组成、等电点、亲水性等理化性质。
1.3 系统进化分析 应用DNAMAN(V6)软件对顶复门原虫ACBPs氨基酸残基进行比对分析并构建系统发育树。
1.4 保守性结构域分析 运用在线工具SMART(http://smart.embl-heidelberg.de/)分析顶复门原虫ACBPs蛋白的保守性结构域,并使用IBS 1.0软件绘制顶复门原虫ACBPs的保守性结构域图。
1.5 二级和三级结构预测 运用在线软件Predict-Protein(https://www.predictprotein.org)对顶复门原虫ACBPs的二级结构进行预测;运用在线软件SWISS-MODEL(https://www.swissmodel.expasy.org)将顶复门原虫ACBPs同源建模进而预测三级结构,同时使用在线工具 RAMPAGE(http://mordred.bioc.cam.ac.uk/~rapper/rampage.php)对预测到的三级结构进行验证。
1.6 亚细胞定位和功能预测 运用在线工具MultiLoc2(http://abi.inf.uni-tuebingen.de/Services/MultiLoc2)以及 TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)对顶复门原虫ACBPs的亚细胞定位进行预测。
2 结果与分析
2.1 顶复门原虫ACBPs理化性质分析 通过比对隐孢子虫的ACBP序列发现,隐孢子虫与新孢子虫均只有一个ACBP,弓形虫、巴贝斯虫、艾美耳球虫各有2个ACBP,疟原虫有4个ACBP(表1)。ACBPs按照蛋白质分子量大小可分为两大类:Ⅰ型分子量较小,约为10 kDa左右,如NcACBP1,PfACBP1,TgACBP1,EtACBP1等;Ⅱ型ACBPs分子量较大,约为30 kDa左右,如TgACBP2,BbACBP2等。
蛋白质的亲水性与其氨基酸的极性有关,等电点主要取决于其氨基酸所带的电荷性质,同时也与该蛋白的大小及其亚细胞定位相关[7]。对顶复门原虫ACBPs氨基酸序列的亲水性和等电点分析发现,其绝大多数氨基酸为疏水性,故所有ACBPs的亲水性质均为负值,且亲水性大小依次为 Ⅰ型<Ⅱ型。顶复门原虫 ACBPs的等电点相差较大,CpACBP带负电荷的氨基酸(Asp+Glu,14.9%)大于带正电荷的氨基酸(Lys+Arg,11.2%),其等电点最低;而PfACBP4(Asp+Glu,11.30%)小于(Lys+Arg,14.00%),其等电点最高。
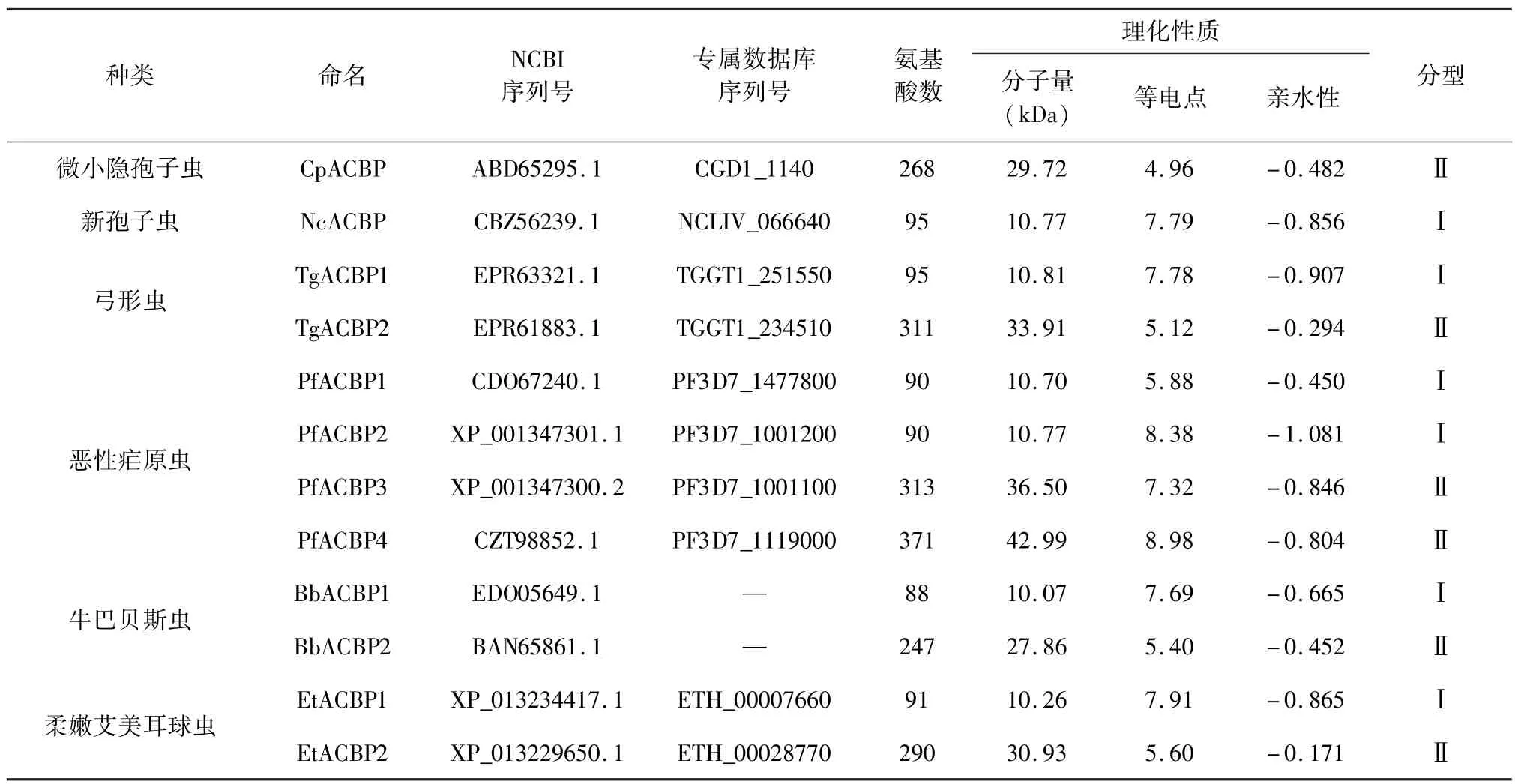
表1 几种顶复门原虫酰基辅酶A结合蛋白(ACBP)的理化参数
2.2 顶复门原虫ACBPs的系统进化分析 同源性是指在进化过程中源于同一祖先的分支之间的关系,对氨基酸序列的同源性进行分析有助于推测各物种间的亲缘关系。对顶复门原虫ACBPs氨基酸残基比对发现,该蛋白在进化过程中保守性非常强,见封二彩版图1中所示粉色标注部分的几种氨基酸残基如 Tyr(Y)、Lys(K)、Cys(C)、Gly(G)、Val(V)、Ala(A)的相似性高达75%,均是构成ACBD所需的保守性氨基酸残基。而且大部分氨基酸残基的相似性可达33%。这些相似性极强的氨基酸残基可能在ACBPs的结构与稳定性、有效折叠以及与其配体结合或其他功能中起到重要作用。
系统发育树可以描述不同生物之间的相关关系,并揭示生物的进化历史过程。NcACBP与TgACBP1以及TgACBP2与CpACBP在系统发育树中均相距很近(图2),说明两者在物种进化过程中亲缘性非常高;此外,进化树分支的长短体现出此类蛋白质在进化过程中出现的先后顺序,由此推断出EtACBP1是在顶复门原虫进化过程中最早出现,而PfACBP4则出现的最晚。虽然系统发育树并不能揭示各顶复门原虫ACBPs之间的联系,但能够说明这些蛋白参与了顶复门原虫的进化过程[4]。
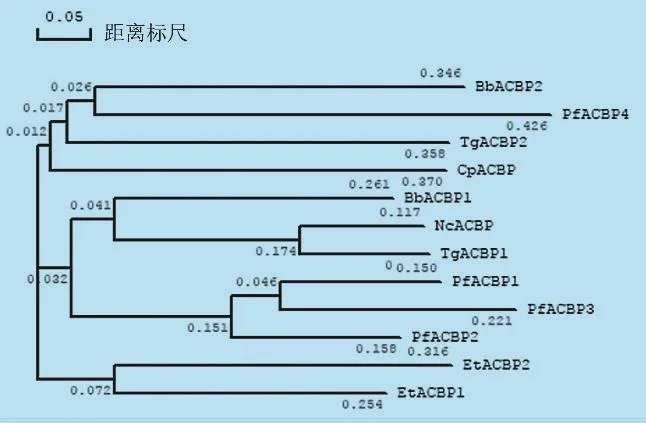
图2 顶复门原虫ACBPs的氨基酸系统发育树
2.3 顶复门原虫ACBPs的保守性结构域 结构域是生物大分子中具有特异结构和独立功能的区域,是蛋白质生理功能的结构基础。保守性结构域是指在生物进化或者一个蛋白家族中具有不变或相同的结构域,对蛋白质的保守性结构域的研究有助于揭示其在生物进化过程中的重要功能。对顶复门原虫ACBPs的保守性结构域分析发现,不同虫体的ACBPs都至少含有1个ACBD,但在不同物种中该结构所处的位置有所差异(图3)。蛋白质分子量越大,其结构与功能也越复杂。Ⅰ型ACBPs仅含有1个ACBD,且位于3~89位氨基酸残基处,说明其蛋白功能比较单一且特异;Ⅱ型ACBPs除了2个ACBD之外还包含2个ANK,位于其N-末端的第168~356位氨基酸残基处,其中EtACBP2还含有1个跨膜结构域(Transmembrane region,TMR),位于其10~32位氨基酸残基处;PfACBP4有2个ANK(294-323、327-356)和 4 个 ACBD(63-71、118-155、158-183、253-260),故其分子量较大,可能影响其对酰基CoA的结合亲和力和转运能力。
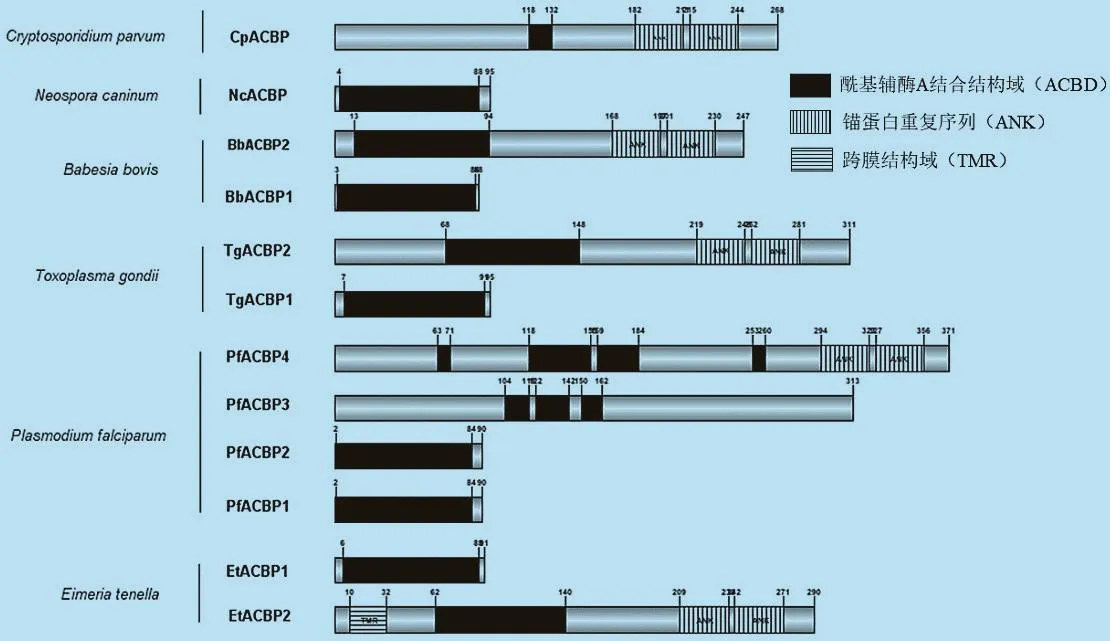
图3 顶复门原虫ACBPs的保守性结构域分析
2.4 顶复门原虫ACBPs的二级和三级结构预测蛋白质二级结构是指多肽链借助氢键沿一维方向排列成具有周期性的结构构象,是多肽链局部的空间结构,主要构成有α螺旋、β折叠、β转角、无规则卷曲等几种形式。顶复门原虫ACBPs的二级结构相对简单,主要为α-螺旋(alpha-helix)和无规则卷曲(random coil)或称为环(loop)。由于EtACBP2的保守性结构域中不仅仅由1个ACBD组成,还分别含有1个TMR及2个ANK,BbACBP2也含有2个ANK结构,所以两者在二级结构上还包含有小部分延长链(extend strand)。除此之外,顶复门原虫中其他ACBPs的二级结构均由简单的α-螺旋和无规则卷曲组成。其中CpACBP的HELIX与LOOP各占一半(50%)。而且即使是同种寄生虫的ACBP,其二级结构也存在差异,一般而言分子量大的ACBP中LOOP的含量要高于HELIX;分子量较小的 ACBP中 LOOP的含量则低于 HELIX。如TgACBP1(95 kDa)中HELIX约占60%,而TgACBP2(311 kDa)中HELIX仅占45%左右。
从蛋白质结构分析,蛋白质分子的疏水内核保守性比亲水表面高,疏水结构核心大部分由规则的二级结构单元,即α螺旋和β折叠构成,其埋藏表面积较大。而蛋白质结构的亲水表面则很少出现有规则的二级结构,常见的是转角和无规则卷曲,这部分结构的埋藏表面积较小。因此,从其二级结构的构成便可以解释,为何这几种顶复门原虫ACBPs的亲水性均为负值。
蛋白质的三级结构是指球状蛋白质的多肽链在二级结构的基础上相互配置而形成特定的构象。根据预测结果,选定与模型蛋白比对覆盖率最高(≥98%)的模型,可以发现ACBPs的三级结构较为简单:4个α螺旋束蛋白上下排列形成疏水性结合口袋,其间由残基环与之相连(见封二彩版图4)。ACBPs的配体结合位点理论上由三部分组成:一部分以盐桥或氢键的方式与酰基CoA的3′-磷酸集团结合并提供全部结合过程中40%的能耗,一部分以非极性分子作用力与腺嘌呤环相结合并保证其在极性溶剂中的稳定性,另一部分结合配体的酰基链以发挥转运功能[8]。虽然蛋白质稳定性的微小变化仅导致其结合亲和力和能量有所损失,但其结合能一旦发生微小改变,蛋白质的稳定性将产生巨大变化。不同物种ACBPs的α螺旋处氨基酸残基有所不同,使得形成的结合口袋的大小、以及针对不同配体的结合亲和力存在差异,以适应不同物种对不同脂肪酸的需求量差异,同时也说明蛋白质结构上存在的微小差异,可能导致其主要的生物功能发生很大变化。ACBPs为疏水性蛋白质,二级结构相对简单,主要为α螺旋和无规则卷曲;其疏水性结合口袋末端氨基酸残基的差异使其能够与不同的配体特异性结合;其中,与酰基CoA特异性结合的ACBD是其结构中最重要的一部分,对三级结构的分析将有助于阐明ACBP与其他分子相互作用的空间结构基础。
2.5 顶复门原虫ACBPs的亚细胞定位和功能预测 蛋白质在核糖体合成后经蛋白质分选信号引导后被转运到特定的细胞器中,部分蛋白质则被分泌到细胞外或留在细胞质中,只有转运到正确的部位才能参与细胞的各种生命活动,如果定位发生偏差,将会对细胞功能产生重大影响。此外,蛋白质在细胞内常在不同的亚细胞环境中运动而发挥作用,而非静止不动的;而且成熟的蛋白质必须在特定的细胞部位才能发挥其生物学功能。顶复门原虫ACBPs的亚细胞定位预测结果发现,TgACBP2、EtACBP2、PfACBP3均属于分泌蛋白,其他蛋白均定位于细胞质中。
蛋白质的结构可以决定其功能以及发挥此功能的亚细胞定位。ACBD是ACBPs中最为核心的结构域,而且ACBPs也是由于该结构域能够以高特异性和亲和性结合酰基CoA而命名的[4],所有的ACBPs都是由同一个祖先演化而来的,只是在该过程的基因复制和重排中产生了差异,所以才进化出了不同型的ACBPs[9]。ACBPs在细胞内的定位取决于其与何种配体相结合[15],故对其亚细胞定位的预测发现,ACBPs大部分定位于细胞质中,少部分属于分泌蛋白,这与其在生物体内结合并转运酰基CoA的功能有关。同时,EtACBP2上的跨膜结构域(TMR)可与信号肽重叠,既可将其自身锚定于细胞内膜系统又可将其输送至胞外环境中[10],故EtACBP2被预测为分泌蛋白的一种。另外,BbACBP2、TgACBP2与PfACBP4中的ANK可参与转录起始、离子转运、细胞信号传导和细胞周期调节以及细胞骨架完整性等多种基本生物学功能,并将不同结构的蛋白质运送至内质网或质膜等特定的区域[11],故BbACBP2、TgACBP2与PfACBP4等均定位于细胞质中。
3 讨论
ACBPs能够高特异性、高亲和力地结合不同长度的长链脂酰CoA(C14~C22);对短链和游离脂酰CoA的结合亲和力低;不结合游离脂肪酸、棕榈酰肉毒碱和类固醇等,在生物体内作为酰基CoA库的前体并参与其转运,发挥多种重要功能[9,12]。另外,ACBPs可以将质体中合成的脂肪酸转运至内质网中,参与脂肪酸、甘油三酯等的生物合成与代谢活动[5]。酿酒酵母、恶性疟原虫以及人的ACBPs蛋白结构非常相似[10],且该蛋白在哺乳动物中的肝脏、心脏、骨骼肌等许多组织器官中也有较高的表达水平[11],提示ACBPs可能参与许多重要的基本生物功能,在生物进化过程中具有较高的保守性。本研究从生物信息学角度解析了几种代表性的顶复门原虫的ACBPs,也发现这类蛋白的保守性很强。早期研究认为,小分子量的ACBP是唯一能够以高亲和力结合酰基CoA的蛋白,但近年来的研究发现,植物和动物中存在分子量更大的ACBPs(50~80 kDa)[13-14],大分子量的ACBPs不仅仅局限于一个ACBD,有的还包含ANK以及TMR等结构,蛋白结构越复杂提示其功能越多样化。本实验室目前已经验证弓形虫中存在2个ACBPs,其中TgACBP1仅含有95个氨基酸残基(~10 kDa),TgACBP2含有311个氨基酸残基(~34 kDa),虽然两者分子量大小存在差异但均具有结合并转运酰基CoA的功能。
新兴的基因编辑技术为研究ACBPs的功能提供了极大的便利。运用siRNA调控干扰ACBP基因在人肝癌细胞HepG2中的表达,可导致饱和(16∶0)及单不饱和(16∶1,18∶1)的脂肪酸在细胞内的含量显著减少,并严重影响脂肪酸的新陈代谢活动15]。酵母和小鼠ACBPs基因缺失后,也表现出长链脂肪酸和神经酰胺的合成受损,表明ACBPs可能特异性的影响长链脂酰辅酶A代谢酶的活动[14]。
顶质体是顶复门原虫特有的细胞器,参与顶复门原虫脂肪酸、血红素等的新陈代谢过程[16]。在顶质体内进行的各类新陈代谢过程中,脂肪酸是虫体重要的能量来源,其中ACBPs在脂肪酸代谢中起着关键性作用。顶复门原虫中的弓形虫和新孢子虫等胞内寄生原虫能感染多种动物,同时作为机会性致病原虫,不仅药物治疗效果不显著而且还容易产生耐药性,给人类健康和畜牧业生产带来巨大威胁。从生物信息学入手找到它们的ACBPs,分析这些ACBPs的进化关系、保守性结构域、蛋白结构特征和生物学功能不仅能够为研究顶复门原虫脂肪酸代谢提供背景资料,还有可能为研发治疗顶复门原虫病的药物提供理论依据。
