烷氧基菲咯啉设计合成及其氮磷杂配铜光敏剂的光解水制氢性能
2018-02-01吴庆安黄道臣夏良敏王肖璟娄文雅吴晓峰罗书平
吴庆安 陈 浩 黄道臣 夏良敏 王肖璟 娄文雅 吴晓峰 罗书平*,
(1绿色化学合成技术国家重点实验室培育基地,浙江工业大学,杭州 310014)
(2义乌科学技术研究院,浙江工业大学,义乌 322001)
0 引 言
能源和环境是人类社会面临的两个重大热点问题,随着不可再生资源的耗尽与枯竭,人类开始不断的寻找和开发可替代能源[1]。太阳能作为取之不尽用之不竭的清洁能源,是人们心目中最理想的绿色能源。光电转换是人们直接利用太阳能的一种主要方法,但由于电能无法有效存储,因此通过太阳能光解水的光化学转换方法将光转化为可储存的氢化学能受到广泛关注[2-4]。氢能作为一种理想的绿色能源[5],燃烧产物只有水,所以对环境没有任何污染。并且,全球氢元素储存丰富、氢能热效率高等优点也推动氢能作为绿色能源的发展。
光分解水是一个复杂的氧化还原反应过程,为了避免氧化过程和还原过程的相互干扰,往往把光解水氧化半反应(释放氧气)和还原半反应(释放氢气)分开进行研究。目前还原半反应系统由三组分构成,包括光敏剂,水还原催化剂和电子牺牲剂[6]。在三组分体系中,光敏剂的发展是制约体系效率的关键。现在比较高效的光敏剂都为贵金属配合物,如钌[7-9]、铑[10]、铂[11-13]、铱[14-16]等。从2012年起,我们着重研究了非贵金属的氮磷杂配铜配合物作为高效稳定的光敏剂的光解水制氢性能,并对这类光敏剂的构效关系和光敏机理进行了深入研究。其中的氮配体1,10-菲咯啉的结构对光敏剂的光敏活性有非常重要的影响,特别是菲咯啉的2,9位取代基,其空间位阻效应和电子效应都会影响杂配铜配合物的光稳定性,因此研究氮配体对杂配铜光敏剂的影响是一项重要的研究课题[17-21]。
本文为进一步研究菲咯啉2,9位取代基的影响,设计开发了一种新型1,10-菲咯啉配体,即2,9-二烷氧基菲咯啉衍生物。在探索合成路线的基础上,对2,9-二烷氧基-4,7-二苯基-1,10-菲咯啉在杂配铜光敏剂光解水制氢中的作用及其构效关系、光物理化学性能进行探讨。其光水解制氢催化机理如下图1。
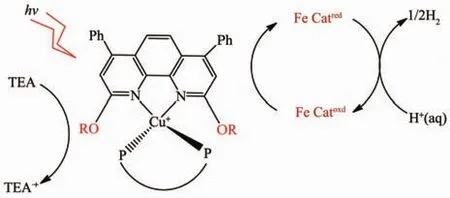
图1 铜光敏剂光解水制氢机理Fig.1 Mechanism of hydrogen evolution from water splitting by copper photosensitizers
1 实验部分
1.1 仪器与试剂
底物4,7-二苯基-1,10-菲咯啉按文献[22]制备,其余底物及试剂均购自商业公司,所有溶剂都经过重蒸除水;NMR分析使用瑞士Bruker公司的AdvanceⅢ核磁共振仪;紫外分析使用瓦里安公司的CARY100紫外-可见-近红外分光光度计;荧光分析使用SHIMADZU公司的RF-6000荧光分析仪;CV分析使用上海辰华的CHI电化学工作站;MS分析使用美国Thermo公司LCQ advantage质谱仪;HR-MS分析使用美国Agilent公司的Agilent 6210 TOF LC/MS。
1.2 合 成
1.2.1 2,9-二烷氧基-1,10-菲咯啉衍生物及其合成
2,9-二烷氧基-1,10-菲咯啉衍生物及其合成路线如图2所示。

图2 2,9-二烷氧基-1,10-菲咯啉衍生物及其合成路线Fig.2 Synthesis route of 2,9-dialkoxy-1,10-phenanthroline derivatives
1.2.2 季铵盐中间体2和内酰胺中间体3的合成及方法
季铵盐中间体2[23]和内酰胺中间体3[24]按参考文献合成。
1.2.3 不同烷氧取代基的1,10菲咯啉配体的合成及方法
1.2.3.1 2,9-二氯-4,7-二苯基-1,10-菲咯啉(4a)的合成
在氩气保护下,向三口烧瓶中依次加入60 mL氯化亚砜、内酰胺中间体(3)4.0 g(0.01 mol)和三氯化磷4.0 g(0.03 mol),升温至回流。 随着反应的进行,溶液逐渐由黄色变为棕褐色,10 h后,取样,TLC检测。原料反应完全后,冷却至室温。将反应液倒入放有0.5 kg碎冰中,剧烈搅拌,有大量的氯化氢气体放出,然后再用50%的氢氧化钠水溶液调至pH值约为8,有固体析出。过滤,得到的褐色固体为粗产物。滤液用二氯甲烷萃取2次,合并有机相,再分别用水和饱和食盐水洗2次,除去溶剂,得到褐色固体。粗产物通过硅胶过柱分离(V石油醚∶V乙酸乙酯=3∶1),再用甲醇重结晶,得到黄色固体 2.8 g(4a),收率 70%。
化合物4a:黄色固体,收率70%;1H NMR(500 MHz,CDCl3):δ 7.84(s,2H),7.62(s,2H),7.58~7.48(m,10H)。13C NMR (126 MHz,CDCl3):δ 151.59,151.51,145.66,136.52,129.52,129.13,128.85,125.99,124.82,124.01,77.29,77.03,76.78。 ESI-MS(m/z):[M+H]+401,[M+Na]+423。
1.2.3.2 2,9-二溴-4,7-二苯基-1,10-菲咯啉(4b)的合成
合成方法参照2,9-二氯-4,7-二苯基-1,10-菲咯啉(4a)
化合物4b:白色固体,收率73%;1H NMR(500 MHz,CDCl3):δ 7.80(s,2H),7.72(s,2H),7.54~7.42(m,10H)。13C NMR (126 MHz,CDCl3):δ 151.00,146.06,142.70,136.31,129.55,129.15,128.85,128.40,126.17,124.30,77.28,77.03,76.78。 ESI-MS(m/z):[M+H]+491,[M+Na]+513。
1.2.3.3 2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)的合成
在氩气保护下,向100 mL三口烧瓶中依次加入50 mL甲醇、2,9-二氯-4,7-二苯基-1,10-菲咯啉 4.0 g(0.01 mol)和甲醇钠 1.35 g(0.025 mol),搅拌升温至 70℃,8 h后,溶液变为棕褐色。TLC跟踪,待原料反应完全后,冷却至室温。将反应液倒入200 mL水中,析出大量黄色固体。抽滤,将滤饼溶解在二氯甲烷中,滤液用二氯甲烷萃取2次,合并有机相,再加入50 mL水,用10%的稀盐酸调节pH值至7。取有机相,用饱和食盐水洗 2 次,干燥,加硅胶过柱(V石油醚∶V乙酸乙酯=10∶1),之后再用丙酮重结晶,得到白色固体3.2g(5a),收率82%。
化合物5a:白色固体,收率82%;1H NMR(500 MHz,CDCl3):δ 7.62 (s,2H),7.56 ~7.43 (m,10H),7.06 (s,2H),4.35 (s,6H)。13C NMR (126 MHz,CDCl3):δ 162.25,151.56,143.93,138.18,129.51,128.49,128.37,123.67,121.15,113.38,77.29,77.03,76.78,53.34。 ESI-MS (m/z):[M+H]+393,[M+Na]+415。
1.2.3.4 2,9-二乙氧基-4,7-二苯基-1,10-菲咯啉(5b)的合成
合成方法参照2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)。
化合物5b:黄色固体,收率83%;1H NMR(500 MHz,CDCl3):δ 7.60 (s,2H),7.51(d,J=4.4 Hz,10H),7.04(s,2H),4.84(d,J=7.1 Hz,4H),1.59(t,J=7.1 Hz,6H)。13C NMR (126 MHz,CDCl3):δ 161.91,151.39,144.06,138.28,129.49,128.45,128.29,123.51,120.99,113.50,77.28,77.03,76.77,61.76,14.77。 ESI-MS(m/z):[M+H]+421,[M+Na]+443。
1.2.3.5 2,9-二烯丙氧基-4,7-二苯基-1,10-菲咯啉(5c)的合成
合成方法参照2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)
化合物 5c:淡黄色固体,收率 86%;1H NMR(500 MHz,CDCl3):δ 7.61 (s,2H),7.55 ~7.45 (m,10H),7.09 (s,2H),6.34 (dd,J=17.2,10.4 Hz,2H),5.71~5.33(m,4H),5.31(dt,J=5.8,1.3 Hz,4H)。13C NMR(126 MHz,CDCl3):δ 161.45,151.61,143.96,138.20,133.90,129.50,128.50,128.37,123.74,121.18,118.12,113.52,77.28,77.03,76.78,66.72。 ESI-MS(m/z):[M+H]+445,[M+Na]+467。
1.2.3.6 2,9-二丙氧基-4,7-二苯基-1,10-菲咯啉(5d)的合成
合成方法参照2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)
化合物5d:黄色固体,收率87%;1H NMR(500 MHz,CDCl3):δ 7.82 (s,2H),7.77 ~7.66 (m,10H),7.49 (s,2H),4.96(t,J=6.8 Hz,4H),2.23(dd,J=14.3,7.1 Hz,4H),1.37 (t,J=7.4 Hz,6H)。13C NMR (126 MHz,CDCl3):δ 162.10,151.44,138.31,129.52,128.47,128.31,123.52,121.00,113.53,77.29,77.03,76.78,67.67,22.47,10.65。ESI-MS(m/z):[M+H]+449,[M+Na]+471。
1.2.3.7 2,9-二丁氧基-4,7-二苯基-1,10-菲咯啉(5e)
的合成
合成方法参照2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)
化合物5e:白色固体,收率80%;1H NMR(500 MHz,CDCl3):δ 7.58(s,2H),7.49(dd,J=7.1,6.0 Hz,10H),7.03(s,2H),4.78(t,J=6.8 Hz,4H),1.95(dt,J=14.5,6.8 Hz,4H),1.74~1.50(m,4H),1.05(t,J=7.4 Hz,6H)。13C NMR(126 MHz,CDCl3):δ 162.10,151.37,144.05,138.32,129.52,128.45,128.29,123.52,120.97,113.53,77.29,77.04,76.78,65.82,31.27,19.48,14.00。 ESI-MS (m/z):[M+H]+477,[M+Na]+499。
1.2.3 铜配合物的原位合成
参考课题组之前的工作,采用原位配位的方法得到相应的铜配合物[25]。以配合物CuPS A为例:氩气保护下,将配体 2,9-二氯-4,7-二苯基-1,10-菲咯啉(1 mmol)、二膦配体 Xantphos(1 mmol)和六氟磷酸四乙腈铜(1 mmol)溶于 20 mL四氢呋喃中,室温下搅拌 0.5 h,既可得到相应的氮磷杂配铜配合物CuPS A(图3),可直接用于光催化反应。

图3 铜配合物的原位合成方法Fig.3 In situ synthetic method of copper complex
氮磷杂配铜基配合物CuPS B~H也采用相同的方法获得,并通过ESI-MS检测得到了确认。
CuPSA:ESI-MS(m/z):[M+H]+1072,[M+Na]+1094。CuPS B:ESI-MS(m/z):[M+H]+1 162,[M+Na]+1 184。
CuPSC:ESI-MS(m/z):[M+H]+1064,[M+Na]+1086。CuPS D:ESI-MS(m/z):[M+H]+1 092,[M+Na]+1 114。
CuPSE:ESI-MS(m/z):[M+H]+1116,[M+Na]+1138。CuPS F:ESI-MS(m/z):[M+H]+1 120,[M+Na]+1 142。
CuPSG:ESI-MS(m/z):[M+H]+1148,[M+Na]+1170。CuPS H:ESI-MS(m/z):[M+H]+1 004,[M+Na]+1 026。
1.3 光解水制氢测试
以氮配体2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉为例:在氩气保护下,将二膦配体Xantphos(3.5 μmol)、2,9-二 甲 氧 基-4,7-二 苯 基 -1,10-菲 咯 啉 (3.5 μmol)、六氟磷酸四乙腈合铜(3.5 μmol)和十二羰基三铁(5 μmol)加入反应瓶中,加入 10 mL(VTHF∶VTEA∶VH2O=4∶3∶1)溶剂(THF 为四氢呋喃,TEA 为三乙醇胺),用循环恒温水浴槽将反应系统的温度稳定在25℃,搅拌,反应液的颜色逐渐变成淡黄色。15 min后,打开氙灯光源照射反应瓶,并用U形管收集产生的氢气。待反应体系中不产生气体时,停止搅拌,关闭光源,记录产生的气体体积,并用气相色谱检测收集的气体。
1.4 光谱测试
取 4,7-二苯基-1,10-菲咯啉(5f)、2,9-二溴-4,7-二苯基-1,10-菲咯啉(4b)和 2,9-二乙氧基-4,7-二苯基-1,10-菲咯啉(5b)配体通过原位配位的铜基配合物(如图3)3.5 μmol,用四氢呋喃溶解后定容到50 mL容量瓶中,在室温下进行光化学测试。
1.5 循环伏安测试
配制0.1 mol·L-1四丁基六氟磷酸铵的四氢呋喃电解质溶液,加入3.5 μmol的铜基配合物,定容到100 mL容量瓶中,用三电极(工作电极、对电极和参比电极)进行测试。循环伏安实验条件:工作电极为玻碳电极(d=2 mm),对电极为铂电极,参比电极为Ag/AgNO3电极,室温,电解质是0.1 mol·L-1四丁基六氟磷酸铵的四氢呋喃溶液,扫描速度100 mV·s-1,阶跃电位2.5 mV,调制振幅25 mV,调制时间0.05 s,间隔时间0.5 s,最高电位1.8 V,最低电位-2.5 V。
2 结果与讨论
2.1 氮配体和氮磷杂配铜配合物的合成
首先以4,7-二苯基-1,10-菲咯啉为原料,对其2,9位进行了修饰,通过季铵化、氧化、卤化和醚化4步反应,合成了一系列相应的2,9-二烷氧基-4,7-二苯基-1,10-菲咯啉(5a~5e),总收率达 45%左右。
再以合成的2,9-二烷氧基-4,7-二苯基-1,10-菲咯啉(5a~5e)为氮配体,以 Xantphos 为膦配体,与[Cu(MeCN)4]PF6通过原位配位方法得到一系列新型的氮磷杂配铜配合物(CuPS A~H),并将其作为光敏剂用于光解水制氢中。原位配位方法简单方便,合成后不用分离直接使用,可通过ESI-MS实时检测。以CuPS D为例,通过ESI-MS检测结果ESI-MS:[M+H]+1 092,[M+Na]+1 114,可知得到的是单核氮磷杂配铜基配合物,与图3中一致。另外,ESI-MS检测结果也显示有极少量单核均配铜基配合物的存在,但其含量非常低,而且根据先前的研究结果表明均配铜基配合物基本没有光敏活性,因此极少量单核均配铜基配合物的存在不影响体系的制氢活性[26]。所以,图3所示通过原位获得的氮磷杂配铜配合物CuPS A~H可直接作为光敏剂用于光解水制氢中。
2.2 制氢数据
从表1可知:当菲咯啉配体的2,9位有取代基时,体系才有制氢活性。这和我们课题组之前的研究结果一致[25]。在8种通过原位配位生成的铜配合物CuPS A~H中,CuPS D光解水制氢活性最高,最大转化数TON可达270。从Entry 1和2对比可以发现,CuPS B的制氢活性高于CuPS A,因为Br的给电子能力大于Cl。当4,7-二苯基-1,10-菲咯啉的2,9位为烷氧基时,它的光敏活性大于2,9位为卤素时的光敏活性,因为烷氧基的给电子能力大于卤素原子。Entry 3和4相比,乙氧基铜基光敏剂的制氢活性大于甲氧基铜基光敏剂的制氢活性,因为乙氧基上甲基多,对称性好,电荷分布更均匀更加稳定,所以乙氧基的给电子能力大于甲氧基。随着2,9位取代基空间结构的增大,光敏活性有所下降(Entry 4和6对比)。2,9位基团的电子效应和空间效应影响制氢活性,而当4,7-二苯基-1,10-菲咯啉的2,9位连有较长链的烷氧基时,空间位阻的存在减弱了氮原子的配位能力[27],使得整个铜配合物的稳定性变弱,制氢活性也相应降低。
我们用合成的 2,9-二烷氧基-4,7-二苯基-1,10-菲咯啉配体和Xantphos通过原位配位与六氟磷酸四乙腈合铜生成的铜基光敏剂的制氢效果和本课题组之前合成的2,9-二烷基-4,7-二苯基-1,10-菲咯啉生成的铜基光敏剂[28]相比较时,发现 2,9位为烷氧基时的制氢效果并没有2,9位为烷基的好,可能的原因是烷氧基中的氧原子可以参与中心铜原子的配位,使以铜原子为中心的四面体配合物的结构遭到破坏,导致其稳定性变弱,在光照下,比较容易解离,所以烷氧基菲咯啉铜基光敏剂的制氢效果较差。
2.2.1 单一波长下光催化性能研究
在上述8种通过原位配位生成的铜配合物CuPS A~H中,CuPS D光解水制氢活性最佳,因此进一步以CuPS D为光敏剂,研究其单波长光的制氢效率。通过分别测试其在波长为380、400、450 nm时的产氢量,结果表明,在相同的实验条件下,CuPS D在3种不同波长下的产氢量为3、8.2和5.1 mL(如图4)。其中在波长为400、450 nm时的产氢量明显较380 nm时的多,说明光催化水还原反应可在可见光范围驱动。

表1 制氢数据Table 1 Data of hydrogen production

图4 配合物CuPS D在不同波长下的产氢量Fig.4 Hydrogen production of CuPS D under different wavelengths irradiation
2.3 紫外和荧光表征
从图5可知,所测的铜基配合物CuPS H、CuPS B和 CuPS D,在300~340 nm之间的紫外吸收归属于1,10-菲咯啉配体,而370~450 nm之间的紫外吸收是铜基配合物的特征吸收峰,即金属到配体的电子转移(MLCT)[29]。 荧光发射光谱中 550~600 nm 的特征峰是配合物分子内π*→π的回落。CuPS H由于2,9位没有位阻基团,几乎没有荧光吸收,很好地解释它没有制氢活性。CuPS D配合物相对于CuPS B配合物发生了轻微的红移,可能的原因是:CuPS D配合物中乙氧基是较强的给电子基团,而当给体的给电子能力强度增加时,分子的吸收带会发生红移;并且氧原子的孤对电子和双键的π电子能形成有效的p-π共轭[30],也会使分子发生红移。虽然CuPS D配合物在580 nm处荧光效率较低,但是由于乙氧基有助于提高其荧光淬灭效率,增强光化学转换能力,故其制氢活性较好。

图5 配合物的紫外吸收和荧光强度图Fig.5 UV absorption and PL intensity of complexes
2.4 循环伏安表征
由图6可知,所测的铜基配合物CuPS H、CuPS B和CuPS D,它们都有一对相似的氧化还原电位(Eoxd=-0.8 V,Ered=-1.2 V)。就整个循环伏安体系而言,整个过程都是一个单电子的还原过程。这一对可逆的氧化还原电位,归属于菲咯啉配体的氧化还原[13]。在-1.0 V处不可逆的氧化电位,主要归属于Cuガ的氧化为Cuギ。通过对比发现,菲咯啉2,9位上的不同基团对于其氧化还原电位的影响较小,可能是因为铜基配合物的整体骨架决定了其氧化还原电位的大致数值,而简单的修饰只起次要作用[31]。

图6 配合物的循环伏安图Fig.6 Cyclic voltammetry of complexes
3 结 论
合成一系列氮配体2,9-二氯-4,7-二苯基-1,10-菲咯啉(4a)、2,9-二溴-4,7-二苯基-1,10-菲咯啉(4b)、2,9-二甲氧基-4,7-二苯基-1,10-菲咯啉(5a)、2,9-二乙氧基-4,7-二苯基-1,10-菲咯啉(5b)、2,9-烯丙氧基-4,7-二苯基-1,10-菲咯啉 (5c),2,9-二丙氧基-4,7-二苯基-1,10-菲咯啉(5d)、2,9-二丁氧基-4,7-二苯基-1,10-菲咯啉(5e),然后和二膦配体Xantphos、六氟磷酸四乙腈合铜通过原位配位形成铜配合物CuPS A~G,检测其光敏活性,CuPS D光解水制氢活性最高,最大质子转化数TON为270。我们对铜基配合物进行了光电物理表征,发现菲咯啉2,9位基团的电子效应和空间效应对光水解制氢活性有很大的影响,这也为铜光敏剂中氮配体的设计提供了借鉴意义。
[1]Fang B,Bonakdarpour A,Reilly K,et al.ACS Appl.Mater.Interfaces,2014,6(17):15488-15498
[2]Teoh W Y,Scott J A,Amal R.J.Phys.Chem.Lett.,2012,3(5):629-639
[3]Kamat P V.J.Phys.Chem.Lett.,2012,3(5):663-672
[4]Fukuzumi S,Yamada Y,Suenobu T,et al.Energy Environ.Sci.,2011,4(8):2754-2766
[5]Xing Y,Fang B,Bonakdarpour A,et al.Int.J.Hydrogen Energy,2014,39(15):7859-7867
[6]Yuan Y J,Yu Z T,Chen D Q,et al.Chem.Soc.Rev.,2017,46(3):603-631
[7]Hiraishi T,Kamachi T,Okura I.J.Mol.Catal.A:Chem.,2000,151(1):7-15
[8]Kitamoto K,Ogawa M,Ajayakumar G,et al.Inorg.Chem.Front.,2016,3(5):671-680
[9]Kitamoto K,Sakai K.Chem.Eur.J.,2016,22 (35):12381-12390
[10]Probst B,Guttentag M,Rodenberg A,et al.Inorg.Chem.,2011,50(8):3404-3412
[11]Yamauchi K,Masaoka S,Sakai K.Dalton Trans.,2011,40(46):12447-12449
[12]Kitamoto K,Sakai K.Angew.Chem.Int.Ed.,2014,53(18):4618-4622
[13]Yamamoto K,Kitamoto K,Yamauchi K,et al.Chem.Commun.,2015,51(77):14516-14519
[14]Kagalwala H N,Gottlieb E,Li G,et al.Inorg.Chem.,2013,52(15):9094-9101
[15]Guo W,Lv H,Bacsa J,et al.Inorg.Chem.,2016,47 (14):461-466
[16]Yuan Y J,Yu Z T,Liu X J,et al.Sci.Rep.,2014,4(2):4045(9 pages)
[17]Mejía E,Luo S P,Karnahl M,et al.Chem.Eur.J.,2013,19(47):15972-15978
[18]Karnahl M,Mejía E,Rockstroh N,et al.ChemCatChem,2014,6(1):82-86
[19]Fischer S,Hollmann D,Tschierlei S,et al.ACS Catal.,2014,4(6):1845-1849
[20]Khnayzer R S,McCusker C E,Olaiya B S,et al.J.Am.Chem.Soc.,2013,135(38):14068-14070
[21]Kim J,Whang D R,Park S Y.Chemsuschem,2017,10(9):1-5
[22]ZHANG Hong-Mei(张红梅),CAO Hu-Jun(曹湖军),ZHANG Zhi-Yong(张 志 勇 ),et al.Chin.J.Org.Chem.(有 机 化 学 ),2012,32(3):621-623
[23]Guo H C,Zheng R H,Jiang H J.Org.Prep.Proced.Int.,2012,44(4):392-396
[24]Frey J,Kraus T,Heitz V,et al.Chem.Eur.J.,2007,13(27):7584-7594
[25]Luo S P,Mejía E,Friedrich A,et al.Angew.Chem.Int.Ed.,2013,52(1):419-423
[26]Lennox A,Fischer S,Beller M,et al.Chem.Eur.J.,2016,22(4):1233-1238
[27]Dooley D M,Scott R A,Knowles P F,et al.J.Am.Chem.Soc.,1998,120(11):2599-2605
[28]Chen N Y,Xia L M,Sun Y Y,et al.Chem.Eur.J.,2017,23(15):3631-3636
[29]Knorn M,Rawner T,Czerwieniec R,et al.ACS Catal.,2015,5(9):5186-5193
[30]Zhu B Y,Han L,Li Y J,et al.Tetrahedron,2017,73(12):1602-1610
[31]XIA Liang-Min(夏良敏),CHEN Hao(陈浩),WU Qing-An(吴 庆 安),et al.Chinese J.Inorg.Chem.(无 机 化 学 学 报 ),2017,33(4):560-568
