老年ARDS患者硝酸甘油联合亚低温治疗的临床效果观察
2018-01-25谭九根归淑华谢建平项美玲齐宏宇
谭九根 归淑华 谢建平 项美玲 齐宏宇
急性呼吸窘迫综合征(ARDS)是由非心源性致病因素引起、以呼吸困难和顽固性低氧血症为临床表现的综合征,是ICU中的常见重症,严重威胁患者的生命[1]。老年ARDS患者由于呼吸功能和其它各项身体功能退化,免疫功能下降,并常伴有高血压、糖尿病等慢性疾病,病死率更是居高不下[2]。国内外学者对该病的发生、发展机制尚有争议,但肺毛细血管内皮细胞和肺泡上皮细胞凋亡,以及肺内促炎-抗炎介质的失衡所致肺泡-肺毛细血管通透性增加,是目前公认的ARDS患者肺组织间接损伤因素[3]。有研究发现,亚低温状态在降低机体代谢的同时,还能减轻炎症反应[4]。而硝酸甘油可改善肺组织微循环[5]。笔者对近年来本院收治的老年ARDS患者采用硝酸甘油联合亚低温治疗,并与仅采用常规治疗的患者作了比较发现,该方法可以改善患者肺毛细血管通透性及短期疗效,现报道如下。
1 对象和方法
1.1 对象 选取2014年2月至2016年10月我院ICU收治因肺部感染导致的老年ARDS患者73例,男53例,女 20 例,年龄 60~75(67.4±5.3)岁。纳入标准:(1)符合2012年ARDS柏林诊断标准[6],且诊断ARDS<24h;(2)年龄≥60 岁;(3)接受机械通气治疗。排除标准:(1)慢性阻塞性肺疾病(COPD)、间质性肺疾病、肺栓塞患者;(2)其它重要脏器严重器质性病变;(3)肿瘤、烧伤或血液系统疾病。按随机数字表法分为观察组37例与对照组36例。两组患者性别、年龄、APACHEⅡ评分以及氧合指数等一般资料差异均无统计学意义(均P>0.05),详见表1。本研究经医院伦理委员会审核同意,患者及家属签署知情同意书。

表1 两组患者一般资料的比较
1.2 方法 对照组患者根据《实用重症医学》中的治疗原则接受常规对症处理以及原发病治疗,包括器官功能支持、呼吸支持以及综合处理[7]。机械通气采取肺保护性通气策略,为同步间歇指令通气模式(SIMV),将气道平台压维持≤30cmH2O。观察组患者在常规治疗基础上,进行硝酸甘油治疗联合全身降温式(亚低温)治疗。具体方法:静脉泵入硝酸甘油0.5mg/h,同时使用BlandetrolⅡ-Model 223R型水毯式医用控温仪(购于美国Sub Zero公司)对患者进行降温,确保患者鼻咽温度(中心体温)在1h内降为34~35℃,并维持连续72h,之后进行缓慢复温,复温速率控制在1℃/d。
1.3 观察指标 分别于治疗前和治疗后(观察组患者为体温稳定后)第1、24、48、72h进行APACHEⅡ评分,并进行动脉血气分析。抽取5ml静脉血,经抗凝、离心、分离和鉴定操作计数循环内皮细胞(CEC)。使用床旁纤维支气管镜进行肺泡灌洗,取灌洗液,ELISA法检测TNF-α、肺泡表面活性蛋白A(SP-A)、血管内皮生长因子(VEGF)水平,操作严格根据试剂盒说明书进行。床旁脉波指示剂心排血量监测对患者血管外肺水指数(EVLWI)和肺血管通透性指数(PVPI)进行监测。同时记录两组患者机械通气治疗与7d、28d存活率。
1.4 统计学处理 应用SPSS 18.0统计软件。计量资料用表示,两组间比较采用t检验,不同时间点的比较采用重复测量方差分析;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者不同时点APACHEⅡ评分与氧合指数的比较 两组患者治疗前APACHEⅡ评分与氧合指数差异均无统计学意义(均P>0.05)。治疗后,两组患者APACHEⅡ评分均有所升高,对照组治疗后48、72h APACHEⅡ评分高于治疗前(P<0.05),观察组治疗后72h APACHEⅡ评分高于治疗前(P<0.05),而对照组氧合指数较治疗前降低(P<0.05)。进一步进行组间比较显示,观察组治疗后24、48、72h的APACHEⅡ评分均低于对照组(均P<0.05),氧合指数高于对照组患者(P<0.05)。详见表2。

表2 两组患者不同时点APACHEⅡ评分与氧合指数的比较
2.2 两组患者不同时点TNF-α、SP-A水平与肺毛细血管通透性的比较 两组患者治疗前TNF-α、SP-A水平与肺毛细血管通透性差异均无统计学意义(均P>0.05)。治疗后,两组患者 EVLWI、PVPI、VEGF、CEC 和 TNF-α水平均较治疗前升高,而SP-A水平较治疗前降低(均P<0.05)。进一步组间比较显示,治疗后第72h观察组患者 EVLWI、PVPI、VEGF、CEC 和 TNF-α 水平较对照组患者低,SP-A水平则较对照组患者高(均P<0.05)。详见表3。
2.3 两组患者通气时间与7d、28d存活率的比较 治疗后,观察组患者机械通气时间显著短于对照组患者(P<0.01),7d和28d存活率高于对照组患者(均P<0.05),详见表4。
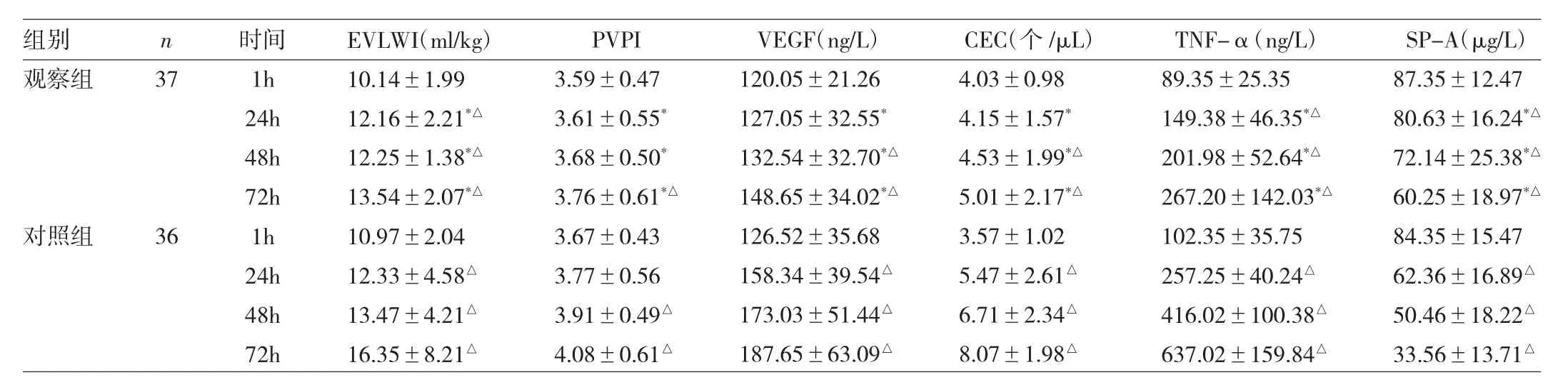
表3 两组患者不同时点TNF-α、SP-A水平与肺毛细血管通透性的比较

表4 两组患者通气时间与7d、28d存活率的比较
3 讨论
ARDS是ICU患者死亡的重要原因之一[8],可由重症肺炎、脓毒症、创伤等引起,并迅速进展为以低氧血症为特征的呼吸困难。老年ARDS患者各项身体功能退化,免疫功能下降,并常伴有高血压、糖尿病等慢性疾病,显著增加救治难度。国内外相关研究普遍认为,患者肺内促炎-抗炎介质的失衡是发生肺泡-肺毛细血管通透性增加的关键环节,最终导致ARDS的发生、发展[9]。通过降低患者肺泡-肺毛细血管通透性达到改善ARDS早期顽固性低氧血症的目的,是ARDS治疗的研究热点[10]。
使用PiCCO技术对患者EVLWI与PVPI水平进行监测,是目前临床上用于评价ARDS非心源性肺水肿程度的常用手段。有学者研究认为,EVLWI水平在ARDS患者诊断和预测预后中有指导价值,PVPI水平可对肺水肿的类型与程度进行鉴别[11]。本研究中观察组患者接受亚低温治疗后,虽然EVLWI与PVPI水平较治疗后第1h有所升高,但从第24h开始,两项指标均低于未进行治疗的对照组患者,提示硝酸甘油联合亚低温治疗能够减轻ARDS患者的肺水肿程度,可能与抑制肺泡-肺毛细血管通透性的增加有关。
有报道发现血浆VEGF水平在多种因素所致的急性肺损伤模型中均有上升,且与损伤程度呈正相关性[12]。还有学者研究证实肺泡上皮细胞衬液中VEGF水平在急性肺损伤(ALI)患者早期显著下降,程度与肺损伤评分呈负相关,并在疾病恢复期缓慢上升[13],这可能与ALI患者早期肺泡-肺毛细血管通透性增加,肺泡上皮细胞衬液中VEGF通过其进行外周血液循环有关。而在本研究中,两组患者VEGF水平均随病情发展逐渐升高,且与EVLWI、PVPI水平的变化趋势一致,提示外周血VEGF水平升高与肺泡-肺毛细血管通透性增加相关。而观察组患者进行硝酸甘油联合亚低温治疗后,EVLWI、PVPI、VEGF水平均低于对照组患者,与硝酸甘油降低肺泡-肺毛细血管通透性有关。作为毛细血管通透性评价指标的CEC在观察组患者中更少[14],也与上述观点相符。分析其具体机制,可能有以下几点:(1)硝酸甘油通过合成一氧化氮松弛血管平滑肌,减少白细胞与血小板黏附,减轻组织水肿并降低微循环通透性[15];(2)亚低温环境直接对VEGF的表达产生抑制作用[16];(3)亚低温环境能够抑制VEGF与血管内皮细胞上的受体结合;(4)VEGF功能在亚低温环境中被抑制,减少中性粒细胞的聚集和其它炎性介质(TNF-α等)的释放,进一步抑制VEGF的表达,产生良性循环并最终对血管内皮细胞起保护作用。
由细支气管非纤毛上皮细胞和Ⅱ型肺泡上皮细胞分泌的SP-A的生理功能主要是维持上皮细胞和肺泡的完整性形态[17],此外,其还在调节炎症反应和免疫功能中发挥生物学作用[18],因此,测定SP-A水平的变化在ARDS的发展过程中有重要临床意义。本研究显示,SPA水平随ARDS的发展而降低,提示Ⅱ型肺泡上皮细胞在ARDS的发生、发展过程中损伤加重。国外有研究发现,ARDS患者的Ⅱ型肺泡上皮细胞受损程度与TNF-α水平呈负相关[19],这与本研究结果相符。
大量研究表明,APACHEⅡ评分和氧合指数可作为评价ARDS患者预后的重要指标[20],在此不做赘述。而本研究中两组患者TNF-α、SP-A水平与肺毛细血管通透性的变化与APACHEⅡ评分和氧合指数的变化趋势一致,再次证实肺泡-肺毛细血管通透性增加是ARDS发展的重要病理生理环节,也提示全身性亚低温状态能够通过减少毛细血管通透性而缩短患者的机械通气时间,降低7d病死率,这可能与亚低温状态在降低老年ARDS患者机体氧耗的同时,还能减少中性粒细胞的浸润、细胞因子和氧自由基的释放,抑制细胞凋亡有关[21]。
综上所述,老年ARDS患者接受常规对症和支持治疗的基础上,应用亚低温治疗作为辅助治疗手段,可改善患者早期肺氧合功能,降低肺血管通透性,减少炎症因子释放,缩短患者机械通气时间,并降低短期病死率。
[1] Repessé X,Charron C,Vieillard-Baron A.Acute Cor Pulmonale in ARDS:Rationale for Protecting the Right Ventricle[J] .Chest,2015,147(1):259-265.doi:org/10.1378/chest.14-0877.
[2] 田瑞兆,张丽.PiCCO指导下液体复苏在ARDS合并感染性休克老年患者EGDT中的意义[J] .甘肃医药,2015,3(8):561-563.
[3] Forel JM,Guervilly C,Hraiech S,et al.Type III procollagen is a reliable marker of ARDS-associated lung fibroproliferation[J] .Intensive Care Medicine,2015,41(1):1-11.doi:org/10.1007/s00134-014-3524-0.
[4] 申美荣.亚低温对油酸型ARDS大鼠Clara细胞分泌蛋白16、肺表面活性蛋白A含量的影响[D] .桂林医学院,2015:5-6.
[5] Liu LP,Li B,Zhu L,et al.Clinical efficacy of nitroglycerin in patients with septic shock with ARDS[J] .Medical Journal of Chinese Peoples Liberation Army,2015,40(8):647-651.doi:10.11855/j.issn.0577-7402.2015.08.09.
[6] The ARDS Definition Task Force.Acute respiratory distress syndrome:theBerlinDefinition[J] .JAMA,2012,307(23):2526-2533.doi:org/10.1001/jama.2012.5669
[7] 刘大为.实用重症医学[M] .北京:人民卫生出版社,2010:496-509.
[8] Geboers DGPJ,Beer FMD,Boer TD,et al.Plasma suPAR as a prognostic biological marker for ICU mortality in ARDS patients[J] .Intensive Care Medicine,2015,41(7):1281-1290.doi:org/10.1007/s00134-015-3924-9.
[9] Calfee CS,Janz DR,Bernard GR,et al.Distinct Molecular Phenotypes of Direct Versus Indirect ARDS in Single and Multi-Center Studies[J] .Chest,2015,147(6):1539-1548.doi:org/10.1378/chest.14-2454.
[10] Dancer RC,Parekh D,Lax S,et al.Vitamin D deficiency contributes directly to the acute respiratory distress syndrome(ARDS)[J] .Thorax,2015,70(7):617-624.doi:10.1136/thoraxjnl-2014-206680.
[11] Saito N,Yagi T,Hara Y,et al.Implementation of an optimal fluid management protocol using the PiCCO system delays development of ARDS secondary to severe sepsis[J] .Critical Care,2012,16(1):1-189.
[12] Wen J,Wang X,Pei H,et al.Anti-psoriatic effects of Honokiol through the inhibition of NF-κB and VEGFR-2 in animal model of K14-VEGF transgenic mouse[J] .Journal of Pharmacological Sciences,2015,128(3):116.doi:10.1016/j.jphs.2015.05.008.
[13] Birgani S A,Mailander M,Wasle I,et al.Efficient therapy of ischaemic lesions with VEGF121-fibrin in an animal model of systemic sclerosis[J] .Annals of the Rheumatic Diseases,2016,75(7):1399-1406.doi:10.1136/annrheumdis-2015-207548.
[14] 瞿长春,赖添顺.肺内型与肺外型急性呼吸窘迫综合征患者血管内皮细胞损伤的比较研究[J] .实用医学杂志,2009,25(16):2668-2670.10.3969/j.issn.1006-5725.2009.16.024.
[15] Papazian L,Calfee CS,Chiumello D,et al.Diagnostic workup for ARDS patients[J] .Intensive Care Medicine,2016,42(5):674.doi:10.1007/s00134-016-4324-5.
[16] 胡军涛,潘熠平,陈显峰,等.亚低温对急性呼吸窘迫综合征患者肺血管通透性的影响[J] .中华危重病急救医学,2016,28(9):775-779.doi:10.3760/cma.j.issn.2095-4352.2016.09.002.
[17] 王杰,牟界,张文斌,等.利拉鲁肽对LPS诱导的小鼠肺泡上皮细胞SP-A表达的调控机制研究[J] .西部医学,2015,27(7):981-985.doi:10.3969/j.issn.1672-3511.2015.07.007
[18] Minutti CM,García-Fojeda B,Sáenz A,et al.Surfactant Protein A Prevents IFN-γ/IFN-γ Receptor Interaction and Attenuates Classical Activation of Human Alveolar Macrophages[J] .Journal of Immunology,2016,197(2):32-42.doi:10.4049/jimmunol.1501032.
[19] Stromps JP,Fuchs P,Demir E,et al.Intraalveolar TNF-β in combined burn and inhalation injury compared with intraalveolar interleukin-6[J] .Journalof Burn Care&Research OfficialPublication of the American Burn Association,2015,36(2):55.10.1097/BCR.0000000000000108.
[20] HajimahmoodiM,Mojtahedzadeh M,GhaffarnatanziN,et al.Effects of vitamin E administration on APACHE II score in ARDS patients[J] .Daru Journal of Pharmaceutical Sciences,2009,17(1):24-28.
[21] Duan M,Berra L,Kumar A,et al.Use of Hypothermia to Allow Low-Tidal-Volume Ventilation in a Patient With ARDS[J] .Respiratory Care,2011,56(12):1956-1958.doi:10.4187/respcare.01211.
