眼镜蛇毒NGF通过PI3K/Akt促人肝星状细胞凋亡的机制研究
2018-01-19蔡凤桃张学荣王秀男班建东
蔡凤桃,张学荣,孙 林,王秀男,廖 明,班建东,陈 缨,农 君
(广西医科大学 1. 蛇毒研究所、2. 基础医学院生物化学与分子生物学教研室,广西 南宁 530021)
肝纤维化(hepatic fibrosis,HF)是由各种致病因子所致肝内结缔组织异常增生,是肝脏对于各种慢性刺激损伤进行自我修复的一种病理过程,最终可能发展为肝硬化、肝功能衰竭等肝脏疾病。细胞外基质(extracellular matrix,ECM)是细胞合成并分泌到胞外,分布在细胞表面或细胞间的大分子,其增生与降解失衡可导致肝内结缔组织沉积,从而导致肝纤维化。肝星状细胞(hepatic stellate cell,HSC)作为肝脏组织中ECM的主要合成细胞,其增殖与凋亡直接影响肝纤维化的发生与发展[1]。近期有研究表明,HSC在肝细胞癌(hepatocellular carcinnoma,HCC) 的发生、发展和转移中可能至关重要,被激活的HSC可以异常分泌一些细胞因子,如IL-8、FGF1/2、PDGF、IGF等,此类因子会促进HCC的进展[2-3]。因此,诱导HSC凋亡、抑制其增殖成为预防和治疗肝纤维化、肝癌和一些其他肝脏疾病的一个重要途径,对HSC凋亡机制的研究也显得尤为重要[4]。PI3K/Akt作为大鼠HSC中的重要信号通路已被证明可通过控制其上游或下游蛋白,影响细胞增殖与凋亡[5]。研究表明[6-7],硫化氢、氧化氮类化合物以及神经生长因子(nerve growth factor,NGF)可以通过调节PI3K/Akt信号通路,抑制大鼠HSC的增殖并诱导其凋亡,从而对肝纤维化发挥良好的干预作用。NGF作为近年来发现的HSC凋亡诱导剂,已在肝纤维化的研究中引起广泛重视[8-9]。本实验室从眼镜蛇毒中提取NGF,得率高、纯度高、方法简单。并且前期实验证实,NGF可通过PI3K/Akt信号通路抑制大鼠肝星状细胞HSC-T6的增殖,最小有效浓度为4 mg·L-1,最大抑制率约为60%。 但近年来,对人HSC的研究甚少。本研究以人HSC-LX2为研究对象,采用CCK-8法、流式细胞术和 Western blot 检测NGF对LX2细胞增殖和凋亡的影响及其作用机制,以期为治疗肝脏疾病提供新思路。
1 材料与方法
1.1主要试剂与仪器人肝星状细胞株LX2,由广西医科大学病理学教研室馈赠;眼镜蛇毒神经生长因子(NGF)由本实验室提取;GAPDH抗体、Akt抗体、辣根过氧化物酶荧光标记羊抗兔抗体、PI3K/Akt信号通路的特异性抑制剂 LY294002,均购自Abcam公司;Annexin V-FITC/7-AAD 凋亡试剂盒(6084648)购自BD 公司;CCK-8试剂盒(KL640)购自日本同仁公司。酶标仪(Biotek公司,型号:ELX800);流式细胞仪(BD公司,型号:FACScalibur)。
1.2方法
1.2.1眼镜蛇毒NGF的提取 广西眼镜蛇毒粗毒冻干粉溶解、离心、0.45 μm滤膜过滤,经DEAECL-6B 阴离子交换层析柱、G-50 凝胶分子筛、MACRO-PREP HIGH S 强阳离子交换层析柱三步分离纯化后,收集活性峰,透析、冻干,质谱检测,电泳鉴定,PC-12细胞活性鉴定,所得产物即为NGF。0.22 μm滤膜过滤除菌,-20℃保存备用[10]。
1.2.2LX2细胞培养 将LX2细胞株置于含10%胎牛血清、1%青-链霉素的RPMI 1640完全培养液中,37℃、5% CO2培养箱中培养过夜,细胞贴壁后,换液处理。细胞达到90%融合度,弃去培养基, PBS洗细胞3次,彻底清除血清后,0.25%胰酶消化1 min,加入完全培养基终止消化,1 000 r·min-1离心5 min,弃上清;2 mL新鲜培养液重悬,细胞计数,以每孔1 000个细胞数接种于96孔培养板中。每次实验均在细胞指数生长期时进行。
1.2.3实验分组 本实验分为空白组、实验组(NGF组)、对照组(LY294002)。实验组分别按照0.1、0.5、1、2、4、8、16 mg·L-1浓度梯度加入NGF;对照组加入50 μmol·L-1LY294002,空白组加入等体积的PBS。
1.2.4CCK-8法测定细胞增殖抑制率 取对数期生长期的LX2细胞,计数,以每孔1 000个细胞数接种于96 孔板,共7组,每组设6个复孔。待细胞贴壁后,吸出培养基,用 PBS洗3次,加入无血清的培养基饥饿处理12 h,使细胞同步化。按照实验设计及分组,加入相应剂量的NGF/LY294002,37℃细胞培养箱孵育24 h,弃去孔内培养基,PBS洗3次,每孔加90 μL RPMI 1640完全培养基、10 μL CCK-8,37℃孵育2 h,待颜色变深后,酶标仪450 nm 波长处测定OD值,根据公式计算细胞增殖抑制率。抑制率/%=(培养基孔OD值-实验孔OD值)/(对照孔OD值- 培养基孔OD值)×100% 。
1.2.5流式细胞术检测细胞凋亡 取对数生长期的LX2细胞,以2×105/孔的密度接种于6 孔板,十字震荡混匀,待细胞贴壁后,用无血清RPMI 1640培养液同步化12 h,按照实验分组加入相应剂量的 NGF/LY294002,继续培养24 h 后,弃培养基,用0.25%胰酶(不含EDTA)消化,加入新鲜培养基终止消化,离心弃上清,取1×106细胞/管于流式管中。按照 Annexin V-FITC/7-AAD 凋亡试剂盒说明书进行染色,避光孵育30 min后,上机进行流式检测。
1.2.6Western blot分析Akt磷酸化水平 取对数生长期的LX2细胞2×105个/孔接种于6 孔培养板,用无血清RPMI 1640培养液饥饿处理12 h,按不同分组分别加入 PBS、NGF (最小有效浓度)、LY294002 (50 μmol·L-1)、NGF (最小有效浓度) +LY294002(50 μmol·L-1)作用最小作用时间。处理后的LX2 细胞用预冷的PBS洗3次,每孔加入50 μL细胞裂解液(含PMSF、磷酸酶抑制剂、蛋白酶抑制剂),冰上裂解10 min,13000 r·min-1离心30 min,收集上清,BCA法测蛋白浓度。以GAPDH为内参,Western blot检测蛋白表达量,用 ODYSSEY 系统进行定量。

2 结果
2.1不同处理因素对LX2细胞增殖的影响如Fig 1所示,随着作用于细胞的NGF浓度的增大,LX2细胞增殖抑制率逐渐增大,当 NGF浓度达到 8 mg·L-1时,增殖抑制率达到平台期,上升缓慢。其中,最小有效浓度为1 mg·L-1,当 NGF 浓度为1 mg·L-1以下时,与空白组比较差异无统计学意义(P>0.05);当NGF浓度为1 mg·L-1及以上时,与空白组比较,差异具有统计学意义(P<0.01);对照组与空白组以及实验组各浓度相比,差异具有统计学意义(P<0.01)。

Fig 1 The inhibitory rate of LX2 proliferation after treatment with different factors determined by CCK-8
*P<0.05,**P<0.01vsblank group
2.2不同处理因素对LX2细胞凋亡的影响如Fig 2所示,经流式细胞术检测,在不同浓度NGF作用下,LX2细胞凋亡程度不同,且随着NGF浓度增加,细胞凋亡率逐渐增大。经计算,当NGF浓度为1、8 mg·L-1时,与空白组凋亡率比较差异具有统计学意义(P<0.01)。
2.3不同处理因素对p-Akt蛋白水平的影响Fig 3的Western blot结果显示,当加入NGF(1 mg·L-1)、LY294002 (50 μmol·L-1)后,p-Akt的表达量顺序为:空白组(PBS)>NGF组>LY294002组>NGF+LY294002组,Akt的表达量基本没有变化。提示NGF对Akt的磷酸化具有抑制作用。

Fig 2 Apoptosis of LX2 cells underdifferent treatment factors
A: Blank group ;B: NGF 1mg·L-1; C: NGF 8mg·L-1; D: LY294002 50 μmol·L-1; E: Apoptosis rate of LX2 cells under different treatment factors.**P<0.01vsblank group
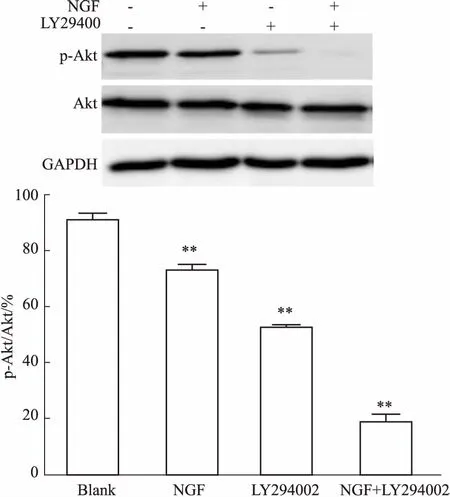
Fig 3 Phosphorylation of Akt protein in LX2 cells detected by Western blot
**P<0.01vsblank group
3 讨论
肝纤维化是多种慢性肝病进展至肝硬化的中间过程,是肝癌发展的早期表现,其特征为以胶原蛋白为主的ECM合成与降解失衡。因此,揭示肝纤维化发生、发展机制以及抑制其发展,成为预防和控制肝硬化、肝癌和其他一些肝脏疾病发展的重要途径。HSC作为产生ECM的关键细胞,减少活化HSC的数量是预防和治疗肝脏疾病的有效方法[11]。研究表明,过氧化氢、硫化氢、EZH2等可通过作用于PI3K通路、TGFβ-Smad通路、ROCK通路、MAPK通路等信号通路,影响通路下游多种效应分子的活化状态,从而对HSC的增殖、凋亡、转录、翻译、代谢、新血管生成以及细胞周期进行调控[12-13]。眼镜蛇毒NGF是一种神经营养因子,可通过使HSC细胞周期停滞于G2期而抑制HSC增殖;经NGF作用的大鼠HSC可出现明显的增殖受抑、细胞凋亡的形态学改变[14]。有研究发现,眼镜蛇毒NGF能改变HSC-T6信号通路中某些蛋白的表达量,使HSC-T6细胞增殖受到抑制,从而逆转肝纤维化过程。
本研究通过CCK-8、流式细胞术、Western blot等技术分别检测了在PBS、NGF、LY294002作用下,LX2细胞增殖、凋亡和蛋白表达的情况。结果显示,眼镜蛇蛇毒中提取的神经生长因子NGF以不同浓度作用于LX2细胞时,均可对细胞的增殖率起到直接抑制作用,并且具有浓度依赖性,其最小有效浓度为1 mg·L-1,当浓度为8 mg·L-1时达到平台期,最大增殖抑制率约为63%。与张可星等[15]实验结果(NGF抑制HSC-T6增殖的最小浓度为4 mg·L-1)相比,最小有效浓度降低。流式细胞术结果表明,NGF促进LX2细胞凋亡也具有一定的浓度相关性,与对照组LY294002的作用结果相比不具统计学意义,说明NGF可促进LX2细胞凋亡,且与LY294002有类似作用。Western blot实验结果表明,NGF和LY294002 均使p-Akt的表达量降低,Akt的表达量基本没有变化,NGF能够有效抑制 PI3K/Akt 信号通路中Akt蛋白的磷酸化,从而抑制LX2细胞的增殖,与通路抑制剂联合使用时效果加强。综合以上实验结果,我们推论,眼镜蛇毒NGF可抑制LX2细胞增殖,促进其凋亡,其作用机制可能与降低PI3K/Akt信号通路中Akt蛋白的磷酸化有关。PI3K/Akt信号通路与其他信号通路之间的关系,及其与各种影响因素之间的关系,也值得进一步研究和探讨。
综上所述,本研究为发现预防及治疗肝纤维化的新作用靶点提供基础。NGF 作为重要的促HSC凋亡的物质在眼镜蛇毒中含量十分丰富,研究眼镜蛇蛇毒 NGF抑制HSC增殖的机制,对阐明肝纤维化的发病机制、寻找肝纤维化的防治药物及临床治疗肝纤维化有着积极的意义。
(致谢:本实验在广西医科大学实验中心蛇毒研究所完成,感谢各位老师和同学对实验的指导与帮助!)
[1] 秦雨萌,陈胜华. 肝纤维化进程中细胞外基质对肝星状细胞的作用及机制研究进展[J]. 实用肝脏病杂志,2017,20(3):381-4.
[1] Qin Y M, Chen S H. Influence of extracellular matrix on hepatic stellate cells during liver fibrosis process [J].JPracticalHepatol, 2017,20(3):381-4.
[2] 袁 园,朱正秋. 下调肝星状细胞MACC1对胃癌细胞迁移侵袭能力的影响[J]. 现代肿瘤医学,2017,25(2):174-8.
[2] Yuan Y, Zhu Z Q. Effect of down-regulating MACC1 by shRNA on invasion and migration of gastric carcinoma cells [J].JModOncol,2017,25(2):174-8.
[3] Song Y,Kim S H,Kim K M,et al. Activated hepatic stellate cells play pivotal roles in hepatocellular carcinoma cell chemoresistance and migration in multicellular tumor spheroids[J].SciRep, 2016,6:36750.
[4] Zhu B,Lin N,Zhang M,et al. Activated hepatic stellate cells promote angiogenesis via interleukin-8 in hepatocellular carcinoma[J].JTranslMed, 2015,13(1): 365.
[5] 黄 成,李 俊,马陶陶,等. PI3K/Akt信号通路与肝纤维化[J]. 中国药理学通报,2011,27(8):1037-41.
[5] Huang C,Li J,Ma T T,et al. PI3K/Akt signaling pathway and hepatic fibrosis[J].ChinPharmacolBull, 2011,27(8):1037-41.
[6] 胡仁统,张学荣,徐 瑾,等.蛇毒神经生长因子对大鼠肝星状细胞增殖、凋亡及肝纤维化相关蛋白质表达的影响[J].中国药理学通报, 2013,29(4): 468-73.
[6] Hu R T, Zhang X R, Xu J,et al. Effects of snake venom nerve growth factor on proliferation, apoptosis and hepatic fibrosis-related protein expression in rat hepatic stellate cells[J].ChinPharmacolBull, 2013,29(4): 468-73.
[7] 卞勉励,陈星燃,张晨曦,等.NOXs在肝纤维化中的作用机制研究[J]. 中国药理学通报, 2016,32(11):1490-3.
[7] Bian M L,Chen X R,Zhang C X,et al. Study on the mechanism of NOXs in hepatic fibrosis[J].ChinPharmacolBull, 2016,32(11):1490-3.
[8] 孙黔云. 眼镜蛇毒因子在生命科学中的应用[J].生命科学,2016,28(1): 22-6.
[8] Sun Q Y. Application of cobra venom factor in life sciences [J].ChinBullLifeSci, 2016,28(1): 22-6.
[9] Trim N,Morgan S,Evans M,et al. Hepatic stellate cells express the low affinity nerve growth factor receptor p75 and undergo apoptosis in response to nerve growth factor stimulation[J].AmJPathol, 2000,156(4): 1235-43.
[10] 侯瑞雪,张学荣,张可星,等. 广西眼镜蛇毒神经生长因子分离纯化方法[J]. 基因组学与应用生物学, 2016,35(5): 1065-70.
[10] Hou R X,Zhang X R,Zhang K X,et al.Separation and purification of nerve growth factor from Guangxi cobra venom[J].GenomicsAppliedBiol, 2016,35(5): 1065-70.
[11] 李丝冰,贾玉杰. 肝纤维化细胞外基质和星状细胞间的相互作用[J]. 生理科学进展, 2014,45(6): 462-4.
[11] Li S B, Jia Y J. The interaction between hepatic fibrosis extracellular matrix and stellate cells[J].ProgPhysiolSci, 2014,45(6): 462-4.
[12] 陈小霞,谢 娟,黄 成,等. EZH2对HSC-T6细胞增殖活化的影响及其部分机制研究[J].中国药理学通报, 2015,31(8):1061-5.
[12] Chen X X, Xie J,Huang C,et al. Research progress on Nrf2-ARE signaling pathway involved in liver disease pathological mechanism[J].ChinPharmacolBull, 2015,31(8):1061-5.
[13] Han M,Liu X,Liu S,et al. 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD) induces hepatic stellate cell (HSC) activation and liver fibrosis in C57BL6 mouse via activating Akt and NF-kappaB signaling pathways[J].ToxicolLett, 2017,273: 10-9.
[14] 陈 新,王玉珍,修贺明,等. 神经生长因子在肝纤维化大鼠肝星状细胞凋亡中的作用[J]. 中华医学杂志, 2006,86(28):1985-8.
[14] Chen X, Wang Y Z, Xiu H M,et al. The effect of nerve growth factor inducing apoptosis on hepatic stellate cells of fibrotic rat liver[J].NatlMedJChina, 2006,86(28): 1985-8.
[15] 张可星,张学荣,侯瑞雪,等.眼镜蛇毒NGF通过PI3K/AKT信号通路对肝星状细胞的影响[J].基因组学与应用生物学, 2016,35(5):1031-5.
[15] Zhang K X, Zhang X R, Hou R X,et al.Effects of obra venom NGF on hepatic stellate cells through PI3K/Akt signal pathway[J].GenomicsAppliedBiol, 2016,35(5): 1031-5.
