人参皂苷CK对人肝癌细胞HepG2迁移及侵袭的影响
2018-01-19彭文婷孙妩弋孙家昌杜佳佳
彭文婷,孙妩弋,孙家昌,杜佳佳,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽 合肥 230032)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肿瘤之一。2015年,中国超过30万人死于HCC,其致死率在肿瘤相关死亡病例中位居第2位,仅次于肺癌,严重危害了人类的生活质量和生命健康[1]。尽管诊疗水平不断提高,手术切除仍是HCC治疗的主要手段,HCC患者术后5年的生存率有所提高,但是术后癌细胞的转移仍是HCC预后的重要影响因素[2]。HCC的转移是一个复杂的过程,它涉及大量基因异常表达以及相关信号通路的异常。肿瘤细胞获得转移和侵袭能力的主要途径就是上皮间质转化(epithelial mesenchymal transition,EMT),其主要的特征表现为上皮型标志物如E-钙黏蛋白(E-cadherin)的缺失或下调,以及间质型标志物如神经-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)的获得和上调[3-4]。目前,用于抗肝癌药物反应性较低,易产生抗药性,且药物毒性大,HCC的预后仍不乐观,如何有效改善HCC的预后仍面临巨大的挑战。越来越多研究提示,天然药物来源的单体化合物在肿瘤的治疗上可能具有重要前景[5]。
人参皂苷CK(ginsenoside metabolite compound K) 结构见Fig 1,是天然二醇型人参皂苷(如人参皂苷Rb1、Rb2、Rc等)在人肠道细菌作用下的主要降解产物,根据皂苷元母核,其结构属四环三萜达玛烷型人参皂苷,是人参皂苷在体内吸收和发挥活性作用的主要形式,具有抗炎、保护肝脏、减轻骨髓抑制、改善免疫功能等药理活性[6]。有研究表明,人参皂苷CK通过抑制PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路,抗脑胶质瘤细胞增殖,促进其凋亡[7]。另外,人参皂苷CK可诱导肝癌细胞凋亡,其作用机制可能与下调p53蛋白表达和降低Bcl-2/Bax比例有关[8]。然而,人参皂苷CK对HCC侵袭转移的影响尚未见报道。本实验探讨人参皂苷CK对人肝癌细胞HepG2迁移及侵袭能力的影响,并进一步探究其可能的作用机制。
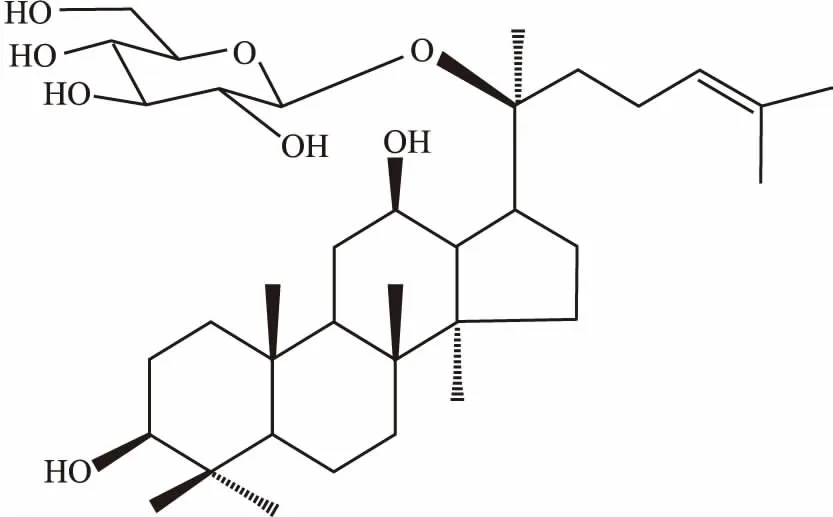
Fig 1 Chemical structural formula of ginsenoside CK
1 材料
1.1细胞株人肝癌细胞HepG2由本实验室冻存。于37℃水浴中复苏,再将细胞转移至培养瓶中,加入适量含10%胎牛血清的培养基,置于37℃、5% CO2细胞培养箱中培养。
1.2药物与试剂DMEM(Dulbecco’s modified Eagle’s medium)高糖培养基:美国Gibco公司;人参皂苷CK:分子质量622.18,由浙江海正制药有限公司提供,用PBS溶解,用培养液稀释成不同浓度;MTT: Sigma公司;Matrigel基质胶:美国BD公司;RIPA蛋白裂解液、Western一抗、二抗稀释液、胰蛋白酶:江苏碧云天公司;预染蛋白质分子量标准:美国Thermo公司;抗p-ERK、ERK、p-Akt、Akt、N-cadherin、E-cadherin抗体:美国Cell Signaling Technology公司;抗β-actin抗体、辣根酶标记山羊抗小鼠IgG(H+L)、辣根酶标记山羊抗兔IgG(H+L):北京中杉金桥生物技术有限公司;ECL化学发光试剂盒:美国Pierce Biology公司。
1.3仪器洁净工作台:江苏苏州安泰空气技术有限公司;CO2细胞培养箱:Thermo Fisher Scientific公司;Infinite M1000 PRO多功能酶标仪:瑞士Tecan公司;Powerpac164-5070电泳仪:美国Bio-Rad公司;LAS4000Mini型化学发光成像分析仪:美国GE公司;BX53正置显微镜、IX-71 荧光倒置显微镜:日本Olympus光学工业株氏会社产品。
2 方法
2.1MTT法检测细胞活力将处于对数生长期的HepG2细胞制成单细胞悬液并计数, 使细胞数约为5×107·L-1,接种于96孔板,每孔加200 μL细胞悬液;放置在37℃、5% CO2细胞培养箱中;待细胞贴壁后,在96孔板中加入不同浓度人参皂苷CK(0、10、20、40、80 μmol·L-1),每组6个复孔,放置在培养箱中培养24 h;培养结束前4 h,取出96孔板,每孔加入20 μL浓度为5 g·L-1的MTT溶液;放入培养箱继续孵育4 h;培养结束后吸出上清,每孔加入150 μL DMSO,避光,在水平振荡仪上震动10 min;用酶标仪检测各组在490 nm处的OD值,绘出细胞活力柱状图。
2.2细胞划痕实验检测细胞迁移能力将处于对数生长期的HepG2细胞制成单细胞悬液,计数,接种于6孔板,使每孔细胞数约为1×106个;放置在37℃、5% CO2细胞培养箱中;待细胞贴壁后,细胞汇合度约为80%时,换为无血清的DMEM培养,每孔用枪头划出3道竖线,在光学显微镜下观察,拍摄各孔细胞0 h时,细胞划痕的初始状态;之后在6孔板中加入不同浓度的人参皂苷CK(0、20、40、80 μmol·L-1),放入培养箱中培养至24 h时后取出,在光学显微镜下拍摄各组细胞划痕的状态。计算细胞24 h迁移率。迁移率=(划痕面积0 h- 划痕面积24 h)/划痕面积0 h
2.3Transwell实验检测细胞侵袭能力将Transwell小室放于24孔板中,在Transwell下室中加入含10%胎牛血清的DMEM高糖培养基,并分别加入不同浓度的人参皂苷CK(0、20、40、80 μmol·L-1);将Matrigel胶放入冰箱中隔夜使其解冻,在Transwell小室表面铺100 μL用DMEM稀释的Matrigel,放在培养箱中孵育2 h,使形成一层基质屏障膜;将处于对数生长期的HepG2细胞制成单细胞悬液,计数,接种于Transwell小室,每孔细胞数约为2×104个,细胞用无血清的培养基进行培养;放入细胞培养箱,培养48 h;取出Transwell小室,PBS轻轻漂洗2遍,用结晶紫染色;PBS冲洗,Transwell上室中未迁移的细胞用棉签轻轻擦去;在倒置显微镜下观察,对膜底细胞进行拍照、计数、统计学分析。
2.4Westernblot实验将处于对数生长期的HepG2细胞制成单细胞悬液,计数,种于6孔板,每孔细胞数约为1×106个;待细胞贴壁后,培养至80%融合后,换无血清培养基同步化;之后在6孔板中加入不同浓度的人参皂苷CK(0、20、40、80 μmol·L-1),放入培养箱中培养24 h;弃去培养基,用PBS洗涤2次;加入细胞裂解液,用细胞刮轻轻刮下贴壁细胞,吸至EP管中,4 ℃、15 000 r·min-1离心15 min,吸取上清得到细胞总蛋白,BCA法进行蛋白定量;进行SDS-PAGE电泳,转膜;用含0.05%吐温20的PBS(TPBS)配制5%脱脂奶粉,封闭PVDF膜,放置于37°C摇床中2 h;将PVDF膜加入按1 ∶1 000稀释的β-actin、p-ERK、ERK、p-Akt、Akt、E-cadherin、N-cadherin抗体中,4 ℃摇床孵育过夜;加入按适当比例稀释后的二抗,37 ℃孵育2 h;将ECL显影液(A液 ∶B液=1 ∶1)均匀涂布于膜上条带相应位置,于LAS4000Mini型化学发光成像分析仪中曝光;采用Image J图像分析软件进行结果分析,测得条带的灰度值,计算各组的目的条带和内参的比值,比较各组间差异。

3 结果
3.1人参皂苷CK抑制肝癌细胞的活力Fig 2 MTT结果显示,不同浓度的人参皂苷CK作用后,与对照组(0 μmol·L-1人参皂苷CK)相比,10 μmol·L-1人参皂苷CK组HepG2细胞活力并无明显变化。人参皂苷CK浓度增加至 20~80 μmol·L-1时,人肝癌细胞HepG2的活力受到明显抑制。

Fig 2 Effect of ginsenoside CK on viability of
**P<0.01vscontrol group
3.2人参皂苷CK抑制肝癌细胞的迁移使用细胞划痕法检测人参皂苷CK对人肝癌细胞HepG2迁移能力的影响。与对照组(0 μmol·L-1人参皂苷CK)相比,人参皂苷CK(20、40、80 μmol·L-1)能明显抑制人肝癌细胞HepG2的迁移(Fig 3)。
3.3人参皂苷CK抑制肝癌细胞的侵袭Transwell侵袭实验结果显示(Fig 4),与对照组(0 μmol·L-1人参皂苷CK)相比,人参皂苷CK(20、40、80 μmol·L-1)明显抑制人肝癌细胞HepG2的穿膜细胞数。提示人参皂苷CK能抑制人肝癌细胞HepG2的侵袭。
3.4人参皂苷CK对HepG2细胞中EMT相关标志蛋白表达的影响EMT在HCC的侵袭转移过程中起着关键的作用。通过EMT进程,细胞获得较高的迁移、侵袭和降解细胞外基质的能力。Western blot结果显示(Fig 5),与空白对照组相比较,HepG2 细胞中N-cadherin蛋白表达水平随给药浓度增高而下降,而E-cadherin蛋白表达水平逐渐升高。结果提示人参皂苷CK可能调控人肝癌HepG2细胞的EMT进程。
3.5人参皂苷CK对HepG2细胞中ERK、Akt信号的影响Western blot检测显示(Fig 6),与空白对照组相比较,人参皂苷CK(20、40、80 μmol·L-1)作用于HepG2细胞24 h后,ERK、Akt蛋白的表达无明显变化,而p-ERK、p-Akt的表达明显降低,p-ERK/ERK、p-Akt/Akt的比值明显降低。提示人参皂苷CK可抑制ERK、Akt的磷酸化。
4 讨论
HCC初期病情隐匿,无明显症状,一旦出现症状前来就诊者,其病程大多已进入中晚期。这个阶段的HCC,癌细胞可能已经发生侵袭转移,出现多个病灶。目前,除手术切除和化药辅助治疗外,HCC治疗领域缺少疗效好、副作用小的治疗药[9]。相关研究表明,人参皂苷CK能抑制人结肠直肠癌细胞系HCT-116的增殖,促进细胞凋亡,也能抑制鼠神经胶质瘤细胞C6的转移[10-11]。本研究发现,人参皂苷CK可抑制HepG2细胞的增殖、迁移和侵袭,与抑制ERK和Akt信号,负性调节EMT有关。
研究发现,肿瘤侵袭转移的关键是肿瘤细胞获得侵袭性,脱离原发灶形成游离细胞,而EMT在此过程中发挥了重要的作用。EMT现象被认为是影响肝癌细胞发生侵袭转移的机制之一。上皮细胞通过发生EMT,获得成纤维样细胞的特征,包括细胞形态改变、黏附减弱、细胞活性增强。通常当E-cadherin表达缺失,肿瘤细胞易脱离原发灶形成游离细胞,导致肿瘤细胞原位浸润性及迁移游走[12]。
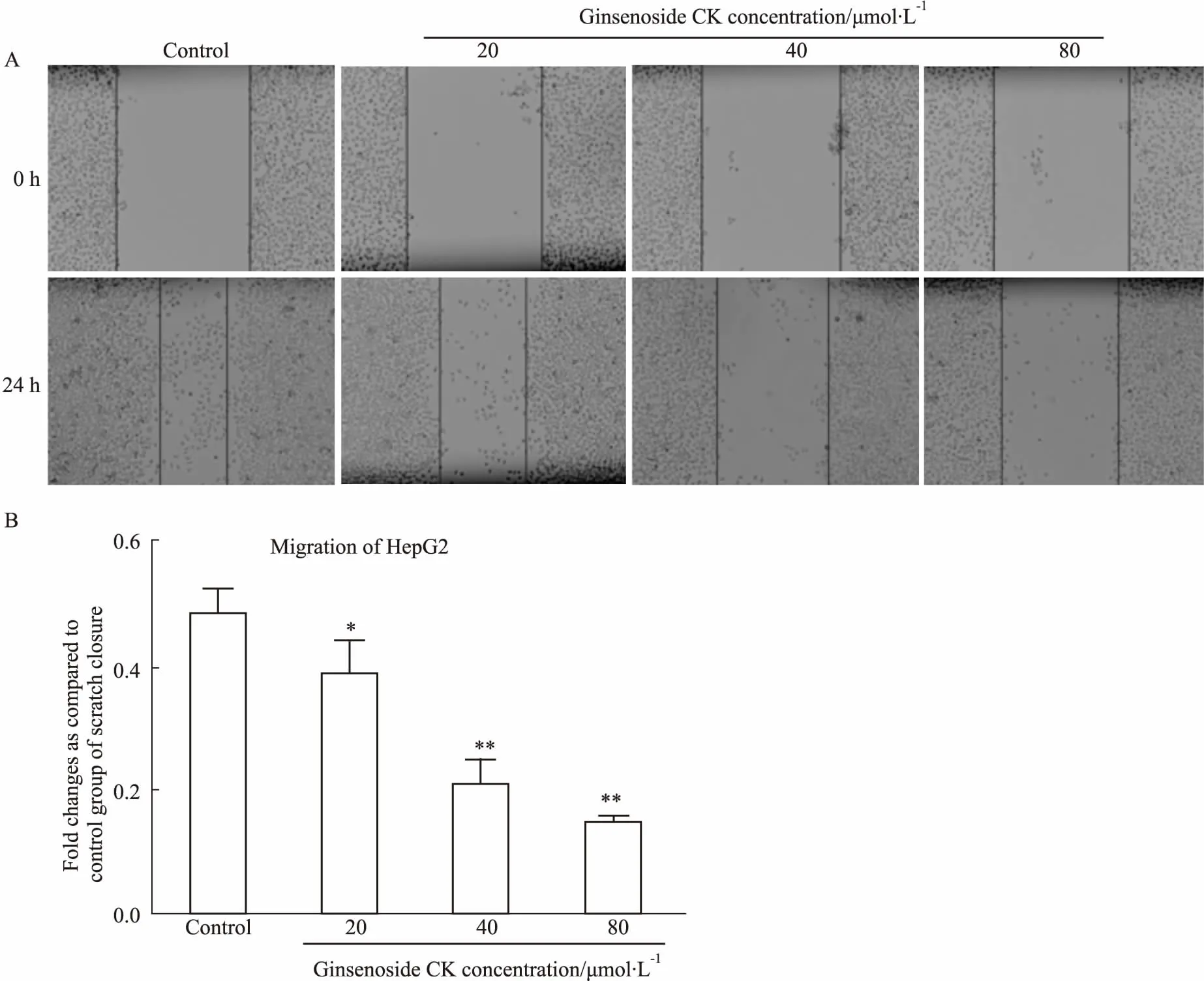
A: Cell wound healing assay was used to detect effect of ginsenoside CK on migration of HepG2 cells; B: Quantitative analysis showed the percentage wound closure relative to different groups using Adobe Photoshop Elements 6.0 software.*P<0.05,**P<0.01vscontrol group.
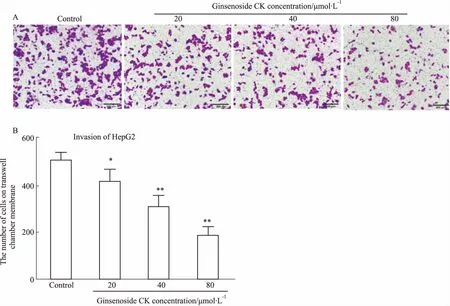
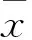
A: Cell transwell assay was applied to detect effect of ginsenoside CK on cell invasion of HepG2 cells; B: Quantitative analysis showed the number of cells on transwell chamber membrane.*P<0.05,**P<0.01vscontrol group.
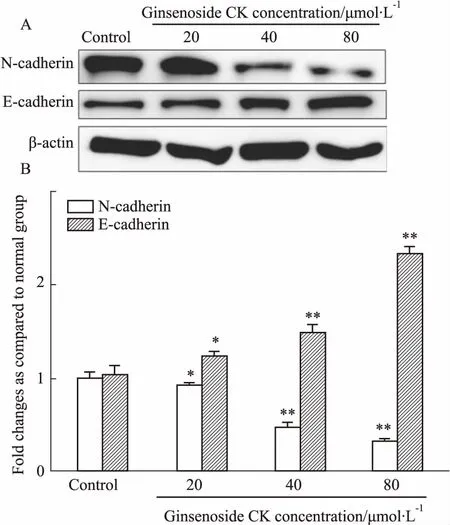
Fig 5 Effect of ginsenoside CK on marker of EMT(±s, n=3)
A: Western blot of N-cadherin and E-cadherin expression in HepG2 cultured with ginsenoside CK at the various concentrations; B: The semi-quantitative analysis of N-cadherin and E-cadherin expression in various groups. The band intensity of N-cadherin and E-cadherin was quantified by densitometry and normalized to β-actin.*P<0.05,**P<0.01vscontrol group.
N-cadherin在EMT过程中表达增加。与E-cadherin不同,在间质型细胞中,N-cadherin加强肿瘤细胞运动和转移的能力,并且其介导肿瘤细胞的侵袭作用可超过介导细胞间的黏附作用[13]。因此,EMT与恶性肿瘤的侵袭转移密切相关。相关研究表明,细胞发生EMT现象时,肿瘤细胞中E-cadherin表达降低,而N-cadherin、Vimentin表达升高。本研究发现,人参皂苷CK(20、40、80 μmol·L-1)抑制了HepG2细胞的迁移及侵袭能力;与对照组(0 μmol·L-1人参皂苷CK)相比,人参皂苷CK(20、40、80 μmol·L-1)作用的HepG2细胞中E-cadherin蛋白表达水平升高,N-cadherin蛋白表达水平下降。提示人参皂苷CK可能调控的人肝癌HepG2细胞的EMT进程。
目前,已知的诱导和调控EMT的因素很多,其信号调控是个十分复杂的网络。ERK1/2及PI3K/Akt是调控细胞增殖、分化、凋亡的重要通路,而这些通路的持续活化与HCC的发生发展密切相关[14-15]。相关实验表明,PI3K/Akt、ERK通路过度活化会促进HCC的EMT进程[16-17]。目前,尚不清楚人参皂苷CK是否能通过ERK、PI3K/Akt通路参与调控EMT进程。本实验通过检测人参皂苷CK不同浓度给药组ERK、Akt通路蛋白表达情况发现,人参皂苷CK能降低p-ERK/ERK和p-Akt/Akt的比值。由此推测,人参皂苷可能通过抑制ERK和Akt信号通路,负性调控肝癌细胞的EMT进程。
Fig 6 Effect of ginsenoside CK on expression of p-Akt and p-ERK proteins(±s, n=3)
A: Western blot of p-Akt and p-ERK expression in HepG2 cultured with ginsenoside CK at the various concentrations; B: The semi-quantitative analysis of p-Akt and p-ERK expression in various groups. The band intensity of p-Akt/Akt and p-ERK/ERK was quantified by densitometry.*P<0.05,**P<0.01vscontrol group.
综上所述,人参皂苷CK可抑制肝癌细胞的迁移和侵袭过程,可能与抑制ERK和Akt信号有关。这些初步研究为人参皂苷CK后期的开发利用提供了实验依据。
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J].CACancerJClin, 2016,66(2):115-32.
[2] Dutta R, Mahato R I. Recent advances in hepatocellular carcinoma therapy[J].PharmacolTher, 2017,173: 106-17.
[3] Nieto M A, Huang R Y, Jackson R A, et al. EMT: 2016 [J].Cell, 2016,166(1): 21-45.
[4] Giannelli G, Koudelkova P, Dituri F. Role of epithelial to mesenchymal transition in hepatocellular carcinoma[J].JHepatol,2016,65(4):798-808.
[5] 朱 磊,沈伟干,徐正新. 杨梅素对肝癌SMMC-7721细胞迁移及侵袭影响的研究[J]. 中国药理学通报,2017,33(6): 823-9.
[5] Zhu L, Shen W G, Xu Z X. Effect of myricetin on migration and invasion of hepatoma SMMXC-7721 cells[J].ChinPharmacolBull, 2017,33(6) : 823-9.
[6] Chen J, Wu H, Wang Q, et al. Ginsenoside metabolite compound K suppresses T-cell priming via modulation of dendritic cell trafficking and costimulatory signals, resulting in alleviation of collagen-induced arthritis[J].JPharmacolExpTher, 2015, 353(1):71-9.
[7] Lee S, Kwon M C, Jang J P, et al. The ginsenoside metabolite compound K inhibits growth, migration and stemness of glioblastoma cells[J].IntJOncol, 2017,51(2):414-24.
[8] 刘荣荣,张 璇,肖 斌, 等. 人参皂苷CK诱导人肝癌HepG-2细胞凋亡的研究[J]. 时珍国医国药,2016,27(4): 843-5.
[8] Liu R R, Zhang X, Xiao B, et al. Effect of ginsenoside CK on apoptosis of human hepatocellular carcinoma HepG-2 cells[J].LishizhenMedMaterMedRes, 2016,27(4): 843-5.
[9] Forner A, Llovet J M, Bruix J. Hepatocellular carcinoma[J].Lancet, 2012,379(9822):1245-55.
[10] Kang K A, Piao M J, Kim K C, et al. Compound K, a metabolite of ginseng saponin, inhibits colorectal cancer cell growth and induces apoptosis through inhibition of histone deacetylase activity[J].IntJOncol, 2013,43(6):1907-14.
[11] Kim H, Roh H S, Kim J E, et al. Compound K attenuates stromal cell-derived growth factor 1 (SDF-1)-induced migration of C6 glioma cells[J].NutrResPract, 2016,10(3):259-64.
[12] Giannelli G, Koudelkova P, Dituri F. Role of epithelial to mesenchymal transition in hepatocellular carcinoma[J].JHepatol, 2016,65(4):798-808.
[13] Sphyris N, Mani S A. pIgR: frenemy of inflammation, EMT, and HCC progression [J].JNatlCancerInst, 2011,103(22): 1644-5.
[14] Ding D, Huang H, Jiang W, et al. Reticulocalbin-2 enhances hepatocellular carcinoma proliferation via modulating the EGFR-ERK pathway [J].Oncogene, 2017 Jul 24. doi: 10.1038/onc.2017.230.[Epub ahead of print]
[15] Golob-Schwarzl N, Krassnig S, Toeglhofer A M, et al. New liver cancer biomarkers: PI3K/AKT/mTOR pathway members and eukaryotic translation initiation factors[J].EurJCancer, 2017,83:56-70.
[16] Fu H, He Y, Qi L, et al.cPLA2α activates PI3K/AKT and inhibits Smad2/3 during epithelial-mesenchymal transition of hepatocellular carcinoma cells[J].CancerLett, 2017,403:260-70.
[17] Ying H Y, Gong C J, Feng Y, et al. Serine protease inhibitor Kazal type 1 (SPINK1) downregulates E-cadherin and induces EMT of hepatoma cells to promote hepatocellular carcinoma metastasis via the MEK/ERK signaling pathway[J].JDigDis, 2017,18(6):349-58.
