1,8-二乙酰基大黄酸-(2-溴)-乙酯的合成及对骨肉瘤MG-63细胞的作用研究
2018-01-19粟正英李钊全何盈萱侯华新
田 炜,粟正英,蓝 富,李钊全,何盈萱,侯华新
(广西医科大学药学院,广西 南宁 530021)
骨肉瘤是骨恶性肿瘤中最多见的一种,其生长迅速、恶性程度高,目前仍是儿童和青少年恶性肿瘤死亡率很高的疾病。临床上对于骨肉瘤的治疗主要采取手术、放疗并辅以化疗的治疗方案,能够使部分患者病情得到有效控制,但仍有大部分患者因局部复发或转移而难以救治[1]。由于骨组织密度大、硬度高、渗透性差、生理生化过程复杂等原因,顺铂、阿霉素、环磷酰胺等传统的抗肿瘤药物很难到达患病部位[2-3]。因此,迫切需要研发疗效确切的新型抗肿瘤药物。大黄酸是传统中药大黄的主要有效成分之一,具有抗炎、抗菌、抗氧化和协同抗肿瘤等生物活性,且具有较强的趋骨性[4-5]。但其水溶性差、抗肿瘤作用弱等原因制约了其进一步应用。
本文以大黄酸为先导化合物,通过化学修饰在1,8位进行双乙酰化增强化合物的水溶性,并在3位通过直链烷烃为桥链引入卤素-Br以增强化合物的抗肿瘤活性。同时,以骨肉瘤细胞为研究对象,初步探讨合成产物对骨肉瘤MG-63细胞的作用机制,为设计和开发新型蒽醌类抗骨肉瘤药物提供一定的理论依据。
1 材料
1.1材料
1.1.1细胞株 MG-63细胞为人骨肉瘤细胞株,由广西医科大学医学科学实验中心提供。
1.1.2试剂 大黄酸购自南京郎泽生物医药,纯度>98%;甲醇(色谱纯,上海阿拉丁);噻唑蓝(MTT,北京Solarbio公司);RPMI 1640培养基、小牛血清(Gibco公司);胰酶(美国Amersco公司);凋亡检测试剂盒(美国BD公司);周期检测试剂盒(杭州联科公司);实验用水为二次蒸馏水;其余试剂均为市售分析纯。
1.1.3仪器 X-5显微熔点测定仪(北京和众视野科技公司);SPECTRUM 100傅立叶红外光谱仪(美国PerkinElmer公司);Bruker-500核磁共振仪(TMS为内标,德国Bruker公司);TU-1901紫外光谱仪(北京普析通用仪器公司);LC-15C岛津高效液相色谱仪(日本岛津公司);全波长酶标仪(美国Thermo);Calibur流式细胞仪(美国BD公司)。
2 方法
2.1合成方法目标化合物的合成路线见Fig 1。
2.1.11,8-二乙酰大黄酸的合成(A) 室温下将100 mg大黄酸溶于20 mL醋酐,0℃条件下缓慢滴加0.3 mL H2SO4,升温至30℃搅拌反应4~5 h。将反应液倒入4℃的纯水中,搅拌析出固体,抽滤,滤饼用纯水洗涤3次,无水乙醇重结晶,真空干燥得淡黄色针状晶体,110 mg,产率85%,mp: 245.8~247.3 ℃(文献值[6]:247~248℃)。
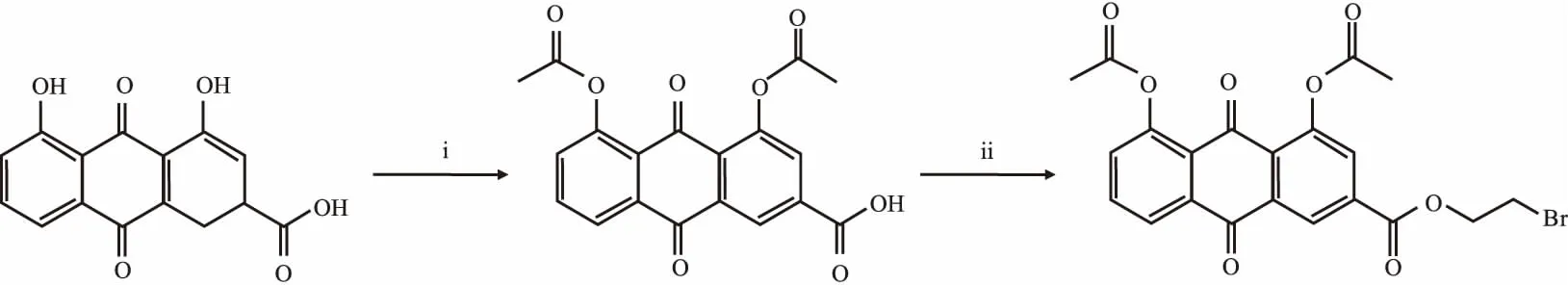
Fig 1 Synthesis of target compoundReagents and conditions: i) (AcO)2O, H2SO4, 0~30℃, 4~5 h; ii) DMF, 1,2-dibromoethane, K2CO3, 60℃, 2 h.
2.1.21,8-二乙酰基大黄酸-(2-溴)-乙酯的合成(B) 化合物A 100 mg溶于10 mL无水DMF中,加入200 mg无水碳酸钾,0.5 mL 1,2-二溴乙烷,60℃条件下搅拌反应,TLC监测反应(石油醚 ∶乙酸乙酯=4 ∶1)至原料点消失,约2 h,停止反应。过滤除去碳酸钾,反应液倒入50 mL二氯甲烷中,有机相用纯水(3×30 mL)洗涤,分液漏斗分液,无水Na2SO4干燥,减压除去溶剂得粗品。经硅胶柱层析(100~200目),石油醚 ∶乙酸乙酯=4 ∶1洗脱,二氯甲烷+石油醚重结晶得大黄酸衍生物B。
2.2高效液相色谱法测定化合物的纯度样品的配制:精密称取1.0 mg大黄酸和1.0 mg大黄酸衍生物B,用四氢呋喃溶解,定容至10 mL,过0.45 μm的滤膜,备用。
色谱条件:Sino Chrom ODS-BP 5μm色谱柱;柱长:150 mm;管径:4.6 mm;流动相 ∶甲醇-0.1%磷酸水(85 ∶15);流速:1.0 mL·min-1;柱温25 ℃;检测波长:260 nm,进样体积:10 μL。
样品测定:用流动相平衡色谱柱后,首先进样10 μL的纯四氢呋喃溶剂,在上述色谱条件下测定溶剂峰;然后分别进样大黄酸、大黄酸衍生物B、大黄酸和大黄酸衍生物B的混合物各10 μL,在上述相同色谱条件下测定。数据分析均在岛津LC-15 Solution系统中运行,扣除溶剂峰,再利用归一化法计算化合物纯度。
2.3化合物脂水分配系数LogP值计算本文采用Chemoffice2010(USA)软件中的Cambridge Soft Corporation模块,计算先导化合物大黄酸和合成产物大黄酸衍生物B的LogP值。
2.4MTT法测定化合物对细胞的生长抑制作用取对数生长期MG-63细胞,以5×107·L-1的密度接种于96孔培养板内,细胞贴壁24 h后,小心弃去原培养基,分别加入100 μL浓度为0、1、2、4、8、16、32、64、128、256 μmol·L-1的大黄酸和大黄酸衍生物B溶液,每个浓度设3个平行复孔,置37℃、5% CO2孵育箱中继续培养48 h,每孔加入5 g·L-1的MTT溶液20 μL,继续孵育4 h,小心弃去上清,每孔加入100 μL DMSO溶解,低速震荡10 min,在全自动酶标仪波长490 nm处测定各孔吸光度值(OD值),按下列公式计算细胞生长的抑制率。细胞生长抑制率/%=[1-(加药组OD值/空白组OD值)]×100%。
2.5流式细胞仪检测细胞凋亡取对数生长期MG-63细胞,以1×108·L-1的密度接种于6孔板中,细胞贴壁24 h后,小心弃去上清,分别加入0、40、80 μmol·L-1的大黄酸和大黄酸衍生物B溶液,每个浓度平行设置3孔。置37℃、5% CO2孵育箱中孵育48 h后,胰酶消化,收集细胞并用PBS漂洗2~3次,将细胞重悬于100 μL的Binding buffuer中,分别加入5 μL Annexin V-PE和5 μL 7-AAD,室温下避光孵育15 min,用流式细胞仪分析细胞的凋亡。每组实验平行测定3次。
2.6流式细胞仪测定细胞周期取对数生长期MG-63细胞,以1×108·L-1的密度接种于6孔板中,细胞贴壁24 h后,小心弃去上清,分别加入0、40 μmol·L-1的大黄酸和大黄酸衍生物B溶液,置37℃、5% CO2孵育箱中孵育48 h后,胰酶消化,收集细胞并用PBS漂洗2~3次。70%乙醇-20℃固定过夜,加入10 μL RNaseA、10 μL碘化丙啶(PI),室温下下避光孵育30 min。用流式细胞仪分析细胞周期的分布。每组实验平行测定3次。

3 结果
3.11,8-二乙酰基大黄酸-(2-溴)-乙酯的结构鉴定浅绿色针状晶体,85 mg,产率66%,纯度>98%(HPLC),mp:(191.8~192.3)℃。UV-vis (DMSO) λmax: 260, 341 nm;IR (KBr, cm-1):3096.91, 3034.64, 2977.46, 2948.39, 1779.50, 1765.63, 1717.90, 1675.80, 1667.71, 1593.88, 1448.31, 1420.53, 1366.55, 1333.60, 1275.54, 1255.51, 1238.62, 1216.26, 1189.84, 1098.12, 1024.28, 924.95, 898.18, 885.12, 800.14, 750.21, 702.51, 567.10, 504.32, 426.97.1H NMR (500 MHz, CDCl3) δ(ppm): 8.84 (d,J=1.2 Hz, 1H), 8.25 (d,J=7.7 Hz, 1H), 8.05 (d,J=1.2 Hz, 1H), 7.80 (t,J=7.9 Hz, 1H), 7.44 (d,J=7.9 Hz, 1H), 4.70 (t,J=6.1 Hz, 2H), 3.67 (t,J=6.1 Hz, 2H), 2.47 (s, 3H), 2.45 (s, 3H).13C NMR (126 MHz, CDCl3) δ(ppm): 181.09, 180.35, 169.29, 169.16, 163.47, 150.31, 150.18, 130.80, 130.55, 128.56, 126.44, 125.68, 125.60, 65.15, 28.12, 21.06, 21.01.
3.2化合物的纯度测定甲醇和(0.1%磷酸)水的比例为85:15的时候原料大黄酸与杂质的峰、大黄酸与目标化合物的峰都能依次分开,且出峰时间合适,分离度R>1.5,理论塔板数n>5 000,峰型对称,测得大黄酸和大黄酸衍生物B的纯度均高于98%。
3.3化合物的LogP值计算LogP为化合物在非水相中的平衡浓度与其在水相中的中性形式平衡浓度的比值的对数,LogP值越小,表示化合物的水溶性越强。大黄酸的LogP理论计算值为3.53,大黄酸衍生物B的LogP理论计算值为3.12,计算结果表明大黄酸衍生物B的水溶性优于大黄酸。
3.4化合物对细胞的生长抑制作用与空白对照组相比,在低浓度<8 μmol·L-1时,大黄酸对骨肉瘤MG-63细胞几乎没有抑制作用;大黄酸衍生物B有一定的抑制作用,抑制率在7.36%~14.14%。随着大黄酸和大黄酸衍生物B浓度的增加,骨肉瘤MG-63细胞的抑制率相应增大,且呈浓度依赖性;作用48 h的IC50分别为110.60、25.78 μmol·L-1,且相同浓度下的大黄酸衍生物B对骨肉瘤MG-63细胞的抑制作用明显强于大黄酸(Tab 1)。后续实验选择大于大黄酸衍生物B的IC50浓度进行。
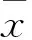
Tab 1 The inhibitory effect of rhein and rhein derivatives B on MG-63 cells (±s, n=3)
*P<0.05,**P<0.01vsrhein
3.5流式细胞仪检测细胞凋亡由Fig 2结果可知,大黄酸和大黄酸衍生物B均能诱导MG-63细胞凋亡。大黄酸和大黄酸衍生物B在40 μmol·L-1浓度时,诱导细胞的凋亡率分别是(5.00±1.06)%、(17.16±0.87)%;80 μmol·L-1浓度时,诱导细胞的凋亡率分别是(6.87±0.53)%、(48.84±2.20)%,说明大黄酸和大黄酸衍生物B诱导细胞凋亡有一定的浓度依赖性,并且相同浓度下的大黄酸衍生物B诱导MG-63细胞的凋亡率明显高于大黄酸(P<0.01)。
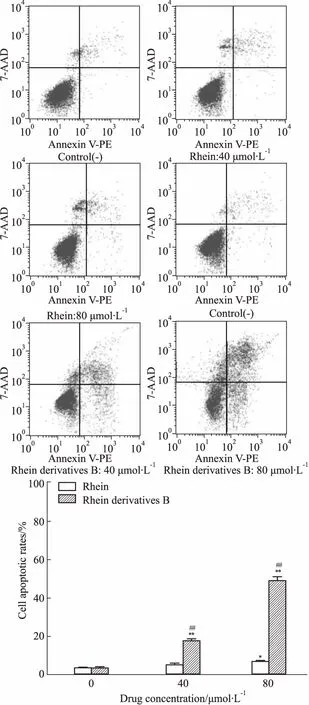
Fig 2 Effect of rhein and rhein derivatives B on apoptosis of MG-63 cells (±s, n=3)
FACS analysis showed annexin V-PE versus 7-AAD staining. The apoptotic rates of MG-63 cells treated with rhein and rhein derivatives B 48 h were detected.*P<0.05,**P<0.01vscontrol;##P<0.01vsrhein.
3.6流式细胞仪测定细胞周期如Fig 3所示,空白MG-63细胞的G1、G2和S期细胞数分别为(75.25±0.39)%、(11.96±0.29)%、(12.80±0.10)%;经40 μmol·L-1大黄酸在和大黄酸衍生物B处理后,G1、G2和S期细胞数分别为(70.38±0.57)%、(11.31±0.22)%、(18.32±0.40)%和(31.92±1.05)%、(8.40±0.79)%、(59.68±1.17)%。细胞周期结果表明,大黄酸和大黄酸衍生物B可使MG-63细胞的细胞周期停滞在S期,且相同浓度下大黄酸衍生物B对细胞S期的阻滞作用明显强于大黄酸(P<0.01)。
4 讨论
大黄酸是中药大黄的有效成分之一,具有协同抗肿瘤活性和良好的人体耐受力。其结构与四环素类似,具有较强的骨靶向性,能将药物相对特异地转运至骨组织[7],但其在抗肿瘤方面的应用受到水溶性差和生物活性低的制约。因此,针对其水溶性差,研究者们目前主要集中在大黄酸的1,8位同时进行酯化,以改善化合物的水溶性[8];其前体药物1,8-二乙酰基大黄酸(双醋瑞因,diacerein)作为治疗骨关节炎的药物,已经在意大利上市。研究发现,双醋瑞因可抑制关节软骨细胞和滑膜细胞的增殖,而无诱导细胞凋亡作用[9]。此外,大黄酸的蒽醌三环共平面结构可以嵌入到DNA的碱基对中,与DNA双螺旋结构可逆性的结合,从而导致DNA裂解和影响DNA的转录、合成,达到抗肿瘤的作用[10]。Yao 等[11]发现,通过侧链结构的修饰可以提高蒽醌类化合物对DNA的嵌入作用,在大黄酸的3位侧链上通过酰胺键引入芳环类α-氨基磷酸酯结构以增强大黄酸的抗肿瘤活性,当在芳环的邻位引入甲氧基时,得到1个体外抗肿瘤活性略优于5-氟尿嘧啶的化合物。Liang等[12]在大黄酸的3,4位引入噻唑类衍生物以提高大黄酸抗肿瘤活性,合成的系列大黄酸衍生物的体外抗肿瘤活性虽然有所提高,但化合物的水溶性明显降低,其所有衍生物的LogP理论计算值均高于大黄酸。
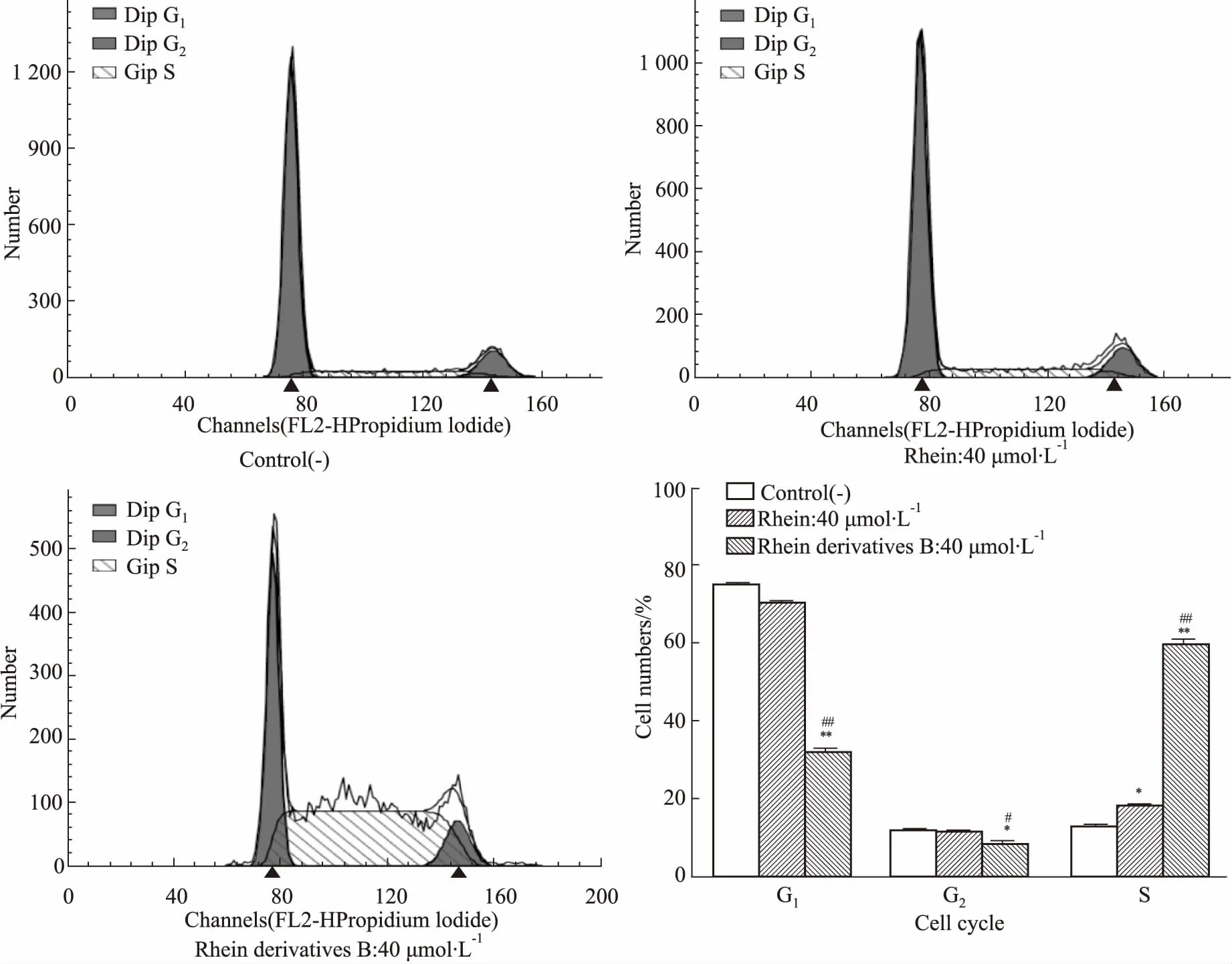
Fig 3 Distribution of cell cycle of each group (±s, n=3)
MG-63 cells treated with rhein and rhein derivatives B for 48 h were harvested for analysis of cell cycle distribution by flow cytometry.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsrhein.
本文设计合成的1,8-二乙酰基大黄酸-(2-溴)-乙酯(大黄酸衍生物B),在保留具有一定骨靶向性的大黄酸母核结构的同时,在1,8位通过乙酰化改善了化合物的水溶性,并在大黄酸的3位进行侧链修饰,增强了抗肿瘤活性。大黄酸衍生物B的LogP理论计算值低于大黄酸,说明大黄酸衍生物B的水溶性强于大黄酸;其次,由MTT结果可知,大黄酸衍生物B的体外抗肿瘤活性明显强于大黄酸。推测其作用机制可能是因为在大黄酸的3位侧链修饰,引入的卤素-Br增强了化合物与DNA的相互作用,从而提高化合物的抗肿瘤活性。
调控细胞周期和(或)诱导细胞凋亡已经成为目前治疗恶性肿瘤的一个重要策略。有文献报道,经大黄酸处理肝癌HepG2、BEL-7402细胞、人乳腺癌MCF-7细胞、人舌鳞癌SCC-4细胞后,可诱导细胞DNA损伤、线粒体跨膜电位的丧失、ATP产生减少,FOXO3a介导的Bim蛋白上调,抑制DNA修复相关基因O-6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)和周期素A、E的表达[13-15],将细胞阻滞在S期,最终诱导和促进细胞凋亡。本实验发现,大黄酸衍生物B可改变 MG-63细胞周期的分布,与对照组相比,G2/M期细胞的比例减少,S期细胞所占比例明显增高,细胞凋亡率明显提高。提示大黄酸衍生物B可使细胞周期阻滞于S期,阻断癌细胞由S期向G2/M期的进程,阻滞细胞的有丝分裂,通过抑制DNA的复制和转录,诱导细胞凋亡,达到抗肿瘤的效果。
(致谢:本文实验在广西医科大学药学院中心实验室和生命科学研究院完成,特此致谢。)
[1] Ma H, He C, Cheng Y, et al. PLK1shRNA and doxorubicin co-loaded thermosensitive PLGA-PEG-PLGA hydrogels for osteosarcoma treatment [J].Biomaterials, 2014,35(30): 8723-34.
[2] Mamo T, Mladek A C, Shogren K L, et al. Inhibiting DNA-PK CS radiosensitizes human osteosarcoma cells [J].BiochemBiophResCo, 2017,486(2): 307-13.
[3] Meyers P A, Schwartz C L, Krailo M, et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate [J].JClinOncol, 2005,23(9): 2004-11.
[4] 唐 敏, 李 鸿, 周国梅, 等. 大黄酸调控Rac1/LIMK1/cofilin信号通路抑制卵巢癌细胞运动与侵袭[J]. 中国药理学通报, 2016,32(3): 366-72.
[4] Tang M, Li H, Zhou G M, et al. Rhein inhibits the movement and invasion of human ovarian carcinoma cells through Rac1/LIMK1/cofilin signaling pathway [J].ChinPharmacolBull, 2016,32(3): 366-72.
[5] Sun H, Luo G, Chen D. A comprehensive and system review for the pharmacological mechanism of action of rhein, an active anthraquinone ingredient [J].FrontPharmacol, 2016,7: 1-16
[6] Gonnot V, Tisserand S, Nicolas M, et al. Total synthesis of rhein and diacerhein via a directed ortho metalation of an aromatic substrate [J].TetrahedronLett, 2007,48(40): 7117-9.
[7] Xu X, Qi X, Yan Y, et al. Synthesis and biological evaluation of rhein amides as inhibitors of osteoclast differentiation and bone resorption [J].EurJMedChem, 2016,123: 769-76.
[8] Cai J, Duan Y, Yu J, et al. Bone-targeting glycol and NSAIDS ester prodrugs of rhein: synthesis, hydroxyapatite affinity, stability, anti-inflammatory, ulcerogenicity index and pharmacokinetics studies [J].EurJMedChem, 2012,55: 409-19.
[9] Legendre F, Heuze A, Boukerrouche K, et al. Rhein, the metabolite of diacerhein, reduces the proliferation of osteoarthritic chondrocytes and synoviocytes without inducing apoptosis [J].ScandJRheumatol, 2009,38(2): 104-11.
[10] 潘智育, 李 竟, 陈云龙, 等. 8-溴乙氧基大黄酸的合成及其对肝癌HepG2.2.15细胞乙肝病毒抑制作用的研究[J]. 中国药理学通报, 2016,32(8):1175-80.
[10] Pan Z Y, Li J, Chen Y L, et al. Synthesis of 8-bromo-ethoxy Rhein and evaluation of its inhibition effect on hepatitis B virus in human hepatoma cells HepG2.2.15 [J].ChinPharmacolBull, 2016,32(8):1175-80.
[11] Yao G Y, Ye M Y, Huang R Z, et al. Synthesis and antitumor activities of novel rhein α-aminophosphonates conjugates [J].BioorgMedChemLett, 2014,24(2): 501-7.
[12] Liang Y K, Yue Z Z, Li J X, et al. Natural product-based design, synthesis and biological evaluation of anthra [2, 1-d] thiazole-6, 11-dione derivatives from rhein as novel antitumour agents [J].EurJMedChem, 2014,84: 505-15.
[13] Chen Y Y, Chiang S Y, Lin J G, et al. Emodin, aloe-emodin and rhein induced DNA damage and inhibited DNA repair gene expression in SCC-4 human tongue cancer cells [J].AnticancerRes, 2010,30(3): 945-51.
[14] Shi P, Huang Z, Chen G. Rhein induces apoptosis and cell cycle arrest in human hepatocellular carcinoma BEL-7402 cells [J].AmJChinMed, 2008,36(4): 805-13.
[15] Wang J, Liu S, Yin Y, et al. FOXO3-mediated up-regulation of Bim contributes to rhein-induced cancer cell apoptosis [J].Apoptosis, 2014,20(3): 399-409.
