高分辨率磁共振对大脑中动脉斑块与梗死灶类型关系的研究
2018-01-17徐曼曼徐运周飞张鑫张冰王一峰李敬伟
徐曼曼,徐运,周飞,张鑫,张冰,王一峰,李敬伟,
颅内动脉性疾病(intracranial arterial diseases,ICAD)是由颅内动脉粥样硬化(intracranial atherosclerosis,ICAS)、动脉夹层、烟雾病、血管炎等各种病因组成的一种疾病[1]。其中,ICAS是ICAD的主要病因,也是复发性卒中的高危因素,尤其是在近期发生过卒中或短暂性脑缺血发作(transient ischemic attack,TIA)及有严重动脉狭窄的患者中[2-3]。我国约有46.6%的急性缺血性卒中由ICAS所致[4],并且约3/4的卒中累及大脑中动脉(middle cerebral artery,MCA)。
以往的血管影像学检查,如数字减影血管造影(digital subtraction angiography,DSA)、计算机断层扫描血管成像(computed tomography angiography,CTA)和磁共振血管成像(magnetic resonance angiography,MRA)等多基于对血管狭窄程度的评估,而高分辨率磁共振成像(high-resolution magnetic resonance imaging,HRMRI)不仅可以显示血管狭窄程度,还能够提供管壁结构以及动脉粥样硬化斑块的生物学特性和动脉狭窄局部血管的重构模式[5]。该技术具有无创、分辨率高、可重复性好、多对比的特点。既往人们多关注MCA狭窄程度>50%的患者,认为此类患者发生脑梗死的风险更大,而忽略狭窄程度≤50%的患者,故本文旨在通过HRMRI检查,探讨因MCA狭窄程度≤50%引起缺血性卒中的梗死灶类型与载体动脉的关系及HRMRI在鉴别病变血管狭窄程度和卒中治疗、预防等方面的应用优势。
1 资料与方法
1.1 临床资料 纳入2012年1月-2016年10月在南京鼓楼医院连续住院的症状性MCA粥样硬化性狭窄的患者。入组标准:①症状性MCA狭窄患者,14 d内发生过脑梗死,且症状为病变血管所致,狭窄程度≤50%;②存在糖尿病、高血压、高脂血症、吸烟、饮酒等≥2个动脉粥样硬化的危险因素;③能够行HRMRI,扫描图像质量可;④耐受且规律服用抗血小板聚集及降脂类药物。排除标准:①心源性栓塞、血管炎、动脉夹层等其他原因导致的脑梗死患者;②合并颈动脉或椎动脉颅外段中、重度狭窄,MCA狭窄程度>50%;③具有严重的心、肺、肾等功能障碍不能耐受磁共振检查者;④体内有金属植入等有磁共振检查禁忌证者。所有患者采集的临床资料包括年龄、性别、高血压、糖尿病、吸烟史、高脂血症及C-反应蛋白。
1.2 影像学检查 所有患者均采用飞利浦3.0T磁共振(Achieva TX,荷兰飞利浦医疗系统公司)和标准8通道头颅线圈进行MRI检查。常规行头颅MRI平扫,扫描序列包括T1加权成像、T2加权成像和弥散加权成像(diffusionweighted imaging,DWI),并进行颅脑三维时间飞越法(three-dimensional time of flight,3D-TOF)磁共振血管造影(magnetic resonance angiography,MRA)检查,然后在病变处垂直血管行HRMRI,扫描序列包括非对比血管成像、脂肪抑制及黑血信号成像技术等,扫描范围包括正常血管及狭窄段血管(表1)。
1.3 图像分析 扫描完成后将图像导入医学影像信息系统(picture archiving and communication systems,PACS),由2名专门从事血管影像诊断的影像科医师在不了解患者临床资料的情况下进行图像分析。将图像质量分为4级:1级:管壁及管腔显示不清;2级:管腔清晰,斑块显示不清;3级:管腔、管壁及斑块显示清晰,但有少量运动伪影;4级:斑块结构清晰,无运动伪影[6]。根据华法林-阿司匹林症状性颅内疾病试验(Warfarin–Aspirin Symptomatic Intracranial Disease,WASID)标准计算狭窄率[7]。在矢状位HRMRI上,手动勾画测量病灶侧MCA M1段最狭窄层面的管腔直径,以病灶侧或对侧正常血管层面作为参照点,测量参照管腔直径和参照管壁直径(若参照点在同侧,则以狭窄点前后的正常血管层面平均值作为参照直径)。计算狭窄率=(1-管腔直径/参照管腔直径)×100%。通过计算血管重构指数(remodeling index,RI)判断MCA血管的重构方式,RI=最狭窄管腔直径/参考管腔直径。RI≤0.95为负性重构(negative remodeling,NR),RI≥1.05为正性重构(positive remodeling,PR),介于0.95~1.05称之为无重构[8]。斑块形态学指标包括斑块位置、长度、厚度。根据矢状位HRMRI,MCA斑块位置可根据斑块最厚点的方向,将之分为上、下、前、后壁4个象限,当斑块分布在2个或多个象限之间,以斑块最厚处所在的象限划分(图1)[9]。斑块厚度为MCA最狭窄层面的斑块厚度,斑块长度根据斑块累及的HRMRI层数乘以层厚计算[10]。

表1 高分辨率磁共振成像序列及其主要参数
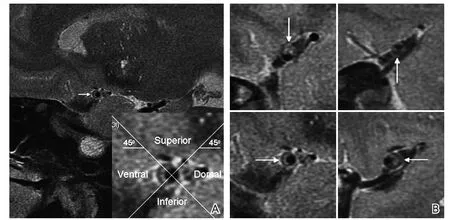
图1 斑块位置分布
1.4 脑梗死类型的分类与分组 根据DWI所显示的梗死病灶部位、大小和分布,按血管供血区域,将脑梗死部位分型如下:①单型梗死:穿支动脉供血区梗死(perforating artery infarct,PAI),皮质支供血区梗死(pial infarct,PI),分水岭梗死(border zone infarct,BZI);②混合型梗死:PAI+PI,PAI+BZI,PI+BZI,PAI+PI+BZI。单型梗死为梗死仅累及1个MCA供血区,混合型梗死为累及1个以上的MCA供血分区[11]。由两位神经内科医师独立阅读患者的DWI图像并确定脑梗死模式,如有阅片结果不一致,由第三位医师介入并讨论后确定。
1.5 统计学分析 应用SPSS 23.0软件进行统计学分析,计数资料用χ2检验或Fisher's精确法进行统计学分析,计量资料以表示并行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入患者51例,其中男34例(66.7%),女17例(33.3%),平均年龄(57.73±13.31)岁。单型梗死组32例,混合型梗死组19例。两组患者性别、年龄、伴随疾病和血液指标比较,差异均无统计学意义(表2)。
2.2 MCA管腔(狭窄程度+重构)与脑梗死灶 通过HRMRI管壁成像技术,发现混合型组的MCA狭窄程度[(38.0±8)%]明显高于单型组[(31.0±10)%],比较差异有统计学意义(t=2.56,P=0.01)。单型组中PAI 22例(68.8%),PI 6例(18.7%),BZI 4例(12.5%),以PAI最多见(图2);其中PAI的斑块位置:前壁8例(36.4%),后壁7例(31.8%),上壁1例(4.5%),下壁6例(27.3%);正性重构22例(68.8%),负性重构3例(9.4%)。混合型组中PAI+BZI 7例(36.8%),PAI+PI 2例(10.6%),PI+BZI 5例(26.3%),PAI+PI+BZI 5例(26.3%),以PAI+BZI为主(表3、图3);正性重构17例(89.5%),无负性重构。
2.3 MCA动脉粥样硬化斑块与脑梗死灶 不同类型梗死灶的斑块形态特征不同。单型梗死组较混合型梗死组斑块厚度小,差异有统计学意义(P=0.001);而斑块长度比较,差异无统计学意义(表3)。
3 讨论
动脉粥样硬化性MCA狭窄引起脑梗死的病理生理机制主要包括病变部位的斑块阻塞穿支动脉开口处、血栓形成、动脉-动脉栓塞、低灌注-栓子清除能力下降等[12]。随着影像学技术的不断发展,尤其是HRMRI的临床应用,进一步加深了医学研究者对颅内动脉病变的认识。与传统MR/CTA相比,HRMRI具有几个优点,首先它可以直视化观察亚毫米级动脉壁,其次FSE-T2WI序列在高分辨率参数下保持了高信噪比和较短的成像时间[13],使其在颅内动脉粥样硬化疾病诊断中的应用愈加广泛。但目前,该检查方法应用于MCA狭窄程度≤50%的研究不多。
3.1 基线比较 卒中的危险因素可分为不可调节和可调节因素两大类[14]。不可调节因素主要指年龄、性别及种族等,可调节因素包括高血压、糖尿病、高脂血症、吸烟等。本研究中,两组患者的一般临床资料比较,年龄、性别、高血压、糖尿病、高脂血症、吸烟等差异均无统计学意义,两组基线水平大致相同,具有可比性。
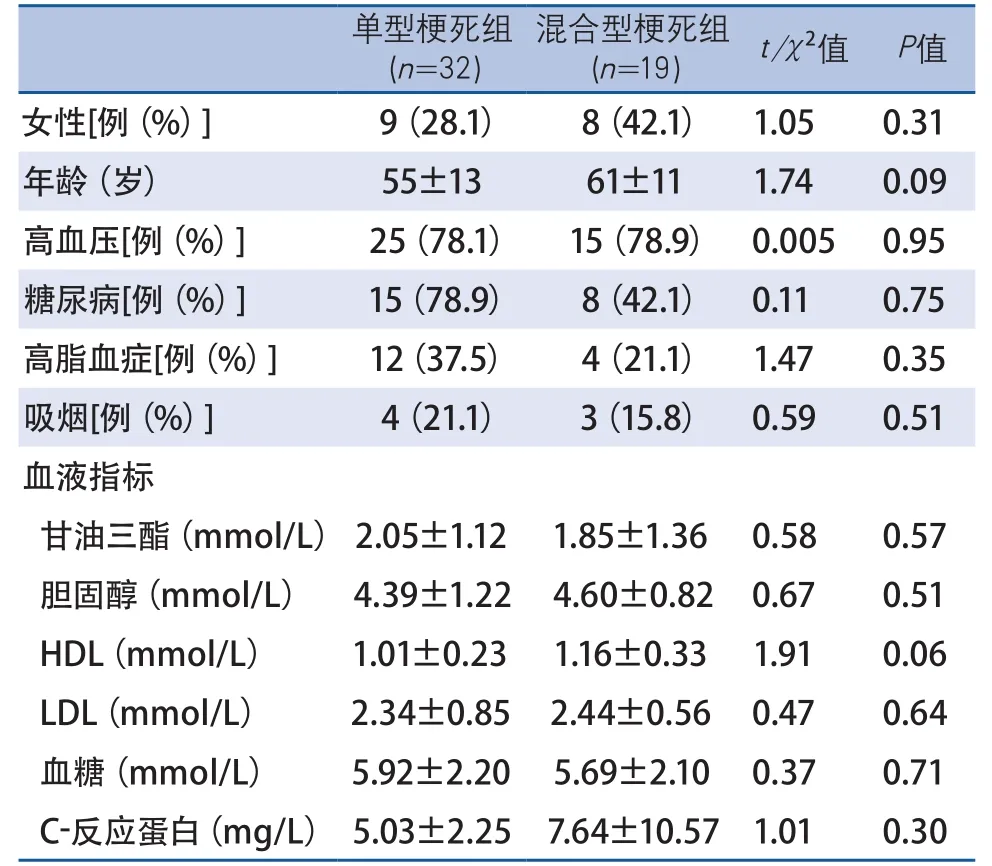
表2 两组患者一般资料基线水平比较

图2 单型梗死左侧MCA狭窄患者图像
3.2 HRMRI对MCA管腔(狭窄程度+重构)与脑梗死模式 由于动脉粥样硬化早期血管外膨性生长,即正性重构效应,在常规影像学检查中并不表现为狭窄,也不能全面、客观地确定病变血管的狭窄程度。而HRMRI管壁成像技术能直视病变管腔部位,并准确测量狭窄程度。
当前,血管狭窄程度仍是判断动脉粥样硬化病变的主要指标。WANG等[4]分析了来自多中心2864例国内ICAS患者的临床资料,结果显示动脉狭窄程度与卒中复发相关,狭窄程度越重越易造成卒中复发。MCA狭窄患者的DWI模式表现为多种脑梗死类型。有研究报道,MCA中度狭窄主要导致PAI,而PI较少见[11]。本研究发现混合型梗死组的MCA狭窄程度较单型组重,且单型梗死组中多数为PAI(68.8%),与文献报道相符。MCA粥样硬化性狭窄引起PAI,可能是斑块或小栓子阻塞穿支动脉开口所致[15]。随着狭窄程度的增加,MCA狭窄致PAI的同时,也会合并其他部位的梗死。因MCA狭窄后,其远端分支血管血流主要依靠同侧的大脑前、后动脉代偿,造成分支血管内血流紊乱,流速缓慢,供血区的血流储备降低,易促使血栓形成[16],引发BZI和PI。本研究中混合型梗死主要为PAI+BZI类型。由于本研究的对象为MCA狭窄程度≤50%的患者,故可能与前期研究结果稍有所不同。血管重构是狭窄血管自身的代偿选择,包含正性重构(positive remodeling,PR)、负性重构(negative remodeling,NR)两种方式。冠脉的研究证实PR有利于维持动脉管腔大小,但却表现为易损斑块的特性;虽然NR加重管腔狭窄,但多为稳定斑块[17]。此外,SCHOENHAGEN等[18]研究显示PR与缺血性症状密切相关。随后MCA的研究也发现类似特性。XU等[17]表明与无症状MCA狭窄相比,症状性MCA狭窄患者PR率更高。另一项关于基底动脉粥样硬化狭窄程度≥70%的研究发现,与非PR相比,PR更常见,并且斑块负荷更大[8]。血管重构的发生机制尚未完全清楚,可能管壁的PR与动脉粥样硬化斑块释放的金属蛋白酶有关[19],存在PR的病变动脉局部金属蛋白酶释放增加,导致斑块稳定性下降、斑块破溃和栓子形成,致使远端分支动脉栓塞形成脑梗死[20]。这也为卒中患者的二级预防及治疗提供方向。

表3 两组病变血管情况比较
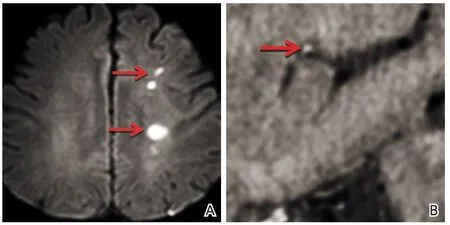
图3 混合型梗死左侧MCA狭窄患者图像
3.3 HRMRI对MCA动脉粥样硬化斑块特征与脑梗死模式评价 在管腔狭窄程度<50%的情况下,颈内动脉的HRMRI研究确定了增加血栓栓塞事件风险斑块的特征,包括斑块内出血、大的脂质核、薄的纤维帽等[21-22]。颅内动脉斑块负荷被揭示是发生卒中的危险因素,有研究提示与无症状性MCA狭窄相比,症状性狭窄的斑块更厚,斑块厚度与管腔之比更大[13,17]。本研究通过HRMRI比较两组患者的MCA斑块形态特征,发现除管腔狭窄程度外,混合型组斑块的一些高危特征。
在本研究中,混合型组的斑块厚度>单型组。XU等[17]揭示较大的斑块负荷不仅造成管腔狭窄影响血流动力学,而且还可能在粥样斑块的基础上发生继发病变,如斑块内出血、斑块破裂等。所以本课题推测混合型梗死可能由于斑块的局部血栓阻塞穿支动脉开口或血栓脱落阻塞远端血管,引起多个部位的梗死。此外,斑块位置分布被认为是动脉粥样硬化性卒中的另一因素。XU等[9]发现,MCA的斑块更常见于管壁的前壁和下壁,即穿支血管开口的对侧;但在症状性MCA狭窄患者中,穿支梗死血管粥样斑块更多分布于上壁(P=0.001)。本研究中穿支动脉梗死的斑块多位于前壁(36.4%),与之前的研究不同,推测可能是由于本课题研究对象为MCA轻型狭窄的患者(≤50%),另一原因可能是本课题在确定斑块位置时是根据斑块最厚点的方向来统计的,在未引起症状性卒中前,斑块已在前壁形成,随着斑块逐渐扩增,阻塞穿支动脉口,导致脑梗死。由于本研究纳入的样本例数少,未发现两组斑块分布及斑块长度存在统计学差异。故早期识别动脉粥样硬化斑块,判断管腔狭窄程度,从而为卒中的病因诊断及临床治疗提供客观依据,有助于进行针对性卒中二级预防。本研究不足之处为单中心、小样本的回顾性研究,受到研究对象的MCA狭窄率≤50%的限制,且患者病情相对较轻,故纳入患者的选择上存在一定的偏倚,尚需大样本临床研究来一步证实。
本研究发现不同程度的MCA狭窄(狭窄程度≤50%),其梗死灶分布有所不同,单型梗死主要为PAI,混合型梗死主要以PAI+BZI多见;混合型梗死组的狭窄程度较单型组严重,斑块厚度高于单型组,提示斑块阻塞穿支动脉口或小栓子栓塞远端分支可能是单型梗死的机制,而血流动力学紊乱可能是混合型梗死的机制。本研究为小样本研究,结论只适用于该群体患者。
[1] SWARTZ R H,BHUTA S S,FARB R I,et al.Intracranial arterial wall imaging using high-resolution 3-tesla contrast-enhanced MRI[J]. Neurology,2009,72(7):627-634.
[2] ARENILLAS J F. Intracranial atherosclerosis:current concepts[J/OL]. Stroke,2011,42(1 Suppl):S20-S23. DOI: 10.1161/STROKEAHA.110.597278.http://stroke.ahajournals.org/content/42/1_suppl_1/S20.
[3] KASNER S E,CHIMOWITZ M I,LYNN M J,et al. Predictors of ischemic stroke in the territory of a symptomatic intracranial arterial stenosis[J].Circulation,2006,113(4):555-563.
[4] WANG Y,ZHAO X,LIU L,et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China:the Chinese Intracranial Atherosclerosis(CICAS)Study[J]. Stroke,2014,45(3):663-669.
[5] KIM Y S,LIM S H,OH K W,et al. The advantage of high-resolution MRI in evaluating basilar plaques:a comparison study with MRA[J]. Atherosclerosis,2012,224(2):411-416.
[6] UNDERHILL H R,YARNYKH V L,HATSUKAMI T S,et al. Carotid plaque morphology and composition:initial comparison between 1. 5-and 3. 0-T magnetic fi eld strengths[J]. Radiology,2008,248(2):550-560.
[7] YANG W Q,HUANG B,LIU X T,et al.Reproducibility of high-resolution MRI for the middle cerebral artery plaque at 3T[J/OL]. Eur J Radiol,2014,83(1):e49-e55. DOI: 10.1016/j.ejrad.2013.10.003.http://dx.doi.org/10.1016/j.ejrad.2013.10.003.
[8] MA N,JIANG W J,LOU X,et al. Arterial remodeling of advanced basilar atherosclerosis:a 3-tesla MRI study[J]. Neurology,2010,75(3):253-258.
[9] XU W H,LI M L,GAO S,et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J]. Stroke,2011,42(10):2957-2959.
[10] LI M L,XU W H,SONG L,et al. Atherosclerosis of middle cerebral artery:evaluation with highresolution MR imaging at 3T[J]. Atherosclerosis,2009,204(2):447-452.
[11] LEE D K,KIM J S,KWON S U,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusionweighted imaging study[J]. Stroke,2005,36(12):2583-2588.
[12] ISAKA Y,NAGANO K,NARITA M,et al. High signal intensity on T2-weighted magnetic resonance imaging and cerebral hemodynamic reserve in carotid occlusive disease[J]. Stroke,1997,28(2):354-357.
[13] CHUNG G H,KWAK H S,HWANG S B,et al. High resolution MR imaging in patients with symptomatic middle cerebral artery stenosis[J]. Eur J Radiol,2012,81(12):4069-4074.
[14] SACCO R L,BENJAMIN E J,BRODERICK J P,et al. American Heart Association Prevention Conference. Ⅳ. Prevention and Rehabilitation of Stroke. Risk factors[J]. Stroke,1997,28(7):1507-1517.
[15] BANG O Y,HEO J H,KIM J Y,et al. Middle cerebral artery stenosis is a major clinical determinant in striatocapsular small,deep infarction[J]. Arch Neurol,2002,59(2):259-263.
[16] YONG S W,BANG O Y,LEE P H,et al. Internal and cortical border-zone infarction:clinical and diffusion-weighted imaging features[J]. Stroke,2006,37(3):841-846.
[17] XU W H,LI M L,GAO S,et al. In vivo highresolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J]. Atherosclerosis,2010,212(2):507-511.
[18] SCHOENHAGEN P,ZIADA K M,KAPADIA S R,et al. Extent and direction of arterial remodeling in stable versus unstable coronary syndromes:an intravascular ultrasound study[J]. Circulation,2000,101(6):598-603.
[19] ZHU X J,DU B,LOU X,et al. Morphologic characteristics of atherosclerotic middle cerebral arteries on 3T high-resolution MRI[J]. AJNR Am J Neuroradiol,2013,34(9):1717-1722.
[20] 李文君,刘俊艳. 不同机制症状性颅内动脉粥样硬化性疾病的高分辨率磁共振特征[J]. 中国卒中杂志,2016,11(4):262-268.
[21] WASSERMAN B A,WITYK R J,TROUT H H 3RD,et al. Low-grade carotid stenosis:looking beyond the lumen with MRI[J]. Stroke,2005,36(11):2504-2513.
[22] YUAN C,MITSUMORI L M,BEACH K W,et al. Carotid atherosclerotic plaque:noninvasive MR characterization and identif i cation of vulnerable lesions[J]. Radiology,2001,221(2):285-299.
