食品中绿豆成分PCR特异性检测方法的建立
2018-01-10赵仲麟李瑞歌秦志扬兰青阔
赵仲麟,李瑞歌,秦志扬,王 成,王 永,袁 超, 兰青阔
(1.河南农业大学理学院, 河南 郑州 450002; 2. 天津市农业质量标准与检测技术研究所,天津 300381)
食品中绿豆成分PCR特异性检测方法的建立
赵仲麟1,李瑞歌1,秦志扬1,王 成2,王 永2,袁 超1, 兰青阔2
(1.河南农业大学理学院, 河南 郑州 450002; 2. 天津市农业质量标准与检测技术研究所,天津 300381)
针对绿豆物种特异性序列,设计了定性PCR引物,建立了绿豆源性成分检测方法,并对0.2、0.4、0.6、0.8、1.0 μmol·L-1的引物浓度,52、54、56、58、60、62 ℃的退火温度等反应条件进行优化,对该方法的灵敏度、特异性和检出限进行了测试。结果表明,在引物浓度0.4 μmol·L-1、退火温度58 ℃条件下的扩增效果最优,绿豆的检出限可达到0.5 %。该检测方法具有高度的特异性,操作方便、简单、快捷,可为食品安全的检测提供依据。
食品; 绿豆成分;凝胶电泳;PCR;特异性检测
目前,食品掺假问题是中国食品质量管理面临的重大挑战之一[1]。假冒伪劣食品严重威胁人们的身体健康。人们在担忧污染物对健康造成威胁的同时,食品掺假问题同样引起人们的重视。以绿豆食品为例,一些企业为获取高额利润,常利用豌豆、大豆等其他原材料充当绿豆食品出售,违反了消费者的合法权益[2]。中国政府也已加大对食品行业的监管力度,同时制定更严苛的检测标准,以期重拾消费者对政府和企业的信心。食品成分检测的方法主要有:(1)依靠形态学鉴别手段的传统感官或物理方法鉴别,如电子舌和电子鼻技术的应用[3-4];(2)基于仪器的检测方法,如核磁共振波谱技术[5]、近红外光谱技术[6]、液质联用[7]等方法;(3)蛋白质大分子检测方法,如利用双抗体夹心ELISA法检测食品中花生过敏原蛋白成分[8];(4)DNA分子检测方法,常用有聚合酶链式反应[9]、指纹图谱技术[10]及基因芯片技术[11]。PCR方法具有特异性强,灵敏度高等特点,已经普遍用于农产品、食品的检测分析中。目前,国内还没有针对绿豆制品的检测分析标准。本研究采用的特异性PCR检测手段,对食品中的绿豆成分进行检测,以期为绿豆成分检测的相关标准的制定提供依据。
1 材料与方法
1.1 引物设计及筛选
收集、分析和验证绿豆mgQ062FRFLP序列,获得绿豆物种特异性序列。根据该特异性序列,设计定性PCR引物;在通用的PCR扩增程序和反应体系条件下,比较不同引物扩增条带的特异性、亮度等,选择表现相对好的引物对作为候选引物对。
1.2 PCR反应退火温度和引物浓度优化
本试验设置引物浓度优化范围为0.2、0.4、0.6、0.8、1.0 μmol·L-1,退火温度优化范围 52、54、56、58、60、62 ℃,根据扩增条带的亮度、引物二聚体等表现,确定合适的引物浓度和扩增退火温度。DNA模板为50 mg·L-1(10%绿豆,基质为小麦粉),本试验使用Taq DNA聚合酶、PCR缓冲液、dNTPs、MgCl2购自Promega公司的,引物由金唯智公司合成。
1.3 绿豆检测方法特异性和检出限测试
选用不同豆类作物及常见的农作物共28种进行特异性测试,验收标准是仅在绿豆中获得预期的扩增产物。28种测试样品为:(1)空白对照:水;(2)绿豆;(3)豌豆;(4)红豆;(5)黄豆;(6)蚕豆;(7)长奶花豆;(8)花豆;(9)菜豆;(10)熊猫豆;(11)雀蛋豆;(12)大花黑芸豆;(13)小白豆;(14)紫罗兰豆;(15)大白豆;(16)竹花豆;(17)长熊豆;(18)扁豆;(19)青豆;(20)黑豆;(21)大黑豆;(22)豇豆;(23)玉米;(24)水稻;(25)小麦;(26)白芝麻;(27)黑芝麻;(28)花生。
检出限LOD一般是指不低于95%的检出情况下的绿豆含量,严格的测试试验是在60次平行试验中至少检出59次阳性。
2 结果与分析
2.1 引物筛选
检索、搜集到文献中提供的绿豆普通PCR定性检测方法[12],经分析和验证获得绿豆物种特异性序列mgQ062FRFLP。根据该特异性序列信息,应用primer 3.0在线软件(http://primer3.ut.ee/)设计绿豆源性成分定性PCR引物。PCR引物序列信息详见表1,预期目的片段长度为470 bp和425 bp。
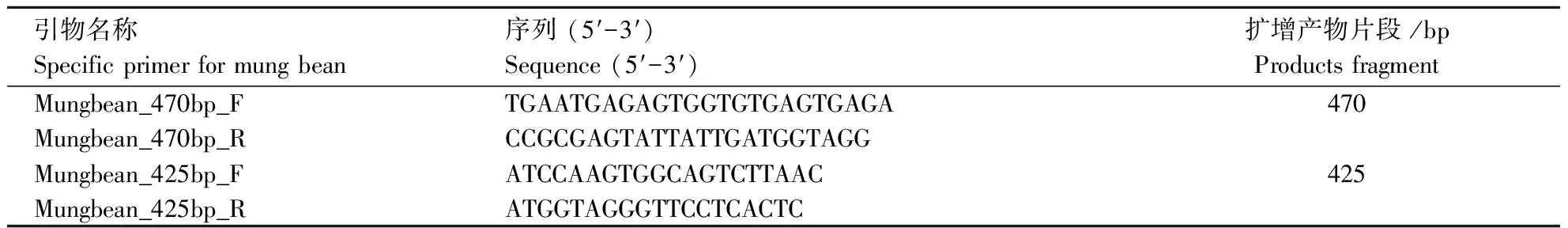
表 1 绿豆源性成分特异性引物序列信息Table 1 Specific primer sequences for mung bean
使用CTAB法提取绿豆等基因组DNA[12],应用通用的PCR反应条件(DNA模板50 ng),对2对引物进行特异性测试。从图1可以看出,目的条带长度为470 bp的引物未出现非特异性扩增,而由图2可知,目的条带长度为425 bp的引物对豌豆、豇豆均出现扩增条带。因此,选择Mungbean_470 bp_F/R引物进行后续的优化分析。
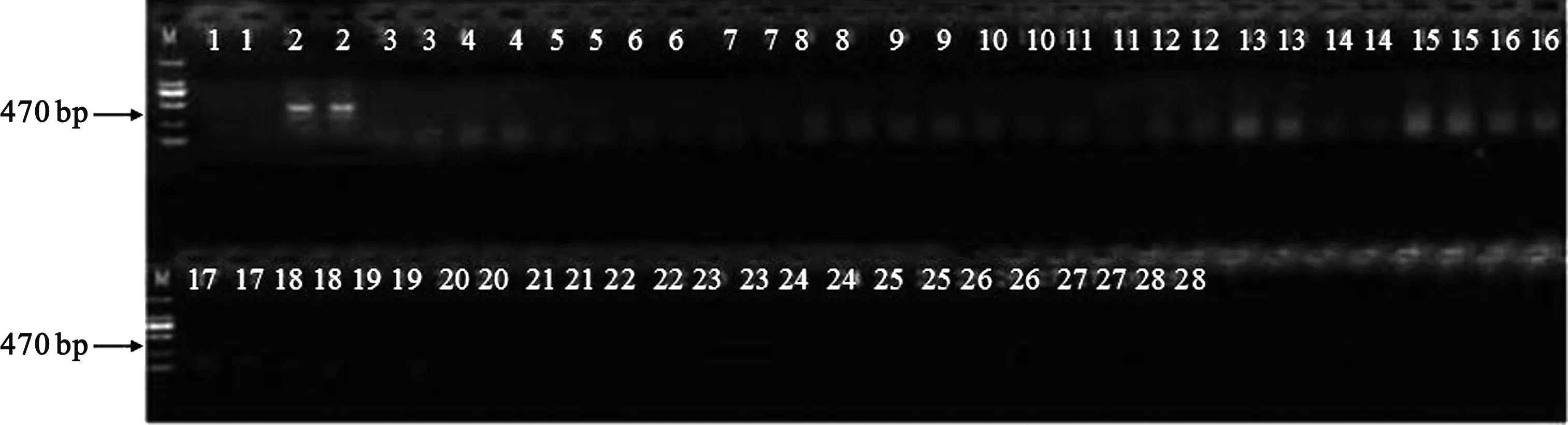
图1 Mungbean_470 bp_F/R引物特异性测试扩增结果Fig.1 Amplification results of Mungbean_470 bp_F/R
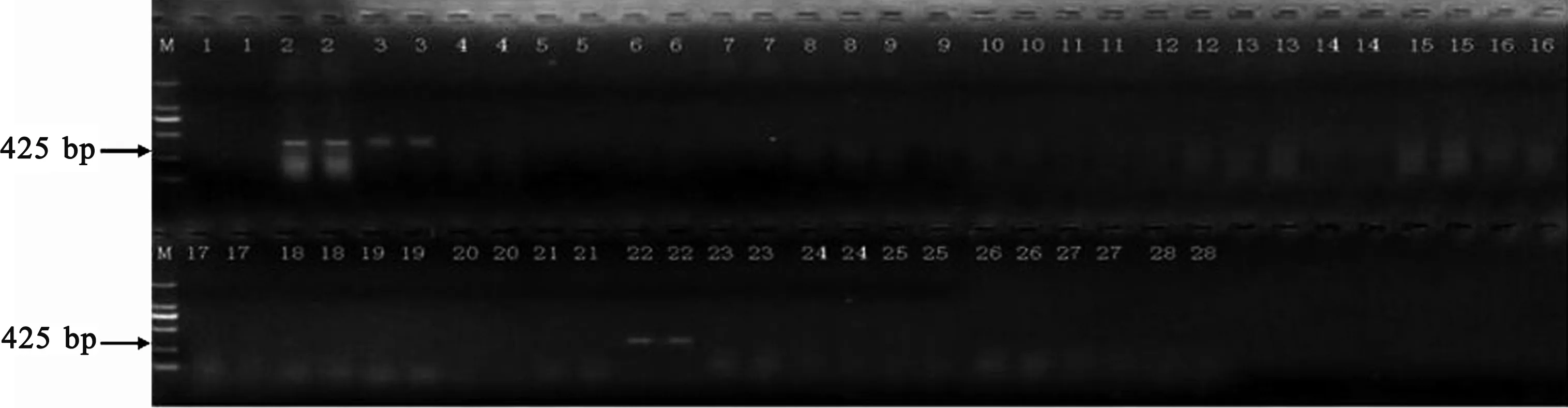
图2 Mungbean_425 bp_F/R引物特异性测试扩增结果Fig.2 Amplification results of Mungbean_425 bp_F/R
2.2 PCR检测体系参数的确立
调整、优化PCR反应程序,优化退火温度和引物浓度。结果表明(图3),Mungbean_470 bp_F/R引物在58 ℃退火温度、0.4 μmol·L-1引物浓度下的扩增效果最优。最终确定扩增反应体为系25 μL: DNA模板(50 mg·L-1)1.0 μL,10×PCR缓冲液2.5 μL,dNTPs(2.5 mmol·L-1)2 μL,Taq DNA聚合酶0.25 μL,上下游引物(10 μmol·L-1)各1 μL,MgCl2(25 mmol·L-1)1.5 μL。PCR扩增程序为:95 ℃预变性5 min,35 个循环(95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s),72 ℃延伸7 min,8 ℃保存。

图3 PCR体系优化结果Fig.3 PCR optimization results
2.3 灵敏度检测
为了进一步测试建立的绿豆源性成分定性PCR检测方法的灵敏度,设置8个不同质量分数(绿豆/小麦粉)的样品,分别为100%、10%、1%、0.5%、0.1%、0.05%、0.01%和0%,每组重复3次。结果表明,在PCR检测反应体系中加入50 ng DNA模板时,质量分数0.5 %及以上的样品扩增条带明显(图4)。

图4 方法灵敏度检测结果Fig.4 Sensitivity test results
2.4 检出限检测
称取了60份绿豆质量分数为0.5%的样品,提取基因组DNA,进行PCR扩增。结果如图5所示,60份试样中均能稳定检测出470 bp的预期DNA片段。上述结果表明,在该PCR检测体系检出限可达到0.5 %。

图5 检出限检测结果Fig.5 Detection limit detection results
2.5 市售绿豆糕中绿豆源性成分定性检测
称取市售绿豆糕样品200 mg,放入微量离心管中,通过CTAB方法[12]提取得到DNA,溶于100 mL TE溶液中,进行PCR扩增。以去离子水作为空白对照,产物经2.0%琼脂糖凝胶电泳判定结果。结果表明,在与对照绿豆凝胶电泳图谱相应的位置上,绿豆在470 bp处有1条DNA条带,空白对照(CK)无条带,说明样品中含绿豆成分(图6)。空白对照和市售绿豆糕样品各2个重复。
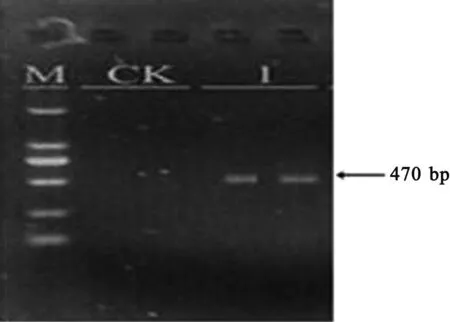
M: DNA Marker; CK:空白;1:绿豆糕样品。 M:DNA Marker; CK:Control;1:Bean cake samples.
3 结论
本文探索设计了一种基于定性PCR的绿豆成分检测方法。根据绿豆基因组特异性序列,设计PCR引物,并且对PCR反应退火温度、引物浓度等反应体系进行优化。结果表明,使用Mungbean_470 bp_F/R引物、在58 ℃退火温度、0.4 μmol·L-1引物食品加工品成分检测具有良好的可操作性,检出限可达到0.5%。本方法属于定性检测方法,对于产品中是否添加豇豆、大豆等成分,亦可以采用对应的引物对这些豆类进行检测。采用PCR检测法检测绿豆成分,技术成熟、操作简单。
[1] 杨杰,高洁,苗虹.论食品欺诈和食品掺假[J]. 食品与发酵工业,2015,41(12):235-240.
[2] 张晓娜. 转基因大豆MON87705及其产品的检测技术研究[D]. 济南:山东师范大学,2015.
[3] 钱敏,黄敏欣,黄伟健,等. 电子舌和电子鼻在婴儿奶粉检测中的应用 [J]. 中国乳品工业,2016,44(8):58-60.
[4] 张红梅,侯明涛,王淼森,等. 基于电子鼻技术的玉米气味品质检测研究 [J]. 河南农业大学学报,2016,50(3):336-340.
[5] 刘威,刘伟丽,魏晓晓,等. 核磁共振波谱技术在食品掺假鉴别中的应用研究 [J]. 食品安全质量检测学报,2016,7(11):4358-4363.
[6] 王君,刘蓉.近红外光谱技术在液态食品掺假检测中的应用 [J]. 食品工业科技,2016, 37(7):374-380.
[7] 徐文. 液质联用技术在两种中药成分分析中的应用[D]. 广州:广州中医药大学,2015.
[8] 吉坤美, 陈家杰, 汤慕瑾, 等. 双抗体夹心ELISA法测定食物中花生过敏原蛋白成分[J]. 食品研究与开发,2009,30(6):110-114.
[9] XIN F, CHI Z. Detection of adulterated murine components in meat products by TaqMan real-time PCR [J]. Food Chemistry,2016, 192:485-490.
[10] 李溪盛,马莺. DNA指纹技术在食品掺假鉴定中的应用[J]. 中国甜菜糖业,2014(4):44-50.
[11] 孔金明. 生物芯片技术在食品安全领域的应用综述 [J]. 郑州轻工业学院学报(自然科学版),2013,28(1):1-6.
[12] 刘金华, 魏春艳, 马立晖. 应用RFLP特异基因片段检测绿豆成分 [J]. 植物检疫,2006,20(6):336-338.
EstablishmentofspecificPCRformungbeaningredientsdetectioninfood
ZHAO Zhonglin1, LI Ruige1, QIN Zhiyang1,WANG Cheng2, WANG Yong2,YUAN Chao1,LAN Qingkuo2
(1.College of Sciences, Henan Agricultural University, Zhengzhou 450002, China; 2.Institute of Tianjin Agriculture Quality Standard and Testing Technology,Tianjin 300381, China)
A specific PCR method was established for mung bean composition detection in food. Specific primers were designed to detect the gene from mung bean composition. Primer concentrations of 0.2, 0.4, 0.6, 0.8 and 1.0 μmol·L-1and annealing temperature of 52, 54, 56, 58, 60 and 62 ℃were tested to optimize the reaction condition. We also tested the sensitivity, specificity, and detection limits of this method. The results showed that the best annealing temperature and primer concentration were 58 ℃ and 0.4 μmol·L-1, respectively. The sensitivity of detection was 0.5%. The method was simple, fast and easy to operate. Due to its high specificity, it could provide a basis for food safety assessment.
food; mung bean ingredients; gel electrophoresis; PCR ; specificity detection
2017-06-08
国家自然科学基金项目 (31100067)
赵仲麟(1980-),男,辽宁鞍山人,副教授,博士,从事化学生物学及分子生物学方面的研究。
兰青阔(1980-),男,河南南阳人,副研究员,硕士。
1000-2340(2017)06-0867-04
TS214
A
蒋国良)
