响应曲面法优化枸骨总皂苷的提取工艺及抗氧化活性
2018-01-06赵玲艳张红芳陈崇莲陈晔
赵玲艳+张红芳+陈崇莲+陈晔
摘要: 为优化枸骨总皂苷的提取工艺,研究枸骨总皂苷的抗氧化活性。用超声-微波协同萃取法,以提取时间、提取功率、料液比为考察因素,在单因素试验基础上,采用响应曲面法(response surface methodology,简称RSM)Box-Benhnken中心组合试验设计,优化枸骨总皂苷的提取工艺;采用清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryylhydrazyl,简称DPPH)自由基能力分析枸骨总皂苷的抗氧化活性。结果表明,采用超声-微波协同萃取法,在提取时间180 s、提取功率 100 W、料液比1 g ∶ 30 mL、乙醇体积分数80%的条件下,枸骨总皂苷的提取率为 3.739 3%;抗氧化试验结果表明,枸骨总皂苷浓度为62.24 μg/mL时,对DPPH自由基的清除率为 24.22%,表明响应曲面法优化了枸骨总皂苷的提取工艺,枸骨总皂苷具有一定的抗氧化活性。
关键词: 枸骨总皂苷提取工艺;超声-微波协同萃取法;响应曲面法;抗氧化活性;DPPH自由基
中图分类号: R284.2 文献标志码: A
文章编号:1002-1302(2017)22-0205-05
枸骨(Ilex cornuta)为冬青科冬青属常绿植物,主要分布于长江流域、秦岭山脉的局部及以南各地,是苦丁茶的主要植物来源之一 。枸骨叶中含有多种对人体有益的成分包括氨基酸、维生素、苦味素、脂多糖和多种微量元素[3]。其根、枝、叶和果实均可入药,具有清火解毒、止渴生津的功效,主要的活性成分是三萜皂苷:枸骨叶含有冬青苷Ⅰ甲酯(ilexosideⅠ methy lester)、冬青苷Ⅱ(ilexoside Ⅱ)、苦丁茶苷等皂苷类化合物[4-6]。皂苷广泛存在于植物体内,具有广泛的生物活性和功能,如抗菌消炎、抗肿瘤、抗病毒、抗生育、免疫调节、降血脂、保肝活性等作用[3,6-7]。
超声-微波协同萃取是近年来发展的一门新技术,用于枸骨总皂苷的提取,不但操作简便、副产物少,而且能缩短提取时间、增加提取率,还能降低操作费用,符合环境保护的要求[8]。响应曲面法(response surface methodology,简称RSM)可以采用二次回归方程拟合多个因素与多个响应值之间的函数关系,通过回归方程分析寻求最佳工艺参数。响应曲面法具有周期短、回归方程精度高、能研究多种因素间交互作用等优点[8]。
关于枸骨叶皂苷提取的研究还很少[9-10],本研究拟通过超声-微波的提取方法和响应曲面法确定枸骨叶中皂苷提取的最佳工艺条件,并对其抗氧化作用进行探讨,为进一步开发利用枸骨叶提供依据。
1 材料与方法
1.1 材料与试剂
材料:2016年7月于江西省九江市南湖公园采集枸骨叶片,烘干,粉碎,过60目筛,备用。
试剂:齐墩果酸标准品(上海如吉生物科技公司);维生素C对照品(BTH,德国进口);1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryylhydrazyl,簡称DPPH,南京奥多福尼生物科技有限公司);无水乙醇、正丁醇、过氧化氢(30%)、香草醛、冰醋酸、高氯酸,均为分析纯。
1.2 仪器与设备
超声-微波协同萃取仪(CW-2000,新拓分析仪器科技有限公司);电子天平(BSA124S,赛多利斯科学仪器有限公司);低速台式大容量离心机(TDL-40B,上海安亭科学仪器厂);可见分光光度计(721,天津普瑞斯仪器有限公司);水浴锅等。
1.3 试验方法
1.3.1 标准曲线的制备 精确称量齐墩果酸0.005 g,用无水乙醇溶解定容至10 mL;精准移取浓度为0.5 mg/mL的齐墩果酸样品0.1、0.2、0.3、0.4、0.5、0.6 mL标准溶液于6支10 mL的试管中,水浴蒸干后分别加入0.3 mL新配置的5%香草醛-冰醋酸溶液及1.0 mL高氯酸溶液,将它们置于 60 ℃ 水浴锅中加热20 min,取出后用流水冷却至室温后在试管中分别加入5.0 mL冰醋酸,摇匀。在560 nm波长处测吸光度[10-11]。以吸光度为纵坐标、齐墩果酸浓度为横坐标,绘制标准曲线,求得回归方程为y=0.262x+0.131 4(r2=0.998 6)。
1.3.2 枸骨叶皂苷提取流程 提取流程:枸骨叶烘干—粉碎—过60目筛—超声-微波协同萃取仪提取枸骨中的皂苷(2次)—抽滤、合并提取液—水浴旋转蒸发—加入正丁醇—水浴旋转蒸发—加入过氧化氢—水浴加热(99 ℃)—定容至10 mL得样品溶液[12-15]。取样品溶液0.2 mL,采用“1.3.1”节的方法测定吸光度,按上述回归方程,计算总皂苷的含量。
提取率=m2/m1×100%。
式中:m2为提取到的枸骨总皂苷的质量(g);m1为枸骨叶粉末的质量(g)。
1.3.3 单因素试验
在开启超声波的条件下,以乙醇体积分数80%为溶剂[9]、固定提取时间为240 s、提取功率为 180 W,分析料液比分别为1 ∶ 20、1 ∶ 30、1 ∶ 40、1 ∶ 50、1 ∶ 60(g ∶ mL)对枸骨总皂苷提取率的影响;固定提取时间为 240 s、料液比为 1 g ∶ 30 mL,考察微波功率分别为60、120、180、240、300 W对枸骨总皂苷提取率的影响;固定提取功率为120 W、料液比为 1 g ∶ 30 mL,考察提取时间分别为120、180、240、300、360 s对枸骨总皂苷提取率的影响。
1.3.4 响应曲面试验设计
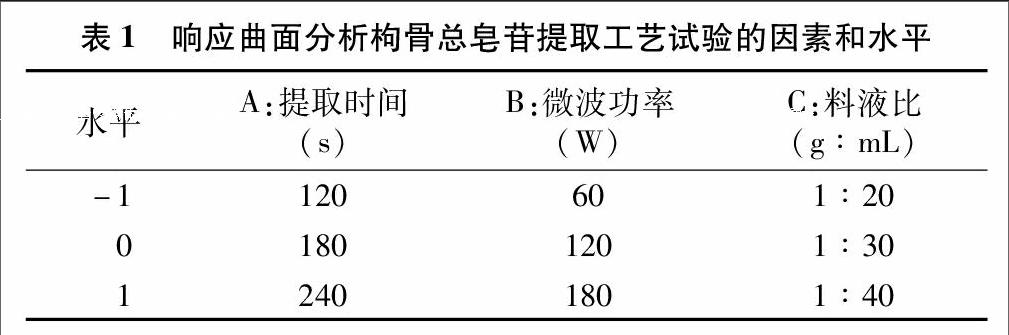
在单因素试验的基础上,根据 Box-benhnken Design中心组合试验设计原理,以提取时间、提取功率、料液比为自变量,以枸骨总皂苷提取率为响应值,设计3个因素3个水平的响应曲面分析试验,建立枸骨总皂苷提取工艺条件的二次模型。因素水平见表1。endprint
1.3.5 抗氧化试验
本试验采用的方法是通过测定皂苷清除DPPH自由基的能力判断枸骨总皂苷的抗氧化能力[12-20]。
溶液的制备:(1)DPPH溶液的制备:取0.002 0 g DPPH固体,用95%乙醇溶液溶解,定容至25 mL摇匀,现配现用;维生素C对照品(BTH)溶液的制备:取0.002 2 g BTH固体,用95%乙醇溶液溶解,定容至50 mL,现配现用。
枸骨总皂苷抗氧化性试验:吸取2 mL DPPH溶液于试管中,加入2 mL样品溶液,摇匀,常温下避光反应45 min,在517 nm波长处测定其吸光度,记为样品吸光度DA1;取样品溶液2 mL,加入80%乙醇溶液,摇匀,常温下避光反应45 min,测其吸光度;记为干扰吸光度DA2;取2 mL 80%乙醇溶液,再加入2 mL DPPH溶液,摇匀,常温下避光反应45 min,测定其吸光度,记为对照吸光度DA0。样品设有6组浓度梯度,每组3个平行。清除率=1-(DA1-DA2)/DA0×100%。
维生素C标准品对照试验:分别吸取BTH溶液2.5、33、5.0、6.6、8.3、9.1、10.0 mL用95%乙醇溶液定容至 25.0 mL,摇匀。分别取2.0 mL于具塞试管中,加入2.0 mL DPPH溶液,摇匀,避光反应45 min,测其吸光度,记为样品吸光度DB1;取稀释液各2.0 mL于具塞试管中,分别加入 2.0 mL DPPH溶液,摇匀,避光反应45 min,测其吸光度,记为干扰吸光度DB2;取 2.0 mL 95%乙醇溶液,再加入2.0 mL DPPH溶液,摇匀,常温下避光反应45 min,测定其吸光度,记为对照吸光度DB0。清除率=1-(DB1-DB2)/DB0×100%。
1.3.6 数据处理 采用Origin 8.0软件作图,Design-Expert 8.0.6软件进行方差分析。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对枸骨总皂苷提取率的影响
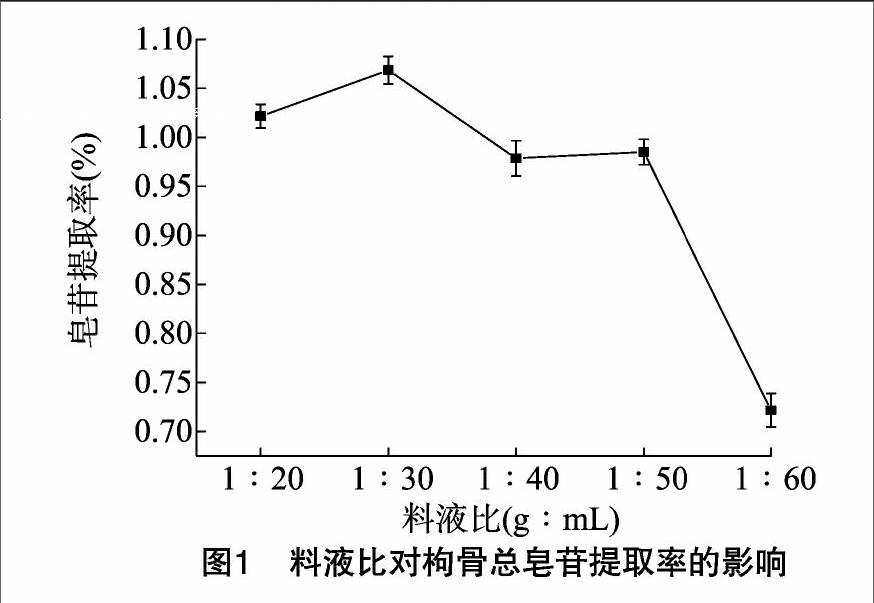
在微波功率 180 W、提取时间240 s的条件下,分析不同料液比对枸骨总皂苷提取率的影响。如图1所示,当料液比小于1 g ∶ 30 mL时,随着料液比的增加,枸骨总皂苷含量呈上升趋势。提取剂的增加,更有利于枸骨总皂苷的溶出,这是因为溶剂和原料间的浓度差越大,其提取效率就越高,目标物质就越容易溶出,当料液比超过1 g ∶ 30 mL时,枸骨总皂苷含量有下降的趋势,可能是由于溶剂过大,超声波协同微波的能量在相同时间提供的热量被提取剂吸收的比例增加以及空化效应和机械效应等效应的强度减弱等影响了提取效率。因此选择液料比 1 g ∶ 30 mL于后面的试验继续考察。
2.1.2 微波功率对枸骨总皂苷提取率的影响
由图2可知,在微波功率为120 W之前,枸骨总皂苷提取率呈上升趋势,随后就开始下降。可能由于随着微波功率的增加,物質的加热程度也随之增加,使枸骨总皂苷更容易被提取出来,即皂苷提取效率增加。在微波功率达到120 W之后,枸骨总皂苷提取率有减少趋势,这可能是由于高微波功率导致的热效应使枸骨总皂苷分解。因此,120 W为最佳微波功率。
2.1.3 超声-微波协同提取时间对枸骨总皂苷提取率的影响
由图3可知,在超声-微波协同提取时间为180 s之前,枸骨总皂苷不能充分地转移到溶液中,随着提取时间的延长,枸骨总皂苷的提取率增加,在180 s时达到峰值,提取时间继续延长,枸骨总皂苷提取率明显下降,这可能是因为随着微波时间的延长,温度急剧升高,导致皂苷分解。因此,180 s为最佳提取时间。
2.2 响应曲面法分析枸骨总皂苷的提取工艺
2.2.1 响应曲面法分析枸骨总皂苷的提取工艺试验设计及结果
根据单因素试验结果,以提取时间、微波功率和液料比为自变量,按表1中的因素、水平,利用Design-Expert 8.0.6软件,采用Box-Behnken设计响应曲面试验方案。如表2所示,共17个试验点,其中12个为析因点,5个为零点,析因点为自变量取值在A、B、C所构成的三维顶点;零点为区域的中心点,其中零点试验重复5次,用以估算试验误差。
2.2.2 响应曲面法分析枸骨总皂苷提取工艺模型的建立及显著性检验
利用Design Expert 8.0.6软件通过逐步回归对表2数据进行多元回归拟合,得到枸骨总皂苷提取率对提取 时间、提取功率、料液比的回归方程为
Y(%)=3.67-0038A- 0.42B+0.19C+0.006A×B-0.24A×C+0.12B×C-113A2-0.59B2-0.71C2。
对模型进行方差分析,结果见表3。由表3可知,该模型具有高度显著性(P<0.01),失拟项不显著(P=0.73),R2adj=0.912 6,R2=0.938 7,信噪比为11.910,远大于4,可知回归方程拟合度和可信度均较高,说明这种试验方法是准确可靠的,使用该方程模拟真实的3个因素3个水平的分析是可行的。在所选的各因素水平范围内,对结果的影响排序为微波处理功率>液料比>提取时间。模型的复相关系数R2为93.87%,大于90%,说明模型拟合程度良好,试验误差小,该模型是合适的。因此可以用该模型方程来分析和预测不同提取条件下枸骨总皂苷提取率的变化。由表3的P值可知,方程中B、A2、B2、C2对枸骨总皂苷提取率Y值的影响极显著,表明试验因素对响应值的影响不是简单的线性关系,二次项对响应值也有很大的影响,交互项作用的影响较小。这与模拟回归中线性和二次项影响显著相对应。
2.2.3 枸骨总皂苷提取工艺的响应曲面分析与优化
根据二次模型得到的等高线及响应曲面可以评价试验因素之间的endprint
交互作用强度,确定各因素的最佳水平范围。从图4至图9中的响应曲面最高点及其等高线可知,在所选范围内存在极值,即响应曲面最高点,同时也是等高线最小椭圆的中心点。
由图4、图5可知,当料液比为1 g ∶ 30 mL时,在提取时间 120~180 s的范围内皂苷提取率先迅速增加,在180 s之后皂苷提取率有下降的趋势。在微波处理功率60~120 W范围内,皂苷提取率不断增加,之后随着提取时间的延长,皂苷提取率有下降的趋势。随着提取时间和微波功率的增加,皂苷提取率先迅速增加,达到最高点之后略有下降的趋势。
从图6、图7可以看出,当微波处理功率为120 W时,随时间的延长、液料比的增大,皂苷提取率逐渐升高,达到最高点之后有下降的趋势。
由图8、图9可知,当提取时间为180 s时,在料液比 1 g ∶ (20~30) mL范围内,皂苷提取率不断增加,之后随着微波功率的增大,皂苷提取率有下降趋势。微波处理功率在60~120 W范围内,提取率不断增加,之后随着液料比的增大,皂苷提取率有下降趋势。
从图4至图9中的响应曲面及其等高线可以看出,等高线呈椭圆,说明提取时间和微波功率、微波功率和液料比、料液比和提取时间之间交互影响明显,响应曲面陡峭说明枸骨总皂苷提取率受提取时间、微波功率和料液比的变化敏感,也表明各因素对枸骨总皂苷的影响不是简单的线性关系。
通过软件分析,得到皂苷提取的最佳条件为提取时间179.96 s,微波处理功率98.84 W,料液比1 ∶ 30(g ∶ mL),在此条件下皂苷提取率的理论值为3.7429%。为检验响应曲面法所得结果的可靠性,采用上述优化提取条件进行皂苷提取率提取,考虑到实际操作的便利,将提取工艺参数修正为提取时间180 s、微波处理功率100 W、料液比1 ∶ 30(g ∶ mL),5次平行试验皂苷提取率分别为3.731 2%、3.740 8%、3.741 3%、3.744 1%、3.739 2%,平均皂苷提取率为 3.739 3%,数据重现性良好,偏差不大,吸光度测量值稳定,说明每次测定的皂苷含量稳定,证明该结果是合理可靠的。
2.3 抗氧化活性试验
由图10可知,枸骨总皂苷在10~65 μg/mL浓度范围内,随着枸骨总皂苷浓度的升高,对DPPH清除率增强,当枸骨总皂苷浓度为65 μg/mL时清除率达最大值,为25%;之后随着枸[CM(25]骨总皂苷浓度的升高,对DPPH清除效果有下降趋势。从
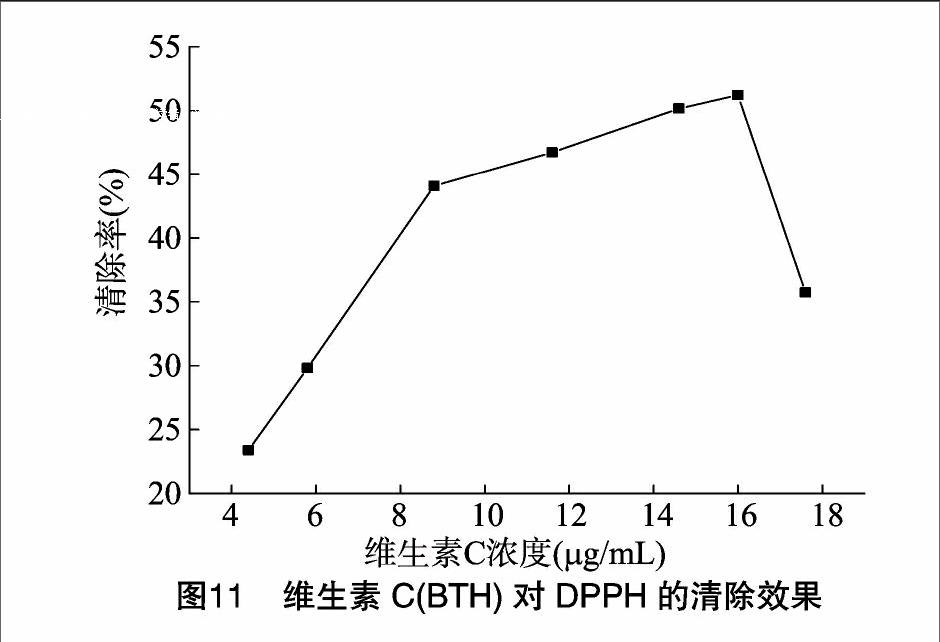
图11可知,维生素C在低浓度的条件下即可对DPPH表现出很强的清除能力,当维生素C浓度超过16 μg/mL时随浓度的升高清除率下降。
总之,枸骨总皂苷具有较强的抗氧化能力,但它对DPPH的清除效果要小于维生素C的作用效果,这可能是因为使用枸骨总皂苷粗提物进行抗氧化试验,含有较多的其他化合物,从而影响了其对DPPH的清除效果。
3 结论与讨论
在單因素试验的基础上,利用响应曲面法对枸骨总皂苷超声-微波协同提取工艺参数进行优化研究,选择超声-微波协同提取时间、微波功率以及料液比为自变量,总皂苷提取率为响应值,采用Box-Behnken设计方法,研究各自变量及其交互作用对总皂苷提取率的影响。利用Design Expert软件对数据进行回归分析,得到二次多项式回归方程的预测模型。结[CM(25]果表明, 枸骨总皂苷超声-微波协同提取的优化工艺条件
为超声-微波协同提取时间180 s、微波功率100 W、料液比 1 ∶ 30(g ∶ mL)。在此工艺条件下枸骨总皂苷理论提取率为3.742 9%,实测提取率为3.739 3%。张风礼等利用浸提法,通过乙醇体积分数、料液比、提取温度、提取时间等单因素和正交试验法优化枸骨叶总皂苷的提取工艺,结果以80%乙醇水溶液为溶剂,料液比1 g ∶ 10 mL,65 ℃浸提取1.5 h时总皂苷提取率高提取率达4.51%[10]。虽然利用该工艺提取枸骨叶总皂苷提取率达4.51%,但该工艺提取时间长,耗能较高,而本试验利用超声-微波协同提取枸骨叶总皂苷的方法具有操作简便、提取时间短、耗能较少等特点。
枸骨叶是苦丁茶的主要源植物之一,作为日常保健饮品,具有减肥、强身健体的功效,近年来多数学者对枸骨叶药理学进行了研究[3,6]。结果表明,枸骨叶具有抗心肌缺血、降血脂、抗菌、免疫、抑制抗生育和抗氧化等广泛的药理作用[20-27]。旷春桃等在新鲜肥肉熬制的猪油中分别添加自制的0.02%枸骨叶多酚类提取物,来检测枸骨叶多酚类提取物的抗氧化能力,结果表明枸骨叶多酚类提取物能有效抑制猪油的氧化,表现出较强的抗氧化活性[19]。本试验通过对DPPH的清除力来检测不同浓度的枸骨总皂苷体外抗氧化活性,结果显示枸骨总皂苷浓度为62.24 μg/mL时,对DPPH自由基的清除率为24.22%,进一步说明枸骨叶有较强的抗氧化能力。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典:一部[S]. 北京:化学工业出版社,2010:233.
[2]谢宗万. 全国中草药汇编(上册)[M]. 2版.北京:人民卫生出版社,1996:602.
[3]李国文,吴 弢,谢 燕,等. 中药枸骨叶研究进展[J]. 国际药学研究杂志,2011,38(5):356-361.
[4]张 洁,喻 蓉,吴 霞,等. 枸骨叶的化学成分研究[J]. 天然产物研究与开发,2008,20(5):821-823.
[5]Tsutomu N,Hiroko T,Masao N,et al. Tow triterpeniod glycosides from leaves of Ilex cornuta[J]. Phytochemistry,1982,21(6):1373-1377.endprint
[6]彭国全,杨冬梅. 枸骨的药物功效与保健作用[J]. 江西农业学报,2011,23(6):79-82.
[7]Qin W J,Wu X E,Zhao J J,et al. Triterpenoid glycosides from leaves of Ilex cornuta[J]. Phytochemistry,1986,25(4):913-916.
[8]潘青友,童群义. 响应曲面法优化超声-微波协同提取百合残渣中总皂苷工艺的研究[J]. 食品工业科技,2012,33(16):273-276.
[9]周國莉,舒 柯,聂骊晓,等. 不同产地中药材枸骨叶中总皂苷的含量测定[J]. 湖南中医药大学学报,2010,30(7):33-35.
[10] 张风礼,曾超珍,刘志祥. 枸骨叶总皂苷的提取工艺的研究[J]. 中南林业科技大学学报,2010,30(9):194-197.
[11]吴剑峰,王 宁. 天然药物化学[M]. 2版.北京:人民卫生出版社,2013:164-177.
[12]沈雅婕,张榕文,黄凯伟,等. 响应曲面法优化墨旱莲三萜总皂苷提取工艺研究[J]. 环球中医药,2014,7(5):341-345.
[13]杜静婷,陈 超,范三红. 响应面法优化藜麦糠皂苷的提取及抗氧化活性[J]. 山西农业科学,2016,44(7):932-937.
[14]孙冀平,裘爱泳,胡学烟. 茶皂素的脱色研究[J]. 中国油脂,2003,28(4):42-45.
[15]梁翠霞,吴丽霞. 三七皂苷加压提取工艺优化与抗氧化活性研究[J]. 中国医学工程,2015,23(6):203-204.
[16]令狐晨,阿依吐伦·斯马义. 皂苷提取纯化及其抗氧化活性的研究进展[J]. 广州化工,2015,43(6):7-9,22.
[17]王 晶,刘春明,白鹤龙,等. 中药中皂苷类化合物的抗氧化活性评价研究[J]. 时珍国医医药,2010,21(6):1485-1487.
[18]张猛猛,田冰洁,洪秀云. 纯化的绞股蓝皂苷的抗氧化活性研究[J]. 生物技术,2013,23(1):76-78.[HJ1.75mm]
[19]旷春桃,陈如锋,吴 斌,等. 枸骨叶中多酚类物质的提取及抗氧化性能分析[J]. 湖北农业科学,2009,48(2):427-429.
[20]周 萍,廖庆文. 大孔树脂富集枸骨叶中总皂苷的研究[J]. 湖南中医杂志,2002,18(1):51.
[21]李维林,吴菊兰,任冰如,等. 枸骨中3种化合物的心血管药理作用[J]. 植物资源与环境学报,2003,12(3):6-10.
[22]林 晨,谭玉波,张 晶,等. 枸骨叶不同溶媒萃取物对小鼠体外T淋巴细胞活化增殖的影响[J]. 暨南大学学报(医学版),2006,27(2):199-203.
[23]邢莹莹,岑颖洲,王一飞,等. 瑶药枸骨叶不同溶剂组分体外抑菌活性比较[J]. 暨南大学学报(自然科学版),2004,25(1):119-121.
[24]程 林. 枸骨冬青秋季光合生理特性研究[J]. 江苏农业科学,2015,43(12):221-223.
[25]张 晶,林 晨,岑颖洲,等. 枸骨叶抗真菌作用初探[J]. 中国病理生理杂志,2003,19(11):1562.
[26]魏成武,杨翠芝,任华能,等. 枸骨抗生育作用[J]. 中药通报,1988,13(5):48-50.
[27]李路军,杜 鹏,孙珂焕,等. 华中枸骨叶的化学成分及其肿瘤细胞毒作用[J]. 中国中药杂志,2013,38(3):354-357.endprint
