不同成熟期桃品种NAC基因遗传多样性研究
2018-01-06雷雨张雪芳罗鑫磊刘咲頔熊怡冯涛
雷雨+张雪芳+罗鑫磊+刘咲頔+熊怡+冯涛

摘要: 从11个桃品种嫩叶中分别提取基因组DNA,根据GDR数据库中NAC基因序列信息,设计特异引物,PCR扩增,对产物克隆测序。然后,使用DNAman软件进行核苷酸和氨基酸序列比对,使用ORF Finder获得开放阅读框和推导氨基酸序列,使用CDD工具进行蛋白质结构域分析,利用Blastp工具搜索同源蛋白,采用Mega软件绘制系统进化树。结果发现,NAC蛋白第16~140位存在1个NAC结构域,N端比较保守,C端则多样性比较高;核苷酸变异有SNP和Indel 2类,津柳早红和小白桃在第3外显子区SNP和Indel变异数量非常多,说明这2个品种的NAC基因结构具有独特性。蛋白比对发现,桃NAC与梅同源性最高,其次是鸭梨;进化树体现了物种的亲缘关系。结果表明,参试品种NAC基因存在比较丰富的遗传多样性,在保守区内的氨基酸变异可能影响蛋白的功能。
关键词: 桃;NAC转录因子;成熟期;保守区;系统进化树
中图分类号: S662.101 文献标志码: A
文章编号:1002-1302(2017)22-0046-04
NAC转录因子是一类植物特有的转录调控因子,1996年Souer等首先从矮牵牛中克隆得到[1],随后在拟南芥、水稻、小麦、大豆等中相继发现。研究表明,NAC转录因子在植物的生长发育、形态建成、激素调节以及对生物和非生物逆境的抗性等方面发挥作用[2]。NAC转录因子最主要的结构特点是N端含有高度保守的NAC结构域,由约150个氨基酸残基组成;C末端通常有简单的重复氨基酸序列,富含丝氨酸,苏氨酸、脯氨酸和谷氨酸,或者酸性氨基酸残基,具有转录激活功能。
有研究者指出NAC转录因子调控植物生殖器官成熟和衰老。2006年,Uauy等从小麦中分离了NAM-B 1,功能分析显示,它在野生小麦中加速植株衰老,促进叶片中营养物质向籽粒流动[3]。2011年,Balazadeh等从拟南芥中分离了ORS1,超表达ORS1转化拟南芥,加速了转化体衰老[4]。2013年,Zhou等从水稻中鉴定出OsNAP,发现它调控叶片衰老[5]。2014年,Kim等在拟南芥上发现NAC有调控衰老的功能[6]。2013年,Pirona等利用桃Contender×Ambra和NJWeeping×Bounty F2代分离群体、SNP检測、遗传图谱构建、QTL定位、对候选基因的Sanger测序等技术,结合检测等位基因在子代中的分离比例等,认为NAC基因在控制桃果实成熟期中发挥重要作用[7]。笔者前期克隆了小白桃和它的早熟芽变品种津柳早红的NAC基因,发现二者核酸序列有多处差异,尤其是后者中核苷酸变异形成终止密码子,导致翻译提前终止(未发表资料)。那么,在其他不同成熟期的桃品种中,NAC基因结构是否存在多样性?为了解答这个问题,笔者从11桃品种中克隆了NAC基因,希望通过分析其结构,能找到一些NAC发挥功能的线索。
1 材料与方法
1.1 材料
2014年6月从天津学香果蔬有限公司(位于天津市西青区杨柳青镇大柳滩村)桃资源圃采集津柳早红、万寿红等11个桃品种(表1)的嫩叶,液氮速冻,带回实验室置于-80 ℃超低温冰箱中保存备用。
1.2 基因组DNA提取
采用北京康为世纪生物科技有限公司的复杂植物基因组DNA提取试剂盒基因组DNA。使用Nanodrop 2000检测核酸纯度和浓度。1.5%琼脂糖凝胶电泳检测核酸完整性、洁净度和有无其他类型核酸污染。保留纯度和浓度符合要求的样品,分别于-20 ℃保存。
1.3 NAC基因的PCR扩增及测序
从GDR数据库(https://www.rosaceae.org)获取桃NAC基因序列信息,对5′UTR、外显子区和3′UTR,用Primer Premier 5设计特异引物,委托上海生工生物工程有限公司合成。PCR反应体系25 μL包括10×Ex Taq buffer 2.5 μL,dNTP Mixture 1.5 μL(2.5 mmol/L),模板cDNA 1 μL,上下游引物各1 μL(20 μmol/L),Ex Taq DNA聚合酶0.2 μL(5 U/μL),其余用PCR级纯水补充。反应程序:95 ℃预变性5 min;35个循环(94 ℃变性30 s,59 ℃退火45 s,72 ℃延伸 2 min);最后72 ℃延伸8 min。用1.5%琼脂糖凝胶电泳检测PCR产物,目的条带回收、纯化(Takara胶回收试剂盒),连接至pMD18-T载体,热激法转化大肠杆菌DH5α,挑取阳性单克隆、摇菌,选取阳性克隆,送上海生工生物工程有限公司测序。
1.4 核酸序列比对和生物信息学分析
使用DNAman 5.2软件进行核酸序列比对,结合参考基因组中NAC基因序列,区别各品种NAC基因的外显子区和内含子区;使用ORF Finder在线工具(http://www.ncbi.nlm.nih.gov/projects/gorf/)获得开放阅读框和推导氨基酸序列;使用NCBI中的CDD工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白质结构域分析。
1.5 NAC同源蛋白及其系统进化分析
利用NCBI中的Blastp工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索同源蛋白序列;使用DNAman进行序列比对;使用Mega 4.1软件绘制系统进化树。
2 结果与分析
2.1 NAC基因的克隆及测序
根据GDR数据库中桃NAC基因(ppa008301m)mRNA序列设计特异引物对:Forward primer为ATCCCTCTCTTTCTTTC TCTC,Reverse primer为ACCCCTACTCGATTTCTCCAC。以各品种基因组DNA为模板,分别进行PCR扩增,电泳检测得到约 1 400 bp 片段(图1、图2)。将上述产物克隆测序,分别获得各品种NAC基因的核苷酸序列。
2.2 NAC基因的结构及其遗传多样性
将NAC基因的DNA和cDNA序列进行比对,分析ORF和保守區。结果显示,各品种的NAC基因编码氨基酸157~385个,在氨基酸序列第16~140位存在1个NAC结构域,确认了NAC基因身份。DNA和cDNA序列比对发现,它由5′UTR区、3个外显子区、2个内含子区和3′UTR区组成;在各区域均存在一定数量的变异(表2):变异分为SNP和Indel 2类;第1外显子区有1处SNP,但它为同义突变,没有引起氨基酸序列变化;第2外显子区存在3处SNP,其中津柳早红品种(代号11)的第470位核苷酸为C,其他10个品种均为A,该SNP使氨基酸126位的赖氨酸变为精氨酸(K→R)(图3-B),其余2处未引起氨基酸序列变化。第3外显子区变异最多(图3-A),非同义突变数量也最多,其中品种8在1 052~1 150位有一段99 bp的插入序列,引起插入33个氨基酸残基;津柳早红在559~560位有TT缺失,造成移码突变,另外在569位有SNP,由T变G,出现终止密码子,导致翻译终止(图3-C)。津柳早红和小白桃(代号10)在第3外显子区SNP和Indel变异数量非常多(图3-A),说明这2个品种的NAC基因结构具有独特性。
2.3 桃NAC同源蛋白及其系统进化分析
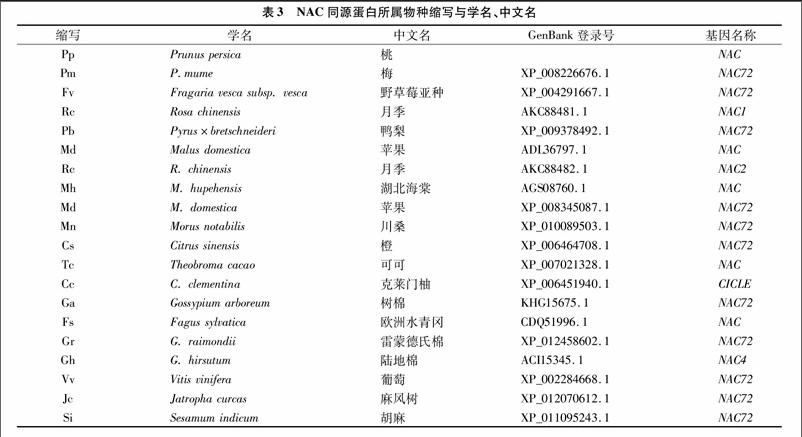
Blastp检索同源蛋白,发现结果中绝大多数属于NAC类成员。桃NAC基因与梅同源性最高,为97%,其次是鸭梨NAC,为89%。其他同源性较高的来自于苹果、月季、湖北海棠、草莓等物种。将score值最高的19个同源蛋白序列(表3)下载到本地,进行同源性分析(图3-E)。桃NAC(ref品种)与19种植物同源性在72%~97%之间。
这些NAC同源蛋白比对结果显示,在NAC结构域保守性较高(图3-E),在它之外则多态性较高。将桃各品种NAC氨基酸序列比对结果与其他物种同源序列比对结果结合起来分析发现:这些物种在126位(按照ref品种序列)赖氨[CM(25]酸高度保守,而津柳早红品种突变为精氨酸(图3-B、图3-E),且其他参试品种均为赖氨酸;在191位丝氨酸高度保守,而早蟠品种为脯氨酸(图3-C、图3-F),且其他参试品种均为丝氨酸;在291~318位高度保守,而小白桃品种氨基酸中发生突变较多(图3-D、图3-G)。
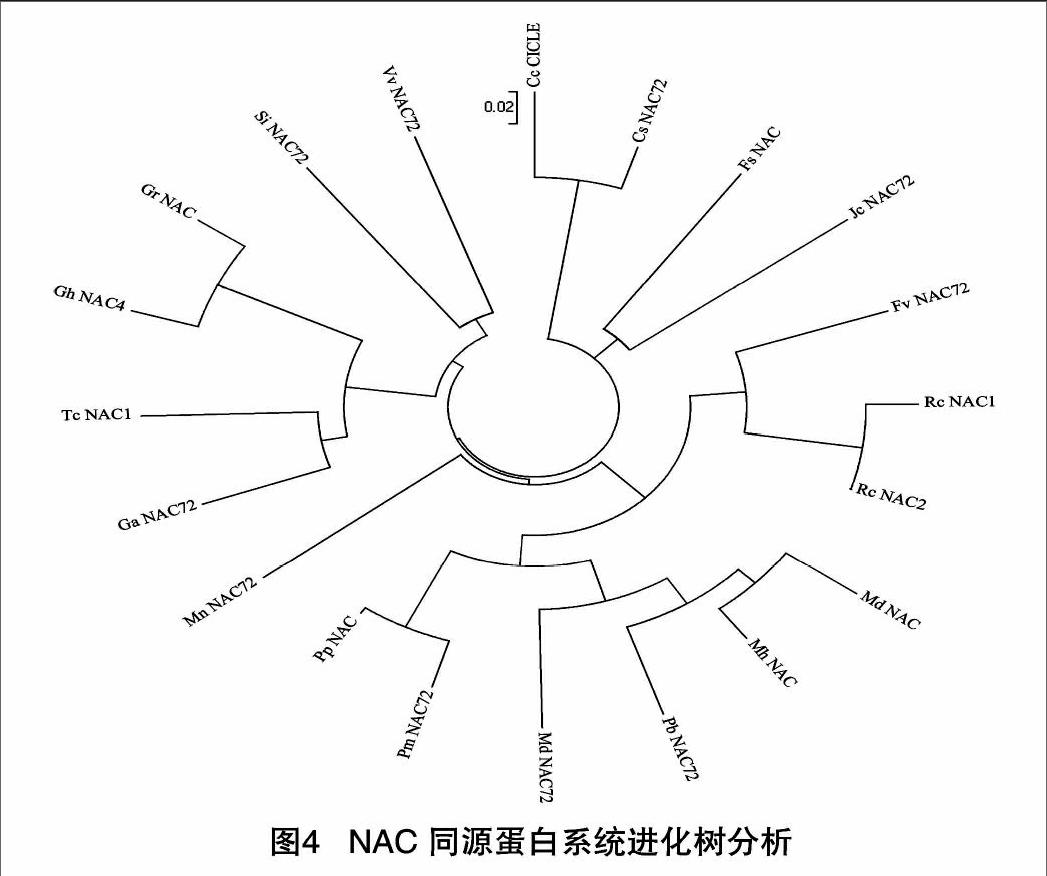
Mega 4.1生成系统进化树(图4),各物种NAC分为3组,桃NAC与梅、鸭梨、栽培苹果、湖北海棠、野草莓亚种、月季、川桑等聚为一组;可可、树棉、雷蒙德氏棉、陆地棉、葡萄、胡麻等为一组;橙、克莱门柚、麻风树、欧洲水青冈等为一组。桃NAC与梅NAC72聚为一小支,与同源性分析结果一致。进化树体现了亲缘关系的远近,如雷蒙德氏棉、陆地棉聚为一支,橙、克莱门柚聚为一支,蔷薇科果树及木本观赏植物形成一组等。
3 讨论
前人研究发现,NAC蛋白N端含有NAC结构域,氨基酸序列比较保守,C端则含有转录激活区,多样性比较高。本研究对不同果实成熟期的桃品种NAC蛋白氨基酸序列比对结果符合上述规律:在第1、2外显子区核苷酸变异少,其中多数是同义突变,不引起氨基酸序列变化;第3外显子区多样性非常丰富,而且引起的氨基酸序列变化比较多。本研究比对20个物种的NAC同源蛋白,发现N端氨基酸序列比较保守,而C端多样性较高,与前人在其他物种上的研究结论一致。津柳早红品种NAC蛋白翻译提前终止,导致转录激活区部分缺失,可能会影响其生物学功能或效能,进而引起果实提早成熟,但是需要进一步试验验证。小白桃在C端存在一段特殊的氨基酸序列,有别于其他参试桃品种,具有独特性。
Ooka等认为在NAC保守结构域中包含5个亚结构域(A、B、C、D、E),其中A、C、D高度保守,B和E保守性不强[8]。前人研究发现,在NAC蛋白中个别氨基酸突变会显著影响其生物学功能。在拟南芥cuc1突变体中,cuc1-1蛋白在123位氨基酸处由赖氨酸突变为苏氨酸(属于D亚结构域),可能影响它核定位和DNA结合,致使突变体不能形成茎顶端分生组织[2,9]。本研究中,NAC同源蛋白在126位(按照ref品种序列)赖氨酸高度保守(属于D亚结构域),而津柳早红品种为精氨酸;在191位丝氨酸高度保守,而早蟠品种为脯氨酸,从类型上讲,从极性氨基酸突变为非极性氨基酸,性质变化比较大。因此,这2处变异很有可能导致蛋白功能或效能的明显变化。
不同物种同源蛋白的系统进化树分析通常能获得与基于表型性状的植物分类学相同或相近的结果。张亮等研究了新疆栽培扁桃CBF1转录因子基因,在对不同植物CBF氨基酸序列进行系统进化树分析时发现,它与甜樱桃、梅亲缘关系最近,而且三者与野生扁桃、山桃、桃、光核桃、新疆桃等聚成一组[10]。陈清等研究黑莓RuMYB10 基因,系统进化树分析同源蛋白发现,同属悬钩子属的欧洲红树莓与RuMYB10 分化时间很近;物种间MYB基本等同于物种分类地位:同属蔷薇科的苹果亚科、李(梅)亚科和蔷薇亚科各自聚为小枝后汇为一大类[11]。本研究中,NAC同源蛋白系统进化树也体现了植物亲缘关系,桃NAC与梅NAC72聚为一小枝,雷蒙德氏棉、陆地棉聚为一枝,橙、克莱门柚聚为一枝,蔷薇科植物聚成一组等。
NAC基因是桃果实成熟期性状的候选基因之一[7]。Eduardo等利用桃分离群体研究发现缓慢成熟性状是单基因控制,它与果实成熟期性状共分离,从NAC基因中开发了一个SCAR标记(PSR2)用于鉴定后代成熟性状[12]。Nuez-Lillo等利用桃F2群体研究发现,NAC与缓慢成熟性状共分离,认为NAC和ERF4 是成熟期性状和果肉粉状性状的候选基因[13]。
[HS2][HT8.5H]参考文献:
[1] Souer E,van Houwelingen A,Kloos D,et al. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J]. Cell,1996,85(2):159-170.
[2]柳展基,邵凤霞,唐桂英. 植物NAC转录因子的结构功能及其表达调控研究进展[J]. 西北植物學报,2007,27(9):1915-1920.
[3]Uauy C,Distelfeld A,Fahima T,et al. A NAC gene regulating senescence improves grain protein,zinc,and iron content in wheat[J]. Science,2006,314(583):1298-1301.
[4]Balazadeh S,Kwasniewski M,Caldana C,et al. ORS1,an H2O2-responsive NAC transcription factor,controls senescence in Arabidopsis thaliana[J]. Molecular Plant,2011,4(2):346-360.
[5]Zhou Y,Huang W F,Liu L,et al. Identification and functional characterization of a rice NAC gene involved in the regulation of leaf senescence[J]. BMC Plant Biology,2013,13:132.
[6]Kim H J,Hong S H,Kim Y W,et al. Gene regulatory cascade of senescence-associated NAC transcription factors activated by ETHYLENE-INSENSITIVE2-mediated leaf senescence signalling in Arabidopsis[J]. Journal of Experimental Botany,2014,65(14):4023-4036.
[7]Pirona R,Eduardo I,Pacheco I,et al. Fine mapping and identification of a candidate gene for a major locus controlling maturity date in peach[J]. BMC Plant Biology,2013,13:166.
[8]Ooka H,Satoh K,Doi K,et al. Comprehensive analysis of NAC family genes in Oryza sativa and Arabidopsis thaliana[J]. DNA Research,2003,10(6):239-247.
[9]Takada S,Hibara K,Ishida T,et al. The CUP-SHAPED COTYLEDON1 gene of Arabidopsis regulates shoot apical meristem formation[J]. Development,2001,128(7):1127-1135.
[10] 张 亮,李 疆,帕提曼·阿布都热合曼,等. 扁桃AcCBF1转录因子的克隆及表达分析[J]. 果树学报,2015,32(5):763-768.
[11]陈 清,余昊唯,汤浩茹,等. 黑莓RuMYB10 基因的克隆和表达[J]. 果树学报,2012,29(5):747-754.
[12]Eduardo I,Picaol R,Rojas E,et al. Mapping of a major gene for the slow ripening character in peach:co-location with the maturity date gene and development of a candidate gene-based diagnostic marker for its selection[J]. Euphytica,2015,205(2):627-636.
[13]Nuez-Lillo G,Cifuentes-Esquivel A,Troggio M,et al. Identification of candidate genes associated with mealiness and maturity date in peach[Prunus persica(L.) Batsch]using QTL analysis and deep sequencing[J]. Tree Genetics & Genomes,2015,11(4):86-98.
