PPAR-γ在小鼠肺成纤维细胞中的抗纤维化作用
2017-12-29刘代顺朱红兰
龚 玲,刘代顺,朱红兰
(遵义医学院第三附属医院 呼吸内科,贵州 遵义 563002)
基础医学研究
PPAR-γ在小鼠肺成纤维细胞中的抗纤维化作用
龚 玲,刘代顺,朱红兰
(遵义医学院第三附属医院 呼吸内科,贵州 遵义 563002)
目的探讨过氧化物酶体增殖物激活受体-γ(PPAR-γ)在小鼠肺成纤维细胞中的抗纤维化作用及机制。方法体外培养小鼠肺成纤维细胞(C57BL/6),以转化生长因子-2(TGF-β2)刺激其转换为肌纤维母细胞,使用不同浓度PPAR-γ配体罗格列酮(RSG)抑制转化,采用细胞生长计数检测细胞增殖;PCR检测PPAR-γ mRNA、血小板衍生生长因子-β(PDGFR-β) mRNA及成纤维细胞生长因子R1(FGF-R1) mRNA转录水平。结果RSG抑制C57BL/6细胞增殖(P<0.05);PPAR-γ mRNA转录水平随RSG浓度增加而表达增加,PDGF-β mRNA随RSG浓度增加而表达减少,FGF-R1 mRNA转录水平与RSG无关(P>0.05)。结论RSG抑制TGF-β2诱导的小鼠肺成纤维细胞生物学特性改变,其可能机制与使PPAR-γ活化及PDGF-β表达下调相关。
过氧化物酶体增殖物激活受体γ;肺纤维化;转化生长因子β2;罗格列酮;血小板衍生生长因子β
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种进展性、致死性、不可逆的慢性肺纤维化疾病[1-2]。临床主要表现为进行性呼吸困难,并伴随肺功能下降[3]。虽然经过药物治疗,但此病仍预后不佳,确诊后的平均生存时间为2~5年[4-6],因此它被认为比癌症更致命[7]。转化生长因子-β(transforming growth factor β,TGF-β)诱导的肺成纤维细胞转化是肺纤维化发病机制中的关键点。罗格列酮(rosiglitazone,RSG)是过氧化物酶体增殖物激活受体γ(Peroxisome Proliferater activated Receptor gamma,PPAR-γ)的配体,常作为胰岛素增敏剂用于糖尿病治疗[8],近年发现,PPAR-γ配体参与某些器官纤维化进程。本研究应用RSG探讨PPAR-γ在小鼠肺成纤维细胞中的抗纤维化作用机制,为临床用药进一步提供更为全面的理论依据。
1 材料与方法
1.1 细胞 C57BL/6小鼠肺成纤维细胞(CRL-6013TM)购于美国American Type Culture Collection(ATCC)公司,实验中所用细胞均为第3~4代。
1.2 药物 罗格列酮(R2408)购于美国Sigma Aldrich公司,10 mg/支,罗格列酮纯度>98%,分子式:C18H19N3O3S,分子量: 357.43。罗格列酮使用二甲基亚枫溶解,刺激浓度分别为5 μmol/L、10 μmol/L、20 μmol/L及40 μmol/L。
1.3 试剂 TGF-β2(美国 R&D Systems), Trizol试剂(美国Invitrogen) ,PCR试剂盒(日本TaKaRa),PCR引物合成 (中国 生工生物工程(上海)股份有限公司),DMEM(美国 Hyclone),琼脂糖(美国Cambrex公司)。
1.4 实验方法
1.4.1 细胞复苏 从-150 ℃液氮中取出装有C57BL/6细胞株的冻存管,立即放入37 ℃恒温水浴箱,轻摇使之快速溶解;酒精消毒冻存管,开封后将细胞悬液移入塑料离心管中,加入DMEM培养基10 mL,混匀后低速离心5 min,小心弃上清液;重新加入DMEM(含10%FBS、100 U/mL青霉素、100 μg/mL链霉素)培养基重新混匀细胞,应用血球计数板进行计数,活细胞率95%,以每瓶1×106个/mL接种到10 cm2培养皿中,放置于5%CO2、饱和湿度、37 ℃培养箱中进行培养。
1.4.2 细胞传代 C57BL/6细胞为贴壁生长细胞,观察细胞生长覆盖培养瓶底壁大于80%以上即可以传代;自动吸液器吸除培养皿内旧培养液;加入0.25%胰蛋白酶1 mL,轻轻摇匀使消化液流遍所有细胞表面,放置在37 ℃孵箱内消化;30 s~2 min后在显微镜下观察,发现胞质回缩、细胞间隙增大、细胞悬浮,立即加入10% FBS-P/S DMEM 9 mL终止消化;混匀吹散细胞,从培养瓶底部一边开始,依顺序反复轻柔吹打贴壁细胞,使细胞脱离瓶壁后形成细胞悬液;将细胞悬液分装于新的培养瓶,加入培养基;隔2~3 d换液,细胞长至70%~80%融合状态时用于实验。
1.4.3 细胞药物处理 参照文献[9-10]TGF-β2刺激浓度为10 ng/mL,二甲基亚枫溶解的RSG为5 μmol/L、10 μmol/L、20 μmol/L及40 μmol/L。
1.4.4 RNA提取及PCR 使用Trizol试剂参照说明书提取总RNA,测定A260/A280吸光度判断纯度和浓度后取2 μL总RNA使用cDNA反转录试剂盒进行反转录DNA。PCR反应过程:反应体系25 μL,94 ℃预变性3 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共30个PCR循环,最后72 ℃总延伸10 min。琼脂糖凝胶电泳验证PCR产物,凝胶成像仪拍照。
表1 PCR引物序列

基因名称 序列大小(bp)PPAR-γPPARγ-F,5′-GCCCTTTACCACAGTTGATTTC-3′252PPARγ-R,5′-GATGCTTTATCCCCACAGACTC-3′FGF-R1FGFR1-F,5′-GGAGGAGAGAGTGAGAGGATGA-3′333FGFR1-F,5′-TGAGTGGTGTGGGTTTGAATAA-3′PDGFR-βPDGFR-β-F,5′-GTGGTCCTTACCGTCATCTCTC-3′312PDGFR-β-R,5′-CTTCTCGCTACTTCTGGCTGTC-3′β-actinβ-actin-F,5′-ATATCGCTGCGCTGGTCGTC-3′500β-actin-R,5′-AGGATGGCGTGAGGGAGAGC-3′
1.4.5 细胞生长计数实验 相同密度的细胞分别接种于10 cm2培养皿中;细胞分为空白组、TGF-β2组(10 ng/mL)、罗格列酮组(5 μmol/L、10 μmol/L、20 μmol/L及40 μmol/L),TGF-β210 ng/mL +罗格列酮组(5 μmol/L、10 μmol/L、20 μmol/L及40 μmol/L),培养24、48、72 h后用血细胞计数板进行计数。
2 结果
2.1 RSG对C57BL/6小鼠肺成纤维细胞增殖的影响 从实验结果得出,在无TGF-β2刺激,C57BL/6细胞增殖随RSG浓度梯度增加和时间梯度增加受到抑制(*P=0.000);在有TGF-β2刺激,C57BL/6细胞增殖同样也随RSG浓度梯度增加和时间梯度增加而受到抑制(**P=0.001),说明罗格列酮存在抑制C57BL/6小鼠肺成纤维细胞生长的作用(见表2,图1)。
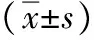

组别空白对照5μmol/LRSG10μmol/LRSG20μmol/LRSG40μmol/LRSG无TGF刺激4.45±0.013.82±0.01∗3.18±0.03∗2.50±0.03∗2.09±0.03∗有TGF刺激5.49±0.034.88±0.03∗∗3.93±0.03∗∗3.07±0.04∗∗2.34±0.02∗∗
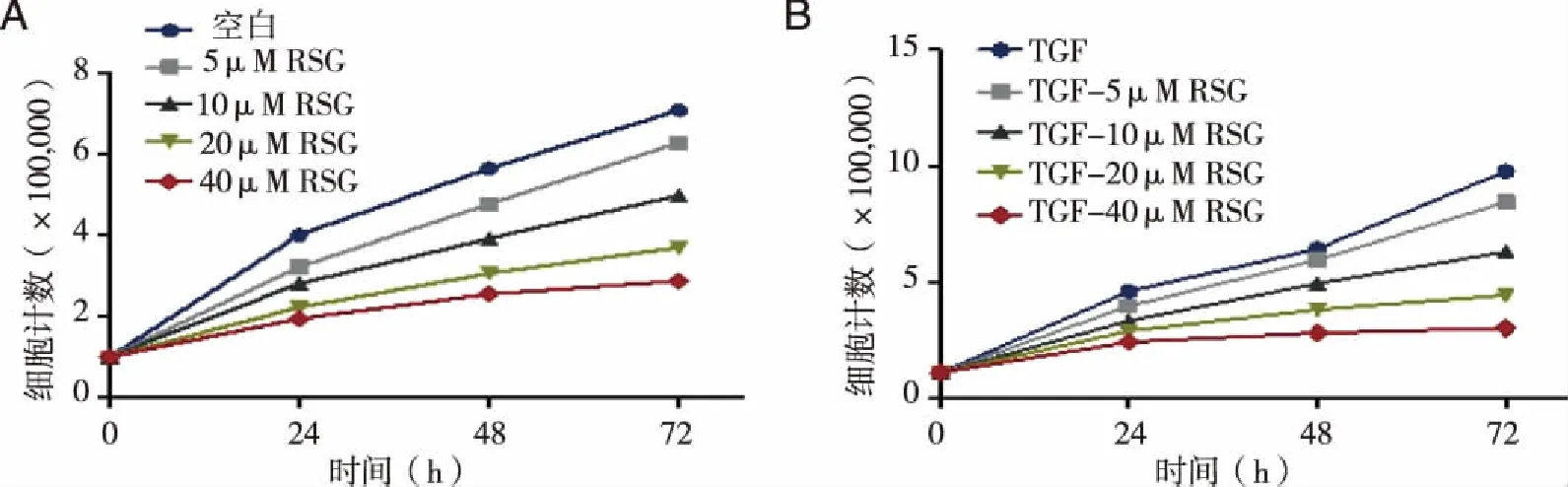
A:未使用TGF-β2刺激; B:使用TGF-β210 ng/mL刺激。图1 PSG对C57BL/6小鼠肺成纤维细胞增殖影响
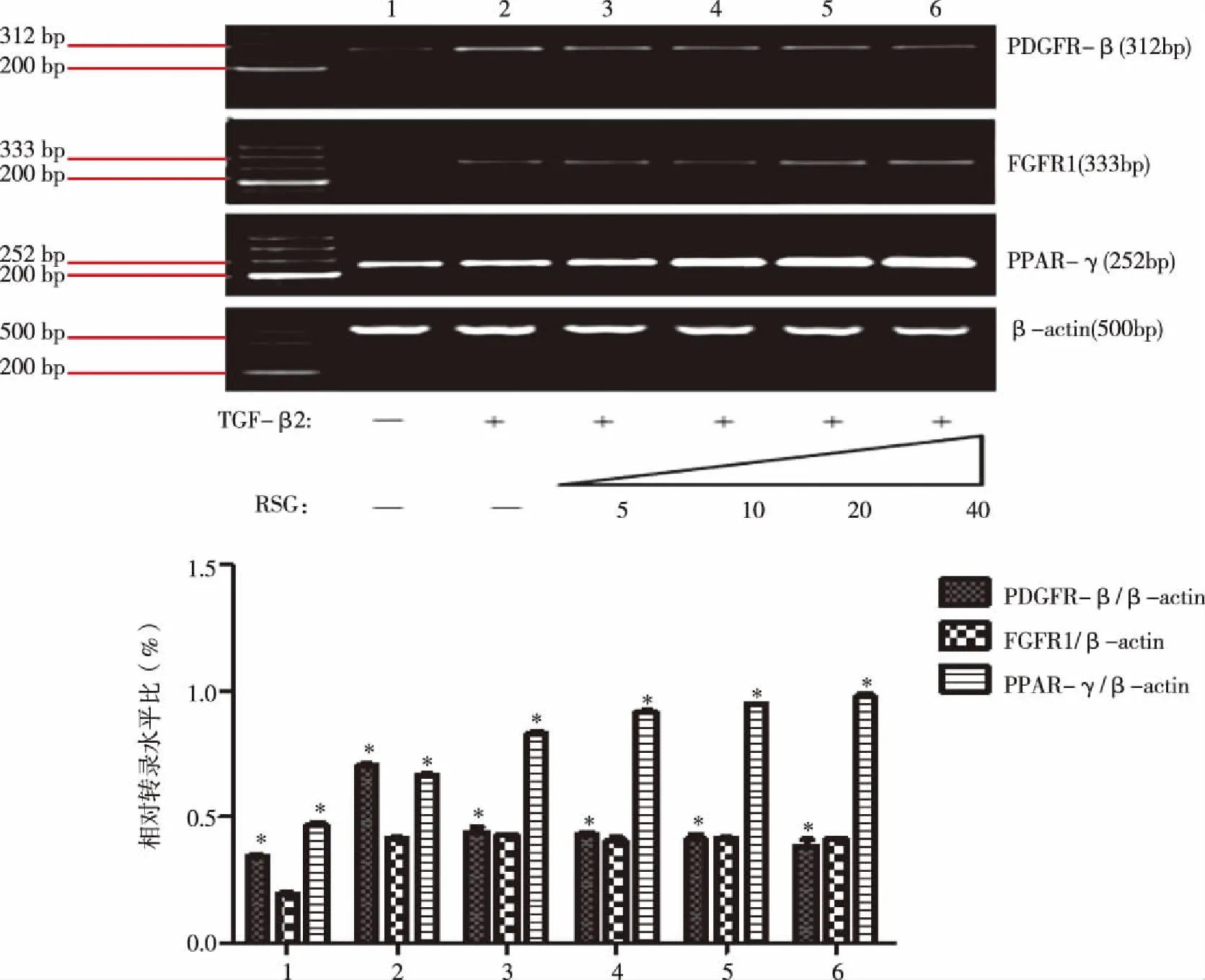
1:空白;2:TGF-β2;3:TGF-β2+RSG 5 μm;4:TGF-β2+RSG 10 μm;5:TGF-β2+RSG 20 μm;6:TGF-β2+RSG 40 μm。图2 PPAR-γmRNA、PDGFR-βmRNA、FGFR1mRNA在不同RSG刺激下表达
2.2 RSG对PPAR-γmRNA、PDGFR-βmRNA、FGF-R1mRNA 转录水平的影响 从实验结果得出,PPAR-γ mRNA转录水平随RSG浓度增加表达上调(*P=0.002)。PDGFR-β mRNA转录水平在TGF-β2刺激下表达上调,当加入RSG后,PDGFR-β mRNA转录水平随RSG浓度增加表达下调(**P=0.001)。FGFR1 mRNA表达水平在TGF-β2刺激下增加,当加入RSG后,FGFR1 mRNA表达水平无明显变化。说明罗格列酮增加PPAR-γ mRNA转录,抑制PDGF-β mRNA转录,对FGF mRNA转录无作用(见表3,图2)。
表3 PPAR-γ mRNA/PDGFR-β mRNA/FGFR1 mRNA光密度值
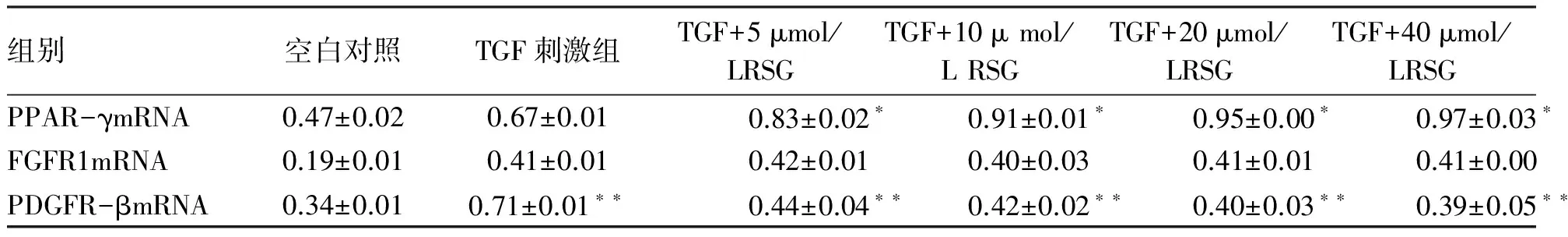
组别空白对照TGF刺激组TGF+5μmol/LRSGTGF+10μmol/LRSGTGF+20μmol/LRSGTGF+40μmol/LRSGPPAR-γmRNA0.47±0.020.67±0.010.83±0.02∗0.91±0.01∗0.95±0.00∗0.97±0.03∗FGFR1mRNA0.19±0.010.41±0.010.42±0.010.40±0.030.41±0.010.41±0.00PDGFR-βmRNA0.34±0.010.71±0.01∗∗0.44±0.04∗∗0.42±0.02∗∗0.40±0.03∗∗0.39±0.05∗∗
3 讨论
IPF是一种原因不明的进行性疾病,是局限于肺部的弥漫性肺泡炎和肺泡结构紊乱,最终导致以肺纤维化伴蜂窝状改变为特征的疾病,因其进展快、死亡率高,被世界卫生组织称为肺系疑难疾病。IPF病人经抗纤维化等药物治疗后,症状无改善,病死率无明显下降[11-14]。因此,对 IPF发病机制及治疗靶点研究已成为国际热点。
PPAR是一类配体激活的核转录因子超家族成员,具有多种生物学效应,在脂质代谢、抑制炎症反应、细胞分化、抑制细胞增殖和诱导细胞凋亡等方面发挥重要作用[15-17]。罗格列酮是目前研究最多的PPAR-γ经典合成配体[18-19],是PPAR-γ的高选择性、强效激动剂,与PPAR-γ亲和力最大,越来越多的证据显示,罗格列酮不仅在炎症反应免疫调节中发挥着重要作用,还参与某些器官纤维化进程,如皮肤和肝脏等[21]。我们实验组研究表明[13-14],姜黄素通过刺激PPAR-γ表达增加从而抑制PDGF-β下游信号通路的转导可能是阻止肺纤维化发生发展的关键。此外,Kulkarni[23]等研究表明,PPAR-γ配体RSG通过抑制FAK下游的PI3K/AKT信号通路转导来阻止肺纤维化发生。Deng[22]等研究表明,罗格列酮还可通过抑制TGF-β下游的SMAD3/4信号通路转导来抑制肺纤维化发生。Lin[24]等学者证实PPAR-γ促使PDGF-β表达下调后可进一步导致细胞周期阻滞及凋亡增加,细胞增殖及活力受到抑制,同样可以阻碍肺维化形成。
结合本实验结果,我们大胆推测,在TGF-β2诱导C57BL/6细胞分化过程中,TGF-β2促使PDGFR-β表达上调从而促使C57BL/6细胞增殖,然而RSG却通过刺激PPAR-γ表达增加来阻止PDGFR-β活化,导致细胞分化受到影响,纤维化形成减少,这可能与PDGF-β下游的PI3K/AKT、ERK及JNK信号通路转导受抑制导致细胞周期阻滞及凋亡增加有关,但是,为验证这一机制是否合理,我们还需要通过实验来深入探讨。
综上所述,PPAR-γ可能存在抗肺纤维化的作用,具体机制可能与PPAR-γ活化及PDGF-β表达下调相关。PPAR-γ配体对肺纤维化治疗可能存在潜在临床应用价值。
[1] Raghu G,Collard H R,Egan J J,et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J].American Journal of Respiratory and Critical Care Medicine,2011,183(6):788-824.
[2] Sakai N,Tager A M.Fibrosis of two:epithelial cell-fibroblast interactions in pulmonary fibrosis[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2013,1832(7):911-921.
[3] Nathan S D,Shlobin O A,Weir N, et al.Long-term course and prognosis of idiopathic pulmonary fibrosis in the new millenniumIdiopathic pulmonary fibrosis[J].Chest Journal,2011,140(1):221-229.
[4] Raghu G,Anstrom K J,King Jr T E,et al. Prednisone,azathioprine,and N-acetylcysteine for pulmonary fibrosis[J].The New England Journal of medicine,2012,366(21):1968-1977.
[5] 龚玲,刘代顺.特发性肺纤维化发病机制及血管新生作用的研究进展[J].医学研究生学报,2014,27(3):326-329.
[6] Olson A L,Swigris J J.Idiopathic pulmonary fibrosis:diagnosis and epidemiology[J].Clinics in Chest Medicine,2012,33(1):41.
[7] Vancheri C,du Bois R M.A progression-free end-point for idiopathic pulmonary fibrosis trials:lessons from cancer[J].European Respiratory Journal,2013,41(2):262-269.
[8] 陈晓铭,吴关芬,郑坤杰,等.罗格列酮对2型糖尿病大鼠胰岛β细胞增殖与再生的影响[J].实用医学杂志,2014,30(8):1193-1195.
[9] Ma B,Kang Q,Qin L,et al.TGF-β2 induces transdifferentiation and fibrosis in human lens epithelial cells via regulating gremlin and CTGF[J].Biochemical and Biophysical Research Communications,2014,447(4):689-695.
[10]Hogan C M,Thatcher T H,Sapinoro R E, et al.Electrophilic PPAR γ ligands attenuate IL-1β and silica-Induced inflammatory mediator production in human lung fibroblasts via a PPAR γ-independent mechanism[J].PPAR Research,2011,2011 (3) :318134.
[11]向敏,赵勇,王先梅.MMP-7在IPF中的水平及意义[J].遵义医学院学报,2012,35(5):400-403.
[12]罗敏,舒磊,李映莹,等.人参茎叶总皂苷抑制肺纤维化小鼠血清氧化水平的研究[J].遵义医学院学报,2016,39(3):260-265.
[13]龚玲,刘代顺,林江,等.姜黄素对TGF-β_2刺激下小鼠肺成纤维细胞PPAR-γ/PDGF-β信号通路的影响[J].中国中西医结合杂志,2015,35(10):1249-1254.
[14]Liu D,Gong L,Zhu H,et al.Curcumin inhibits transforming growth factor β induced differentiation of mouse lung fibroblasts to myofibroblasts[J].Frontiers in Pharmacology,2016,7:419.
[15]Levytska K,Drewlo S,Baczyk D.PPAR-γ regulates trophoblast differentiation in the Bewo cell model[J].PPAR Research,2014,2014.
[16]Ji P,Drackley J K,Khan M J,et al. Overfeeding energy upregulates peroxisome proliferator-activated receptor (PPAR) γ-controlled adipogenic and lipolytic gene networks but does not affect proinflammatory markers in visceral and subcutaneous adipose depots of Holstein cows[J].Journal of Dairy Science,2014.
[17]Ellis H P,Kurian K M.Biological rationale for the use of PPARγ agonists in glioblastoma[J].Frontiers in Oncology,2014,4.
[18]Samah M,El-Aidy A E R,Tawfik M K,et al.Evaluation of the antifibrotic effect of fenofibrate and rosiglitazone on bleomycin-induced pulmonary fibrosis in rats[J].European Journal of Pharmacology,2012,689(1):186-193.
[19]Liu Y,Dai B,Xu C,et al.Rosiglitazone inhibits transforming growth factor-β1 mediated fibrogenesis in ADPKD cyst-lining epithelial cells[J].Plos One,2010,6(12):e28915-e28915.
[20]Yang L,Stimpson S A,Chen L, et al.Effectiveness of the PPARγ agonist,GW570,in liver fibrosis[J].Inflammation Research,2010,59(12):1061-1071.
[21]Higashi K,Oda T,Kushiyama T,et al.Additive antifibrotic effects of pioglitazone and candesartan on experimental renal fibrosis in mice[J].Nephrology,2010,15(3):327-335.
[22]Deng Y L,Xiong X Z,Cheng N S.Organ fibrosis inhibited by blocking transforming growth factor-β signaling via peroxisome proliferator-activated receptor γ agonists[J].Hepatobiliary Pancreat Dis Int,2012,11(5):467-478.
[23]Kulkarni AA,Thatcher T H,Olsen K C,et al. PPAR-γ ligands repress TGFβ-induced myofibroblast differentiation by targeting the PI3K/Akt pathway:implications for therapy of fibrosis[J].Plos One,2011,6(1):e15909.
[24]Lin J,Chen A.Activation of peroxisome proliferator-activated receptor-γ by curcumin blocks the signaling pathways for PDGF and EGF in hepatic stellate cells[J].Laboratory Investigation,2008,88(5):529-540.
[收稿2017-09-11;修回2017-10-12]
(编辑:谭秀荣)
AntifibroticeffectsofPPAR-γinmouselungfibroblasts
GongLing,LiuDaishun,ZhuHonglan
(Department of Respiratory Medicine,The Third Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563002)
ObjectiveTo explore the role and mechanism of PPAR-γ in inhibiting the fibrosis process of mouse lung fibroblasts.MethodsMouse lung fibroblasts from C57BL/6 mice were cultured,stimulated for transformation with transforming growth factor β2,and inhibited for transition by different concentrations of rosiglitazone (RSG).Cell proliferation was detected by cell counting ,PCR was employed to examine transcriptional expression of PPAR-γ,platelet derived growth factorR-β (PDGFR-β) ,and fibroblast growth factor R1(FGFR1).ResultsRSG inhibited C57BL/6 fibroblast proliferation (P<0.05).The relative levels of PPAR-γ mRNA and PPAR-γ protein increased with the increasing concentration of RSG,and the expression of PDGFR-β mRNA decreased with the increasing concentration of RSG.The concentration alteration of RSG had nothing to do with the expression of FGFR1 mRNA(P<0.05).ConclusionRSG can inhibit the induction of TGF-β2 in alterations of biological characteristics of C57BL/6 fibroblasts.Possibly,it activates the PPAR-γ and downregulates the expression of PDGF-β.
peroxisome proliferator-activated receptor γ;pulmonary fibrosis;transforming growth factor β2;rosiglitazone;platelet derived growth factor β
贵州省卫计委基金资助项目(NO:gzwkj2013-1-003)。
刘代顺,男,博士,主任医师,硕士生导师,研究方向:慢性呼吸道疾病的分子机制;胸部肿瘤的靶向治疗,E-mail:ldsdoc@126.com。
R563
A
1000-2715(2017)06-0626-05
