三角帆蚌钩介幼虫寄生包囊在3种鱼鳃丝上的形成规律
2017-12-27邹军张呈祥闻海波马学艳徐良华丹顾若波
邹军,张呈祥,闻海波,马学艳,徐良,华丹,顾若波
三角帆蚌钩介幼虫寄生包囊在3种鱼鳃丝上的形成规律
邹军1,张呈祥2,闻海波3,马学艳3,徐良1,华丹3,顾若波3
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.江阴水产指导站,江苏江阴214443;3.中国水产科学研究院淡水渔业研究中心,农业部淡水鱼类遗传育种与养殖生物学重点开放实验室,江苏无锡214081)
为揭示三角帆蚌Hyriopsis cumingii钩介幼虫寄生包囊的形成规律,选用黄颡鱼Pelteobagrus fulvidraco、鲤Cyprinus carpio和二次寄生黄颡鱼P.fulvidraco 3种鱼鳃丝为寄主,对三角帆蚌钩介幼虫进行了寄生试验,分析了不同宿主对钩介幼虫发育的影响,并对钩介幼虫在3种宿主鱼鳃丝上形成包囊的时间、寄生数量、包囊形成位置进行了形态学观察和比较。结果表明:在水温 (24±1)℃时,寄生于黄颡鱼鳃丝上的钩介幼虫第7天首次开始脱落稚蚌,第8天为脱落高峰期,直至第12天才从鱼体脱落完全;寄生于鲤鳃丝上的钩介幼虫在第4天就脱落完全且没有发现稚蚌。在扫描电镜下观察显示:三角帆蚌钩介幼虫首次寄生在黄颡鱼鳃丝基端3 h形成包囊,6 h幼虫在整片鳃丝形成包囊;三角帆蚌钩介幼虫在鲤鳃丝不能完全形成包囊;在二次寄生黄颡鱼鳃丝基端5 h形成包囊,8 h幼虫在整片鳃丝形成包囊,且三角帆蚌钩介幼虫首次寄生在黄颡鱼鳃上的寄生数量多于二次寄生黄颡鱼和鲤鳃上的寄生数量;三角帆蚌钩介幼虫主要寄生在鱼的鳃丝,很少寄生在鳃耙和鳃弓。
三角帆蚌;钩介幼虫;寄生包囊;寄主鱼
大部分淡水蚌类具有特殊的生活史,它们的钩介幼虫需要短暂寄生在鱼类或两栖类才能完成变态发育[1-3],未能寄生的钩介幼虫将沉入水底死亡[4]。不同蚌类对寄主的选择存在差异,如背角无齿蚌对寄主鱼的选择性不强,可以寄生于4种鱼类[5];褶纹冠蚌可寄生于鳙和尼罗罗非鱼,而不能寄生于黄颡鱼和鲤[6]。三角帆蚌Hyriopsis cumingii是中国优质的淡水育珠蚌品种之一。白志毅等[7]比较研究了三角帆蚌在5种养殖鱼体上的寄生效果,表明了无论寄苗密度高低、寄苗时间长短,黄颡鱼都是三角帆蚌钩介幼虫的最佳寄主;闻海波等[8]研究了三角帆蚌在黄颡鱼和罗非鱼体上的寄生效果,初步阐释了钩介幼虫寄生胁迫对寄主鱼血液营养成分的影响。Reis等[9]研究了Unio tumidiformis钩介幼虫寄生在9种鱼体上变态发育过程中宿主组织表面结构的变化及包囊的形成过程;Rogers-Lowery等[10]研究了U.imbecillis钩介幼虫在鱼体寄生包囊的形成过程。国内,王宏等[11]对三角帆蚌钩介幼虫寄宿阶段形态变化进行了初步观察。目前,关于三角帆蚌钩介幼虫在寄主鱼和非寄主鱼体上寄生包囊的形成过程及形态学差异尚未见相关报道。
本研究中,选取黄颡鱼Pelteobagrus fulvidraco和鲤Cyprinus carpio为宿主,进行了三角帆蚌钩介幼虫的寄生试验,并对幼虫寄生脱落与变态情况进行了统计分析,比较了幼虫寄生包囊在首次寄生及二次寄生于寄主鱼、非寄主鱼鳃丝中形成的时间、位置、数量差异,跟踪观察了寄生包囊脱落过程,分析探讨了蚌类钩介幼虫寄生包囊形成机制。本研究结果将为三角帆蚌的人工繁殖和自然资源保护提供理论指导,也为蚌类钩介幼虫选择性寄生变态发育的基础理论研究积累资料。
1 材料与方法
1.1 材料
试验用三角帆蚌取自中国水产科学研究院淡水渔业研究中心江阴保种基地。2016年6月,选取三角帆蚌孕育蚌,检查育儿囊中幼虫成熟情况。钩介幼虫成熟的判别参照闻海波等[8]的方法。
试验用黄颡鱼和鲤均取自中国水产科学研究院淡水渔业研究中心南泉养殖基地。选取体质健壮、规格相似的个体用于寄生试验,分别暂养在循环养殖系统内;试验前暂养一周,每天上下午各投喂专用配合饲料一次,试验前1 d停止投喂。其中首次寄生黄颡鱼的体质量为 (50.3±1.9)g,体长为(16.2±0.59)cm; 鲤体质量为 (93.6±3.7)g,体长为 (20.9±0.5)cm;二次寄生黄颡鱼体质量为 (48.0±2.1)g, 体长为 (15.7±0.51)cm。 二次寄生黄颡鱼为首次寄生幼虫脱落完全后暂养一周的黄颡鱼,再次用于寄生试验。
1.2 方法
1.2.1 三角帆蚌钩介幼虫的寄生 将含有成熟钩介幼虫的母蚌外壳洗净、阴干2 h,然后放入盛水的盆中,水刚好浸没蚌的排水口,30 min后,母蚌会排出絮状物即钩介幼虫,待其排放到一定数量后,取出母蚌,用曝气的自来水将钩介幼虫附着的黏液和污物等冲洗干净。将钩介幼虫均匀分成3份,搅匀,形成钩介幼虫悬液,然后分别放入首次寄生黄颡鱼、二次寄生黄颡鱼、鲤各60尾进行寄生,寄生过程中不断搅拌水体以增加寄苗机会,寄生15 min后,将寄生鱼在清水中暂养5 min,便于清洗鱼体表黏附并未寄生的幼虫。将鲤、首次寄生黄颡鱼、二次寄生黄颡鱼分别放在3个大水箱(80 cm×55 cm×50 cm)中用曝气的自来水养殖,水温为 (24.0±0.5)℃。
1.2.2 幼虫脱落及变态率统计 按上述寄生方法,寄生后随机取首次寄生的黄颡鱼和鲤各9尾,每个箱子放养3尾,每组设置3个重复,两组鱼一共放在6个养殖箱中 (50 cm×38 cm×22 cm)用充分曝气的自来水养殖;在寄生后2 h时及每天18:00时,采用虹吸法吸取脱落的幼虫和稚蚌,具体参考闻海波等[12]的方法。在CX41型光学显微镜 (O-lympus)下观察钩介幼虫是否完成变态,并统计脱落的钩介幼虫数量及变态稚蚌的数量,变态判断标准参照闻海波等[12]的方法。幼虫变态率计算方法如下:
变态率=变态稚蚌数量/钩介幼虫总数×100%。
1.2.3 鱼体鳃丝上钩介幼虫寄生包囊的形成观察寄生后每隔1 h取寄生鱼鳃丝一次,连续取样至第8 h、24 h、48 h,之后每天取样一次,直至钩介幼虫或稚蚌全部脱落,从3组试验鱼每组取3尾,分别记录试验鱼的体质量和体长后,取鳃丝用pH为7.2的磷酸盐缓冲液冲洗3次,分别固定在体积分数为2.5%戊二醛溶液中,置于4℃条件下保存待用。
扫描电镜样品的制备参考闻海波等[12]的方法。样品经梯度脱水置换后在ES-2030型冷冻干燥仪(Hitachi公司)上冷冻干燥,用E-1010/E离子溅射仪 (Hitachi公司)喷金 (厚度10 nm),采用S-3000N扫描电镜 (Hitachi公司)观察并拍照。
1.3 数据处理
采用SPSS 20软件对试验数据进行统计分析,使用Photoshop 7.0软件处理图片。
2 结果与分析
2.1 钩介幼虫在两种鱼体上寄生脱落及变态情况
2.1.1 寄生黄颡鱼体上的幼虫及稚蚌脱落数量变化 寄生于黄颡鱼的钩介幼虫及稚蚌脱落及变态情况如图1所示。从图1可见:寄生后2 h时,幼虫大量脱落,占脱落幼虫总数的21.2%;寄生后第5、6天时,虹吸箱子底部未发现脱落的幼虫;寄生后第7天时,发现开始变态的稚蚌,当天脱苗变态率近15%;寄生后第8天时,幼虫出现第二次脱落高峰,占脱落幼虫总数的39.2%且显著高于其他脱落时期,当天脱苗变态率近62%,直至第12天时全部脱落。
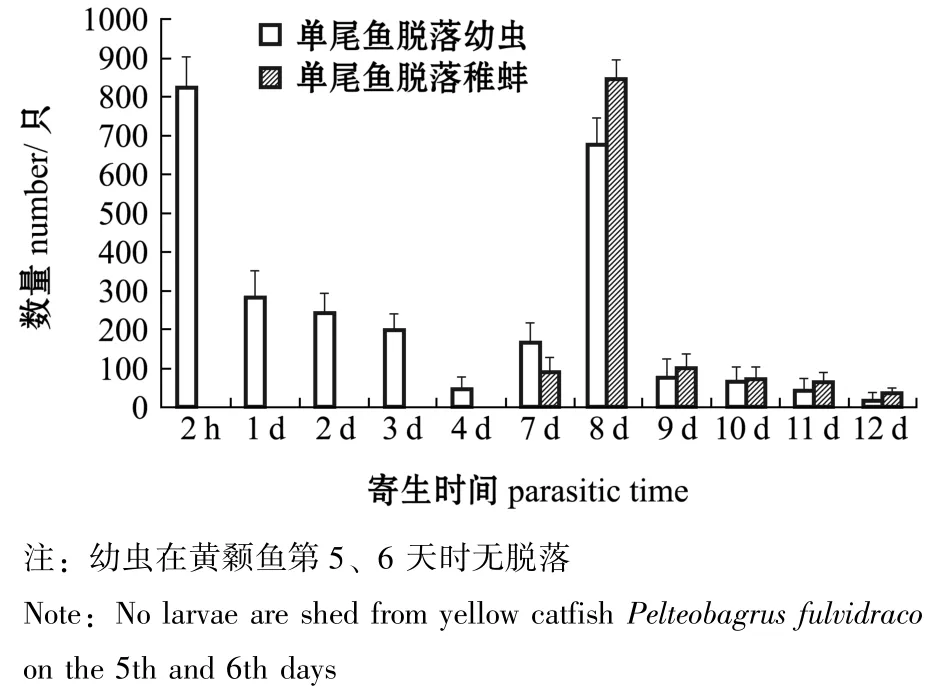
图1 寄生在单尾黄颡鱼鳃上的钩介幼虫脱落及变态数量Fig.1 Number of detached and metamorphated glochidia infested on yellow catfish Pelteobagrus fulvidraco
2.1.2 寄生鲤体上的幼虫及稚蚌脱落数量变化寄生在鲤体上的钩介幼虫及稚蚌脱落情况如图2所示。从图2可见:寄生后2 h时,幼虫脱落量为3380±142只,占脱落幼虫总数的63%;寄生后2~24 h时,幼虫脱落量为872±98只,占脱落幼虫总数的16%;寄生后第2、3天时分别脱落780±68、604±24只,寄生后第4天时,脱落量为24±5只;寄生后第5天时,虹吸箱子底部没有发现脱落的幼虫;自始至寄生后第12天,未发现变态稚蚌。进一步检查寄生鱼的鳃丝和鳍条,未发现有幼虫寄生,表明鲤为三角帆蚌钩介幼虫的非寄主鱼。
2.2 钩介幼虫寄生包囊在3种鱼鳃丝上的形成时间
在水温 (24±1)℃条件下,幼虫双壳机械入侵鱼鳃丝,双壳关闭,依靠腹缘壳钩嵌入寄生鱼鳃组织中。首次寄生黄颡鱼鳃丝基部的幼虫,寄生后2 h,开始形成包囊,包囊约包裹幼虫表面积的30%(图3-A);寄生后4 h,寄生在鳃丝基部的幼虫形成完整的包囊,而鳃丝游离端尚未全部形成包囊(图3-B);至寄生6 h时,鳃丝寄生幼虫表面包囊全部形成 (图3-C)。
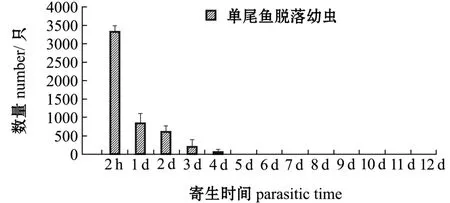
图2 寄生在单尾鲤鳃上的钩介幼虫脱落数量Fig.2 Number of detached glochidia infested on common carp Cyprinus carpio
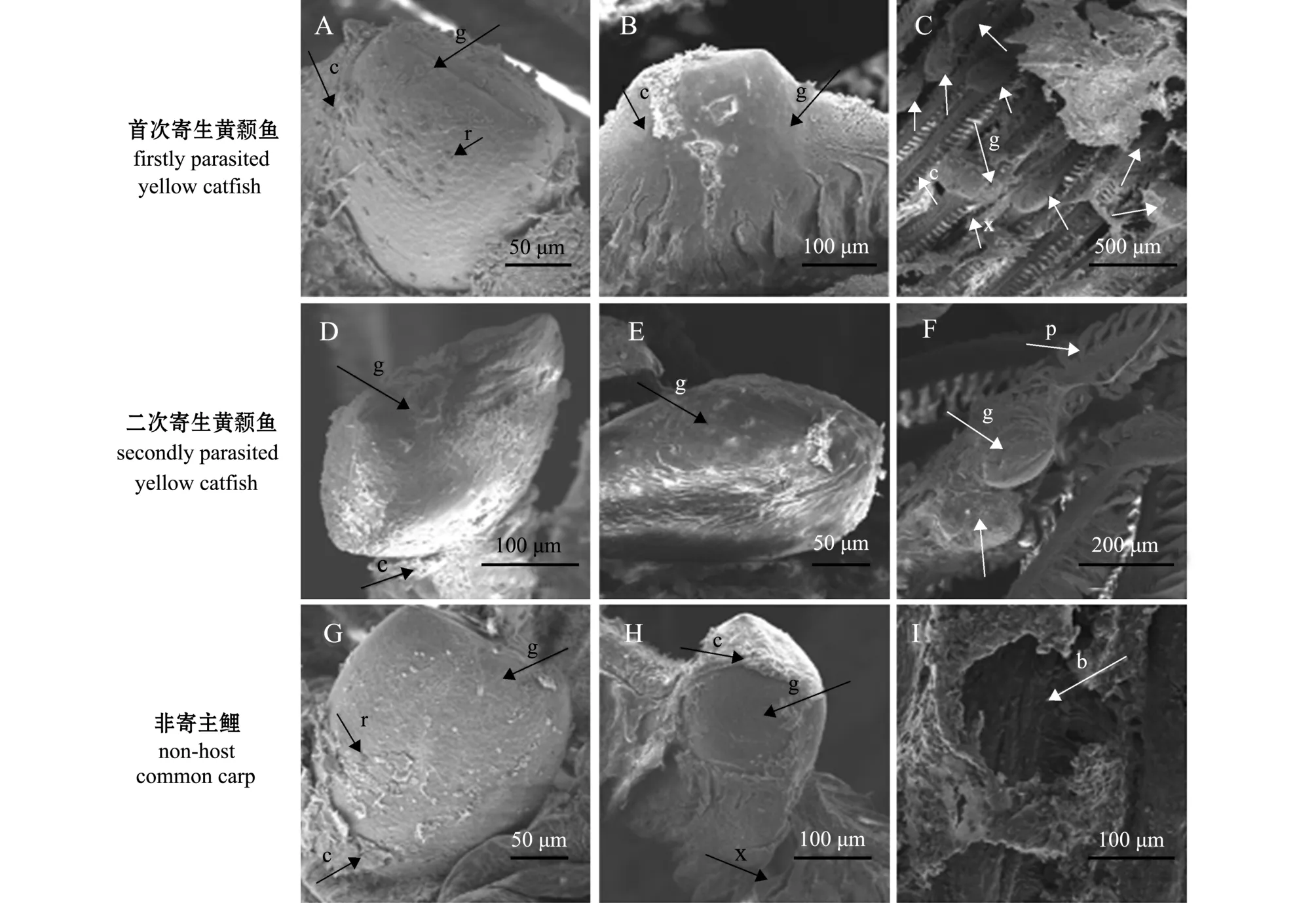
图3 三角帆蚌钩介幼虫在3中鱼鳃丝寄生包囊的形成差异Fig.3 Morphological comparison of cysts in glochidia of freshwater pearl mussel Hyriopsis cumingii on gill filaments of the host fish
在二次寄生黄颡鱼鳃丝基部的幼虫,寄生后2 h,开始形成包囊,包囊约包裹幼虫表面积的10%(图3-D);寄生后5 h,寄生在鳃丝基部的幼虫形成完整的包囊,而鳃丝游离端尚未全部形成 (图3-E);至寄生8 h时,鳃丝寄生幼虫表面包囊全部形成 (图3-F)。这表明,在首次寄生鱼鳃丝形成完整包囊时间明显快于二次寄生鱼。
在非寄主鱼鲤的鳃丝基部,寄生后2 h,包囊约包裹幼虫表面积的15%(图3-G);寄生后4 h,包囊约包裹幼虫表面积的80%左右 (图3-H);通过对5 h~8 h、24 h的样品进行观察,未发现有完全形成包囊的钩介幼虫;寄生后4 d,仅观察到幼虫脱落后的咬痕 (图3-I),且鳃丝、鳃弓、鳃耙上均未观察到幼虫和寄生包囊。
2.3 钩介幼虫在首次和二次寄生黄颡鱼鳃丝上的寄生数量、位置和先后顺序
在扫描电镜下,寄生后8 h,首次寄生黄颡鱼每片鳃上钩介幼虫寄生量为2.6±0.8只,二次寄生黄颡鱼每片鳃上钩介幼虫寄生量为1.0±0.5只,二者之间有显著性差异 (p<0.05)(图4-A、C),这表明首次寄生黄颡鱼的寄生数量显著大于二次寄生黄颡鱼的寄生数量。钩介幼虫主要寄生在鳃丝上,在鳃弓和鳃耙基本无寄生的钩介幼虫 (图4-A、C)。寄生后4 h,钩介幼虫在首次寄生黄颡鱼同一个鳃丝基部已形成完整的寄生包囊(图3-B),而鳃丝游离端尚未形成完整的包囊 (图4-B);寄生后5 h,幼虫在二次寄生黄颡鱼鳃丝基端已形成完整的包囊 (图3-E),而鳃丝游离端的幼虫壳顶尚未形成包囊 (图4-D)。观察结果表明,钩介幼虫在同一个鳃丝基部包囊形成速度明显大于鳃丝游离端。

图4 三角帆蚌钩介幼虫在寄主鱼鳃丝上的寄生量及位置Fig.4 Number and position of the larvae of Hyriopsis cumingii in the host fish
2.4 寄主鱼鳃丝上钩介幼虫的脱落情况
寄生后7 d时,首次寄生黄颡鱼每根鳃丝基部的幼虫数量为2.6±1只,鳃丝游离端幼虫数量为1.2±0.5只,二者有显著性差异 (p<0.05)(图5-A、B);寄生后8 d时,首次寄生黄颡鱼每根鳃丝基部幼虫数量为1.6±0.4只,鳃丝游离端幼虫数量为1.0±0.2只,且每片鳃基部出现大量幼虫脱落后痕迹 (图5-C),鳃丝游离端幼虫包囊未出现破囊现象 (图5-D);寄生后12 d时,寄主鱼鳃丝基端和游离端都未发现包囊,幼虫脱落后留下咬痕 (图5-E、F),这表明,相同时间点钩介幼虫在寄主鱼鳃丝基部的脱落率高于鳃丝游离端。
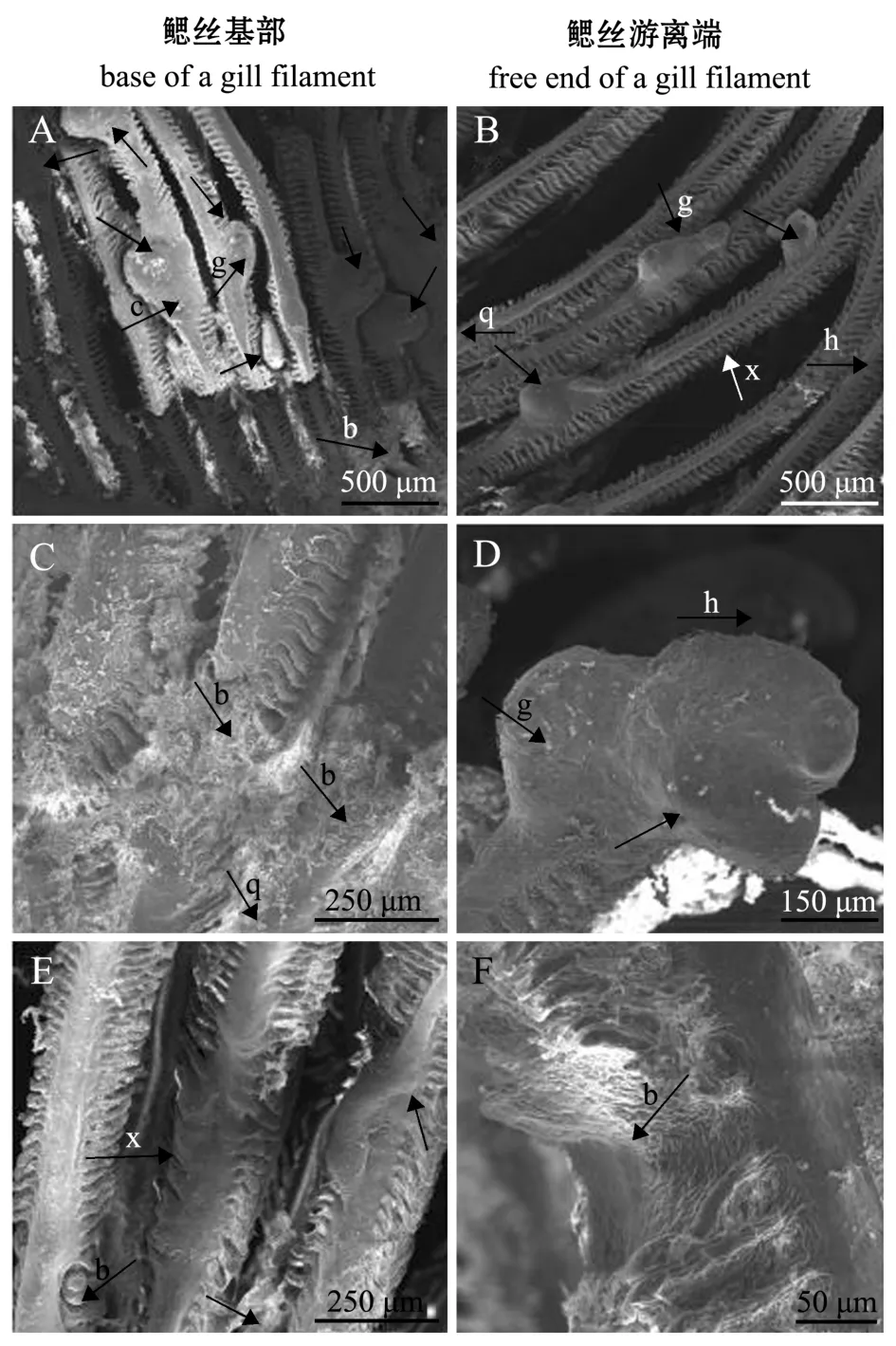
图5 三角帆蚌钩介幼虫在首次寄生黄颡鱼鳃丝上的脱落情况Fig.5 Shedding of the glochidia of freshwater pearl mussel Hyriopsis cumingii on gill filaments of the host fish
3 讨论
3.1 蚌类钩介幼虫对寄主鱼的选择性差异
在人工寄生条件下,由于钩介幼虫对鱼的选择不同,其寄生效果也存在显著性差异。王玉凤等[13]对刻裂丽蚌Lamprotula scripta钩介幼虫的寄主鱼筛选研究发现,16种鱼类中有5种可以使钩介幼虫成功变态;华丹等[14]对圆背角无齿蚌Anodonta woodiana的研究结果表明,罗非鱼是其比较合适的寄主鱼;白志毅等[7]对三角帆蚌钩介幼虫在5种寄主鱼体的寄生效果进行了比较,无论是寄生量还是在稚蚌脱苗率方面,黄颡鱼与草鱼均是三角帆蚌钩介幼虫的最佳寄主。Isom等[15]研究认为,钩介幼虫对寄主的高选择性并非取决于对寄主鱼的营养选择,而更可能与寄主的免疫系统有关。本试验结果表明,黄颡鱼是三角帆蚌的寄主鱼,与白志毅等[7]的研究结果相符,而鲤是非寄主鱼。可以推测,两种鱼鳃的组织结构不同,受免疫反应所产生的物质识别作用也不同,从而使得三角帆蚌钩介幼虫寄生于鲤鳃时不能发育至稚蚌。此结论还需要进一步来证明。
3.2 钩介幼虫在不同鱼鳃上包囊形成差异
寄主鱼鳃丝上的表皮细胞对幼虫形成包囊的过程是快速的,并且通常在6 h内覆盖幼虫[16];Rogers-lowery等[10]研究了U.imbecillis钩介幼虫于鱼体寄生并在130 min内形成包囊;有的蚌科幼虫在鱼鳃丝形成包囊的时间较短[17-18],有的蚌科幼虫在鱼鳃丝上形成包囊的时间较长[19-20];Reis等[9]研究了珠蚌类的钩介幼虫寄生在9种鱼体时,其在变态中宿主组织表面结构的变化及包囊的形成过程,结果表明,9种鱼形成包囊的时间不同。
本试验结果表明,三角帆蚌钩介幼虫在首次寄生黄颡鱼鳃基端形成包囊时间比二次寄生黄颡鱼鳃基端早2 h左右。而寄生在鲤鳃丝表面的幼虫未形成完整的包囊,当包囊包裹幼虫表面积的75%左右时就开始脱落,没有发育至稚蚌。可能是由于寄生鱼生理指标、免疫物、营养物含量不同等原因造成的,还需进一步验证。但可以推测:不仅鱼的种类对三角帆蚌钩介幼虫形成包囊速度有一定的影响,而且同种寄主鱼在不同生理条件下对幼虫形成包囊速度也有显著差异,表明影响钩介幼虫形成寄生包囊速度的因素很多,既受鱼种类的影响,也受鱼生理条件的影响。
3.3 三角帆蚌钩介幼虫寄生包囊在首次及二次寄生黄颡鱼鳃丝上的寄生量及位置差异
杜兴伟[21]选取褶纹冠蚌Cristaria plicata钩介幼虫寄生于寄主鱼鲤,结果表明,钩介幼虫寄生胁迫对寄主鱼的呼吸代谢、营养代谢和免疫方面均产生不同程度的影响。罗芬等[22]研究了黄颡鱼鳃超微结构,鳃小片中有微血管且表皮很薄。本研究表明:三角帆蚌钩介幼虫主要寄生在寄主鱼鳃丝上,可能是因鳃小片表皮很薄更容易寄生和吸取寄主的营养。三角帆蚌钩介幼虫在首次寄生黄颡鱼鳃丝上形成的寄生包囊数量显著多于二次寄生黄颡鱼,可以推测,第一次寄生幼虫吸收鱼体大量的营养物质,鱼体呼吸作用下降,使得幼虫再次寄生对寄生量有一定的影响。此结论还需进一步验证。
3.4 钩介幼虫寄生包囊脱落的影响因素
闻海波等[23]对圆背角无齿蚌寄生变态发育的观察结果表明,在水温为 (19±1)℃时,钩介幼虫需要约13 d的寄生变态才能从鱼体脱落;白志毅等[24]研究表明,三角帆蚌钩介幼虫发育到有效积温时发育成稚蚌并开始脱落;本试验结果表明,在水温为 (24±1)℃时,钩介幼虫需要约7 d的寄生变态才能从鱼体脱落,且同一时间点鱼鳃丝基部的钩介幼虫脱落率高于鱼鳃丝游离端,推测可能是鱼鳃丝基部的钩介幼虫更容易吸收营养,导致脱落较早。关于钩介幼虫脱落的部位及脱落方式是否与营养和鱼鳃的分泌物有关值得进一步探究。
[1] Barnhart M C,Haag W R,Roston W N.Adaptations to host infection and larval parasitism in Unionoida[J].Journal of the North A-merican Benthological Society,2008,27(2):370-394.
[2] Uthaiwan K,Noparatnaraporn N,Machado J.Culture of glochidia of the freshwater pearl mussel Hyriopsis myersiana(Lea,1856)in artificial media[J].Aquaculture,2001,195(1-2):61-69.
[3] 刘月英.中国经济动物志 淡水软体动物[M].北京:科学出版社,1979.
[4] 张根芳,方爱萍,李家乐.淡水蚌类繁殖生物学研究进展[J].水产学报,2005,29(4):560-564.
[5] 徐云涛.两种蚌类钩介幼虫选择性寄生机制的初步研究[D].南京:南京农业大学,2016.
[6] Ma X Y,Wen H B,Zou J,et al.An improved method for in vitro culture of glochidia in freshwater mussel Cristaria plicata(Mollus-ca,Bivalvia)[J].Hydrobiologia,2017:1-12,doi:10.1007/s1075 0-016-3012-3.
[7] 白志毅,李家乐,潘彬斌.三角帆蚌钩介幼虫在5种寄主鱼体寄生效果的比较[J].淡水渔业,2008,38(1):3-5,43.
[8] 闻海波,邱丽华,顾若波,等.三角帆蚌钩介幼虫在两种寄主鱼上的寄生效果及其对寄主鱼血浆生化指标的影响[J].动物学杂志,2009,44(5):92-97.
[9] Reis J,Collares-Pereira M J,Araujo R.Host specificity and metamorphosis of the glochidium of the freshwater mussel Unio tumidiformis(Bivalvia:Unionidae)[J].Folia Parasitologica,2014,61(1):81-89.
[10] Rogers-Lowery C L,Dimock R V Jr.Encapsulation of attached ectoparasitic glochidia larvae of freshwater mussels by epithelial tissue on fins of naïve and resistant host fish[J].The Biological Bulletin,2006,210(1):51-63.
[11] 王宏,李家乐,汪桂玲,等.三角帆蚌钩介幼虫寄宿阶段形态变化的初步研究[J].上海海洋大学学报,2007,16(4):394-398.
[12] 闻海波,顾若波,华丹,等.三角帆蚌钩介幼虫体外培养及变态稚贝的形态变化[J].武汉大学学报:理学版,2011,57(1):75-62.
[13] 王玉凤,魏青山,彭宇.刻裂丽蚌钩介幼虫对寄主鱼的选择[J].华中师范大学学报:自然科学版,2001,35(1):72-76.
[14] 华丹,徐钢春,闻海波,等.3种寄生鱼对圆背角无齿蚌寄生效果的研究[J].浙江海洋学院学报:自然科学版,2005,24(3):213-216.
[15] Isom B G,Hudson R G.In vitro culture of parasitic freshwater mussel glochidia[J].The Nautilus,1982,96(4):147-151.
[16] Waller D L,Mitchell L G.Gill tissue reactions in walleye Stizostedion vitreum and common carp Cyprinus carpio to glochidia of the freshwater mussel Lampsilis radiata siliquoidea[J].Diseases of A-quatic Organisms,1989,6:81-87.
[17] Arey L B.A microscopical study of glochidial immunity[J].Journal of Morphology,2005,53(2):367-379.
[18] Arey L B.The formation and structure of the glochidial cyst[J].The Biological Bulletin,1932,62(2):212-221.
[19] Jong K H.An ultrastructural study on the glochidium and glochidial encystment on the host fish[J].Korean Journal of Malacology,1989,5(5):1-9.
[20] Nezlin L P,Cunjak R A,Zotin A A,et al.Glochidium morphology of the freshwater pearl mussel(Margaritifera margaritifera)and glochidiosis of Atlantic salmon(Salmo salar):a study by scanning electron microscopy[J].Canadian Journal of Zoology,1994,72(1):15-21.
[21] 杜兴伟.钩介幼虫的寄生对寄生鱼呼吸代谢、营养指标及免疫指标的影响[D].南京:南京农业大学,2015:1-73.
[22] 罗芬,陈礼强,康斌.黄颡鱼(Pelteobagrus fulvidraco)鳃的超微结构研究[J].海洋与湖沼,2011,42(4):481-494.
[23] 闻海波,徐钢春,华丹.圆背角无齿蚌寄生变态发育的初步观察[J].上海海洋大学学报,2006,15(2):252-256.
[24] 白志毅,李家乐,杨光.三角帆蚌钩介幼虫发育的生物学零度和有效积温初步研究[J].特产研究,2008,30(1):12-14.
Parasitic encystments of glochidia of freshwater pearl mussel Hyriopsis cumingii on gill filaments of three fish species
ZOU Jun1, ZHANG Cheng-xiang2, WEN Hai-bo3, MA Xue-yan3, XU Liang1, HUA Dan3, GU Ruo-bo3
(1.Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081, China; 2.Jiangyin Aquatic Products Steering Station, Jiangyin 214443,China; 3.Key Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fisheries, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China)
Parasitic encystments of glochidia of freshwater pearl mussel Hyriopsis cumingii on gill filaments were investigated in three fish species including yellow catfish Pelteobagrus fulvidraco,common carp Cyprinus carpio and secondly parasited yellow catfish by glochidia of freshwater pearl mussel to evaluate effects of different host fish on development of the glochidia.Meanwhile, the time, node and location of encystment, and parasitic number of glochidium in gill filaments of the host fish were observed and morphologically compared.The results showed that the larvae began to fall off from the host fish in 7 days,the peak on the 8th day and were completely released from the host fish at water temperature of(24±1)℃.The larvae were found totally to fall off from the host common carp on the 4th day after successful adherent to the gills.The scanning electron microscope revealed that the cysts were observed at the base of gill filaments of yellow catfish in 3 hours,and that the whole gills were covered with cysts in 6 hours.No encystments were found on the gills of common carp.However,the cysts were appeared on the base of the secondly parasited yellow catfish in 5 hours,and covered the whole gills in 8 hours.There were more glochidia on the gills in yellow catfish than in the secondly parasited yellow catfish and common carp,primarily on the gill filaments rather than gill rakers and gill arches.
Hyriopsis cumingii; glochidium; parasitic cyst; host fish
Q954.4
A
10.16535/j.cnki.dlhyxb.2017.06.001
2095-1388(2017)06-0637-06
2017-04-08
江苏省自然基金面上项目 (BK20161145);中央基本科研业务费项目 (2015JBFM02)
邹军 (1990—),男,硕士研究生。E-mail:478955091@qq.com
顾若波 (1963—),男,研究员。E-mail:gurb@ffrc.cn
