四溴联苯醚慢性胁迫对大泷六线鱼生长及抗氧化酶活力的影响
2017-12-27张赛赛孙德启姜欣彤董安然王伟
张赛赛,孙德启,姜欣彤,董安然,王伟
四溴联苯醚慢性胁迫对大泷六线鱼生长及抗氧化酶活力的影响
张赛赛1、2,孙德启1,姜欣彤1,董安然1,王伟1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市水产技术推广总站,辽宁大连116023)
为研究四溴联苯醚 (BDE-47)慢性胁迫对大泷六线鱼Hexagrammos otakii的生物毒性效应,通过设置不同浓度的BDE-47探究了其对大泷六线鱼生长及抗氧化酶活力的影响,试验设置空白对照组和DMSO对照组以及5 ng/L(A组)、50 ng/L(B组)、500 ng/L(C组)、5 μg/L(D组)、50 μg/L(E组)5个BDE-47浓度组。结果表明:在本试验条件下,各组大泷六线鱼的存活率均为100%;BDE-47对大泷六线鱼生长存在剂量-效应关系,随着BDE-47浓度的增大,大泷六线鱼体长和体质量增长受到的影响也增大,尤其是BDE-47浓度在50 ng/L以上时,鱼体质量出现负增长;BDE-47对大泷六线鱼肝脏和肌肉中的超氧化物歧化酶 (SOD)和过氧化氢酶 (CAT)活力有显著影响,随养殖时间的延长,各浓度组肝脏SOD、CAT活力均呈先升高后降低的波动变化趋势;随着养殖时间的延长,高浓度组肌肉CAT活力呈先升高后降低的变化趋势,低浓度组肌肉CAT活力及各浓度组肌肉SOD活力均无明显变化趋势。研究表明,各浓度的BDE-47不同程度地抑制大泷六线鱼生长,其中体质量较体长对BDE-47的响应更敏感;在肝脏组织中,SOD和CAT活力对于污染物的胁迫反应比在肌肉组织中更敏感。
四溴联苯醚;大泷六线鱼;生长;超氧化物歧化酶
多溴联苯醚 (Polybrominated diphenyl ethers,PBDEs)是一类溴代二苯醚类化合物,包含209种同系物,其阻燃效率高、稳定性好,是一种溴系阻燃剂,在电子、电器、化工等领域中应用广泛[1]。PBDEs作为一种持久性有机污染物,挥发性及亲脂性极强,既可随空气和水进行迁移,也可随食物链生物富集和放大[2]。1981年,在瑞典的鮻鱼、鳗鲡和海鳟中PBDEs首次被检出,此后在多种环境介质、人体和生物材料中均发现PBDEs的存在,且其含量呈现逐年递增的趋势[3-4]。PBDEs作为一种普遍存在的持久性环境有机污染物,有关其对环境影响的研究已成为学界的一大热点。据相关资料记载,PBDEs对生物体肝、肾、神经系统、生殖系统、甲状腺均有显著影响[5-8]。四溴联苯醚(Tetrabromodiphenyl ether,BDE-47)是多溴联苯醚中分布最广、生物材料中含量最高、毒性最强的同系物之一[9-10]。目前,对其毒性的相关研究主要集中在环境分布、污染特征、环境行为和人体暴露等方面[2,11-12],而对环境中多溴联苯醚胁迫鱼类方面的研究资料甚少。
大泷六线鱼Hexagrammos otakii,俗称黄鱼,隶属于鲉形目 Scorpaeniformes、六线鱼科Hexagrammidae、六线鱼属Hexagrammos,属于冷温岩礁性鱼类,生活在近海底层,主要分布于中国的黄海和渤海沿岸,日本、韩国和朝鲜等国的近海亦有分布,是中国辽宁和山东省近海的常见鱼类。该鱼肉质细嫩、味美、营养丰富,被誉为 “北方石斑”。目前,对于该鱼的研究报道多集中在遗传多样性和繁殖生物学方面[13-15],而有关多溴联苯醚等持久性有机污染物对大泷六线鱼影响的研究尚未见报道。本研究中,采用毒性试验方法,探讨了BDE-47慢性胁迫对大泷六线鱼生长及抗氧化酶活力的影响,以期为多溴联苯醚的毒性机理和近海环境污染评价提供参考依据。
1 材料与方法
1.1 材料
试验用大泷六线鱼购自大连市旅顺开发区某养殖场,暂养于大连海洋大学农业部北方海水增养殖重点实验室。暂养用海水为沉淀和沙滤后的自然海水,水温为 (21±1)℃,盐度为32,pH为 (7.9±0.1)。
试验试剂主要有:四溴联苯醚 (CAS:5436-43-1,BDE-47)购自百灵威试剂公司;二甲基亚砜 (DMSO)购自上海生工生物工程有限公司;SOD试剂盒和CAT试剂盒均购自南京建成生物有限公司;其他试剂均购自沈联试剂公司。所有化学试剂均为分析纯。
1.2 方法
1.2.1 试验设计 试验鱼暂养7 d后,选取健康的大泷六线鱼用于试验。暂养期间,试验鱼不投喂任何饵料,每天换水1次。试验鱼驯养时间为10 d,驯养期间,将选取的健康试验鱼分别放入120 L聚乙烯水槽 (70 cm×40 cm×32 cm)中,每天投喂新鲜野杂鱼1次,换水1次。
试验鱼经驯化后开始正式试验。共设置空白对照组和DMSO对照组以及5 ng/L(A组)、50 ng/L(B 组)、 500 ng/L(C 组)、 5 μg/L(D 组)、 50 μg/L(E组)5个BDE-47浓度组。每组设3个重复,每个重复放20尾鱼。其中空白对照组不添加任何试剂,DMSO对照组只添加二甲基亚砜 (DMSO),浓度为25 μg/L。在试验开始前,测定每组大泷六线鱼的初始体长和体质量,试验期间每周测定一次试验鱼体长、体质量、肝脏和肌肉中的CAT和SOD活力,养殖试验共进行42 d。
1.2.2 粗酶液的制备 将样品鱼于冰盘上解剖,取其肝脏并除去其表面附着的结缔组织,用4℃预冷的去离子水冲洗干净,再用滤纸吸去表面水分,称取适量样品,按质量 (mg) ∶体积 (mL)比为1∶9加入4℃预冷的生理盐水,用玻璃匀浆器于冰浴中研磨匀浆。粗酶液于4℃下以4000 r/min离心10 min,取上清液备用。
1.2.3 酶活力的测定 总SOD活力和CAT活力的测定均按照试剂盒提供的测量方法进行。用南京建成生物有限公司的蛋白质试剂盒 (考马斯亮兰法)测定组织匀浆中的蛋白质含量。
1.2.4 生长指标的计算 试验鱼存活率 (%)、增重率 (%)和特定生长率 (%/d)计算公式如下:

其中:W0、Wt分别为试验初始和终末时试验鱼平均体质量 (g);t为养殖试验时间 (d);N0、Nt分别为试验初始和结束时试验鱼数量 (尾)。
1.3 数据处理
采用SPSS 19.0软件对试验数据进行双因素方差分析,对不同浓度不同时间的数据再进行单因素方差分析和Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同浓度BDE-47对大泷六线鱼生长的影响
从表1可见,随着养殖时间的延长,空白对照组和DMSO对照组大泷六线鱼体长均呈快速增长的趋势,A、B、C低浓度组体长呈现缓慢增长趋势,增长率较低,而D和E高浓度组体长呈平缓无增长的趋势。
从表1和表2可见:空白对照组、DMSO对照组和A组大泷六线鱼体质量均随养殖时间的延长呈快速增长的趋势,增重率分别为26.33%、9.97%、8.81%,特定生长率分别 3.89、1.58、1.41%/d;而B、C、D、E组体质量均呈负增长,增重率分别为-10.52%、-0.58%、-38.66%、-23.41%,特定生长率分别为-1.85、-0.10、-4.48、-4.45%/d;各组大泷六线鱼的存活率均为100%。
2.2 不同浓度BDE-47对大泷六线鱼肝脏SOD活力的影响
从图1可见:空白对照组和DMSO对照组大泷六线鱼肝脏SOD活力随养殖时间的延长无显著性变化 (P>0.05);各BDE-47浓度组随养殖时间的延长鱼肝脏SOD活力均呈现先升高后降低再升高的趋势 (p<0.05),其中A、B、C组SOD活力均在第六周时出现最高值,D组和E组在第二周时出现最高值。
多重比较结果表明:各浓度组肝脏SOD活力在第一周时与空白对照组相比无显著性差异 (P>0.05);第二周时,A、D和E组SOD活力均显著高于空白对照组 (p<0.05),分别为空白对照组的1.18、1.75、2.26倍,B组显著低于对照组 (p<0.05);第三周时,各BDE-47浓度组SOD活力均显著高于空白对照组 (p<0.05),A、B、C、D、E组分别为空白对照组的 1.33、1.48、1.42、1.61、1.76倍,可见各浓度组 BDE-47对肝脏SOD活力同时出现诱导效应,且浓度越高诱导作用越明显;第四周时,A、D和E组SOD活力显著高于空白对照组 (p<0.05),分别为空白对照组的1.12、1.10、1.22倍,可见各浓度组 BDE-47诱导作用已明显下降,有些浓度组SOD活力已恢复到空白对照组水平;第五周时,B和C组SOD活力显著低于空白对照组 (p<0.05),降幅分别为16.23%、27.64%,D和E组显著高于空白对照组(p<0.05),分别为空白对照组的1.24、1.32倍;
第六周时,A、B、C、D组均显著高于空白对照组(p<0.05),分别为空白对照组的 1.90、1.61、1.33、1.30倍 (p<0.05)。 结果表明,BDE-47对大泷六线鱼肝脏SOD活力的影响呈现出明显的诱导效应。

表1 各组试验鱼生长指标的变化Tab.1 Changes in growth indices of the fish in each experimental group

表2 四溴联苯醚对大泷六线鱼生长效应的影响Tab.2 Effect of tetrabromodiphenyl ether(BDE-47)on growth in fat greenling Hexagrammos otakii

图1 不同四溴联苯醚浓度组大泷六线鱼肝脏SOD活力随胁迫时间的变化Fig.1 Changes in hepatic SOD activity in fat greenling Hexagrammos otakii exposed to various concentrations of BDE-47 with exposure period
2.3 不同浓度BDE-47对大泷六线鱼肝脏CAT活力的影响
从图2可见:空白对照组和DMSO对照组大泷六线鱼肝脏CAT活力随养殖时间的延长无显著性变化 (P>0.05);各浓度组随养殖时间的延长均呈现先升高后降低的波动变化趋势 (p<0.05),其中各浓度组CAT活力的最高值均出现在第三周。

图2 不同四溴联苯醚浓度组大泷六线鱼肝脏CAT活力随胁迫时间的变化Fig.2 Changes in the hepatic CAT activity in fat greenling Hexagrammos otakii exposed to various concentrations of BDE-47 with exposure period
多重比较结果表明:各浓度组试验鱼肝脏CAT活力在第一周时与空白对照组相比无显著性差异 (P>0.05);第二周时,A和D组CAT活力均显著低于空白对照组 (p<0.05),B和C组显著高于空白对照组 (p<0.05);第三周时,各浓度组鱼的CAT活力均显著高于空白对照组 (p<0.05),分别为空白对照组的 1.74、1.76、1.71、1.74、2.11倍,可见各浓度组的BDE-47对鱼肝脏CAT活力同时出现显著的诱导效应,其中E组的诱导作用最明显;第四周时,各浓度组鱼的CAT活力均显著低于空白对照组 (p<0.05),分别为空白对照组的 62.88%、55.79%、52.41%、89.98%、85.26%;第五周时,A、C、D、E组鱼的CAT活力均显著高于空白对照组 (p<0.05),B组显著低于空白对照组 (p<0.05);第六周时,仅A组鱼的CAT活力显著高于空白对照组,其他各浓度组均显著低于空白对照组 (p<0.05)。
2.4 不同浓度BDE-47对大泷六线鱼肌肉SOD活力的影响
从图3可见:空白对照组和DMSO对照组大泷六线鱼肌肉SOD活力随养殖时间的延长无显著性变化 (P>0.05);各浓度组鱼 (除B组外)肌肉SOD活力均呈现先降低后升高的波动变化趋势(p<0.05),B组呈现先升高后降低的波动变化趋势,其中A组鱼肌肉SOD活力最高值出现在第四周,B组最高值出现在第五周,C、D、E组最高值均出现在第六周。
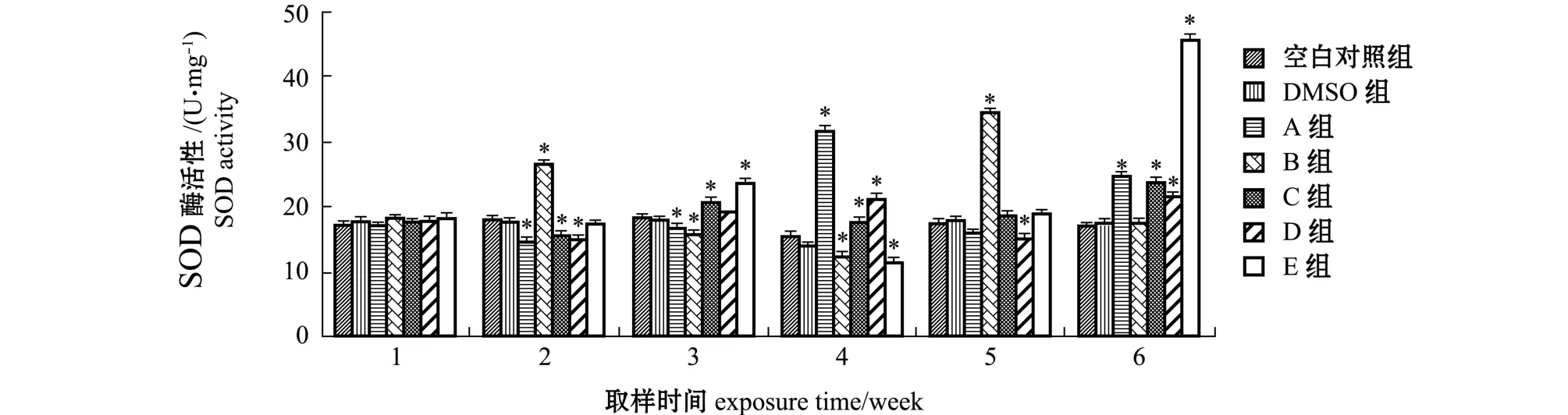
图3 不同四溴联苯醚浓度组大泷六线鱼肌肉SOD活力随胁迫时间的变化Fig.3 Changes in the muscular SOD activity in fat greenling Hexagrammos otakii exposed to various concentrations of BDE-47 with exposure period
多重比较结果表明:各浓度组肌肉SOD活力在第一周时与空白对照组无显著性差异 (P>0.05);第二周时,A、C和D组肌肉SOD活力均显著低于空白对照组 (P<0.05),而B组显著高于空白对照组 (P<0.05),为空白对照组的1.49倍;第三周时,A、B组鱼肌肉SOD活力均显著低于空白对照组 (P<0.05),C组和E组显著高于空白对照组 (P<0.05);第四周时,A、C、D组鱼肌肉SOD活力显著高于空白对照组 (P<0.05),分别为空白对照组的1.12、1.10、1.22倍,而B、E组SOD活力均显著低于空白对照组 (P<0.05);第五周时,B组鱼肌肉SOD活力显著高于空白对照组(P<0.05),D组显著低于空白对照组 (P<0.05),其他浓度组与对照组无显著性差异 (P>0.05);第六周时,各浓度组鱼肌肉SOD活力 (除B组外)均显著高于空白对照组 (P<0.05),分别为空白对照组的1.45、1.38、1.26、2.67倍,诱导作用明显。
2.5 不同浓度BDE-47对大泷六线鱼肌肉CAT活力的影响

图4 不同四溴联苯醚浓度组大泷六线鱼肌肉CAT活力随胁迫时间的变化Fig.4 Changes in the muscular CAT activity in fat Hexagrammos otakii greenling exposed to various concentrations of BDE-47 with exposure period
从图4可见:空白对照组、DMSO对照组和A组大泷六线鱼肌肉CAT活力随胁迫时间的延长呈现很平缓的变化,分析结果无显著性差异 (P>0.05);C、D和E组均呈现先升高后降低的趋势,B组呈现先升高后降低再升高的趋势,其中C、D和E组鱼肌肉CAT活力均在第二周时出现最高值,之后随着时间的延长,CAT活力降低。
多重比较结果表明:第一周时,E组肌肉CAT活力显著低于空白对照组 (P<0.05);第二周时,C、D、E组鱼肌肉CAT活力均显著高于空白对照组 (P<0.05),分别为空白对照组的1.75、1.29、1.44倍;第三周时,C、D、E组与空白对照组无显著性差异 (P>0.05);第四周时,C、D、E组与空白对照组有显著性差异 (P<0.05),CAT活力分别下降了53.84%、41.93%、47.92%;第五周时,C、D、E组与空白对照组有显著性差异 (P<0.05),CAT活力分别下降了57.75%、82.45%、39.69%;第六周时,C、D、E组与空白对照组有显著性差异 (P<0.05),CAT活力分别下降了70.15%、65.90%、84.47%。结果表明,BDE-47对大泷六线鱼肌肉CAT活力的影响在最初阶段呈现诱导效应,但随着胁迫时间的延长,CAT活力降低,在胁迫四周后,CAT活力开始显著低于空白对照组,在第六周时CAT活力出现最低值。
3 讨论
3.1 BDE-47对大泷六线鱼生长的影响
BDE-47对大泷六线鱼生长有明显的抑制作用,随BDE-47浓度的增大,抑制效果明显增强,但本试验浓度条件下,各浓度间无显著性差异。空白对照组和DMSO对照组大泷六线鱼体长均随养殖时间的延长呈快速增长的趋势,但在BDE-47慢性胁迫下,A、B、C低浓度组体长随时间的延长缓慢增长,而D和E高浓度组体长基本无增长。Zhao等[16]研究表明,BDE-47引起日本青鳉Oryzias latipes仔鱼骨骼畸形,这可能是仔鱼解毒系统和免疫系统功能不完善的原因。本试验结果表明,BDE-47胁迫对大泷六线鱼幼鱼体长的影响不显著。
BDE-47对大泷六线鱼体质量的影响有明显影响。空白对照组、DMSO对照组和低浓度A组大泷六线鱼体质量随着时间的延长呈现不同程度的增长,但是A组的增重率明显低于两个对照组,其中空白对照组的特定生长率最高,其他浓度组试验鱼体质量随时间的延长总体出现负增长。B组在前三周试验鱼体质量随着时间的延长不断增加,到第四周时鱼体质量突然下降,原因可能是多溴联苯醚在体内的累计作用引起了鱼体毒性效应。有研究表明,多溴联苯醚通过扰乱鱼类甲状腺的分泌从而影响鱼类的生长[17],Song等[18]对菲律宾蛤仔Rudi-tapes philippinarum的研究验证了上述的假设。B组在第五周和第六周时鱼体质量有所回升,但是仍旧低于第一周时的体质量,原因可能是鱼体自身解毒系统的防御作用使得部分多溴联苯醚已代谢出去,但是仍无法完全代谢,导致试验鱼食欲仍旧不高,出现短时间的体质量增长现象。C组在前四周时鱼体质量随着时间的延长呈下降趋势,在后两周时有所回升。而D组和E组鱼体质量随着时间的延长,出现负增长。
3.2 BDE-47对大泷六线鱼抗氧化酶系统的影响
由于持久性有机污染物具有蓄积性,故研究污染物对鱼体免疫器官中抗氧化酶活力的影响必须要考虑污染物浓度和作用时间两个因素。抗氧化酶的活力较容易受到外界环境中污染物的胁迫而发生变化。Chipman等[19]报道,把欧洲黄盖鲽Limanda limanda暴露于多环芳烃和多氯联苯环境下,其抗氧化酶的活力可被显著诱导。Roberts等[20]研究发现,污染河流中1龄野生波纹绒须石首鱼Micropogonias undulatus肝脏等器官的SOD活力高于未被污染水域的同龄鱼。Burgeot等[21]对被污染海域内羊鱼Mullus barbatus肝脏CAT活力的研究发现,其肝脏CAT活力显著高于未被污染海区的羊鱼。综上所述,当生物体受到环境污染物胁迫时,生物体的抗氧化酶活力会发生被诱导的现象。
据相关资料报道,多溴联苯醚能诱导生物体产生活力氧 (Reactive oxygen species,ROS)[22]。SOD和CAT是生物体抗氧化防御系统中两种非常重要和关键的酶类,可以清除氧化还原反应所产生的活力氧自由基,使细胞内的ROS总量保持相对的平衡,进而减缓或阻止污染物对细胞的氧化损伤。但若产生的ROS过多,超过了生物体的防御能力,细胞清除ROS能力不足,就可能引起细胞受到氧化损伤[23]。近年来,在生态毒理学领域中,抗氧化酶常用来反映生物体受环境等因素胁迫影响的指标,其活力或含量受外界环境影响而发生规律性变化,这就能够间接地反映环境中相关污染物的存在情况,因此,常用来作为环境污染物的监测指标[24-25]。
3.2.1 BDE-47对大泷六线鱼SOD酶活力的影响
本研究结果表现出了典型的 Hormesis现象,Hormesis现象是指化学物质对生物体在高剂量时表现负面影响,但在低剂量时却表现为有益作用的现象[26],如生活在低浓度克百威环境中的轮虫繁殖能力较正常环境中高[27]等。Hormesis是生物在各种逆境胁迫下,提高种群成活率的一种应激适应性,是生物在长期进化过程中经过不断的自然选择后不断加强的结果。生物通过自身的修复作用,在机体受到外界低程度毒性影响时保持机体的稳定状态。许多研究资料表明,当生物受到有毒物质或逆境胁迫时,在最初阶段SOD活力被显著诱导[28],随着时间的延长,诱导作用逐渐下降,呈现显著地抑制作用[29]。周科等[30]在不同水平BDE-47污染沉积物对铜锈环棱螺肝胰脏SOD活力的影响研究中发现,SOD活力受到低水平剂量诱导和长时间或高剂量抑制;唐学玺等[31]的研究则发现,低浓度蒽能引起肝脏组织SOD活力暂时升高,但随着浓度的升高,SOD活力被显著抑制。
本试验结果与上述研究结果趋势一致,即试验初期SOD活力呈现出一种典型的 “毒物兴奋效应”,但不同BDE-47浓度对其的诱导效果不同,浓度越高,诱导作用越明显。由此推测,机体受到短时间的轻度逆境胁迫时,机体内抗氧化防御系统对于外界胁迫有一种应激反应,降低了活力氧的浓度,从而导致SOD活力升高[32];在肝脏和肌肉组织中,各浓度组均出现SOD活力先升高后又急剧下降的现象,可见受到长时间重度逆境胁迫时,组织中SOD代谢外源性化合物的能力已经饱和,使SOD代谢能力降低。另一个重要原因则是此时生物体内已经积聚了过多的活力氧自由基,大量的活力氧可能已经诱导生物体出现病症或已经中毒。但本试验中各组织中SOD活力在降低后又逐渐恢复再到升高的趋势,可能是因为鱼体自身的适应性和耐受性在此时发挥了一定的作用,通过调整自身状态抵御外界的侵袭,因此,可能会出现短暂的SOD活力回升阶段。
3.2.2 BDE-47对大泷六线鱼CAT酶活力的影响
CAT是一种广泛存在于生物体内的具有强大催化功能的抗氧化酶,它能有效清除SOD歧化产生的 H2O2,生成 H2O和,避免造成磷脂功能障碍、生物膜损伤、DNA断裂等,能够阻止机体受到进一步损伤,是重要的活力氧自由基清除剂,在生物体抵御外界负面影响方面起着重要的作用,可以阻止细胞膜或其他生物组织受到氧化损伤。生物体内抗氧化物酶的活力是很重要的生化生理指标,CAT是过氧化物酶的标志酶,因此,CAT活力也经常被用作监测环境污染物的生物标志物[33]。
研究表明,生物体内尚不存在直接清除·OH的物质,而活力较高的·OH危害作用却是极大的。CAT可以直接清除氧化还原反应产生的和。正常情况下,生物体代谢产生的活力氧自由基可以被机体的抗氧化防御系统清除掉。但是当机体受到严重的污染物胁迫时,机体内会发生氧化还原反应,反应产物包括大量的活力氧自由基,此时会引起机体内抗氧化酶活力和剂量的改变等。如果产生的活力氧超过了机体的清除防御能力,就会引起酶活下降、机体中毒等反应。孔强等[35]研究重金属对孔雀鱼肝脏酶活力的影响时发现,CAT活力在最初时期呈现被显著诱导的效应,在后期其活力则明显下降。吴伟等[36]研究不同浓度的BDE-209对鲫肝脏离体组织的影响时发现,CAT活力随着浓度的增加而下降,并且二者呈显著的线性相关的关系。瞿建宏等[37]研究发现,低浓度苯酚对罗非鱼体内CAT具有一定的诱导作用,而高浓度苯酚则有一定的抑制作用,甚至可以使CAT失活。本试验结果显示,在低浓度、短时间情况下,CAT活力被显著诱导,但随着时间的延长或药物浓度的增大,CAT活力被抑制。推测可能是在长时间或药物浓度较大的胁迫条件下,鱼组织或细胞功能受损导致抗氧化系统功能减弱,CAT活力明显减小。本试验结果与上述研究结果基本一致。
本试验结果表明,不同浓度的BDE-47在不同时间对大泷六线鱼肝脏和肌肉组织中抗氧化酶活力的影响均有不同变化阶段,胁迫初期,抗氧化酶活力被显著诱导,酶活升高,随着胁迫时间延长,酶活下降,有些生物体会因为自身的防御抵制作用,出现短暂的酶活回升阶段。从剂量效应看,在胁迫初期,随着BDE-47浓度的升高,酶活力所表现的诱导效应明显。在正常情况下,机体内的各种酶促反应及抗氧化酶对活力氧自由基的清除存在着一个动态的平衡,机体内的活力氧自由基被维持在一个较低水平而不致于引起细胞毒素反应。但在BDE-47的胁迫下,机体组织中会生成大量的自由基,从而诱导抗氧化酶的合成,酶活力增强,因此,在试验初期,酶活力会有所提高。胁迫中期,各试验组酶活力会出现不同的变化,这可能是鱼体在初期BDE-47的胁迫下,出现了一个自身迅速调节的适应期,使酶活力出现不同程度的调整或回落。胁迫末期,大部分浓度组酶活力与空白对照组相比有显著性差异。
本研究表明,研究持久性有机污染物对海洋鱼类的影响时,在考虑污染物本身毒性特征外,还应同时考虑污染物浓度和胁迫时间这两种因素,而要明确污染物对鱼类机体抗氧化酶影响的剂量-时间-效应的关系,还需进一步试验研究才能确定。
[1] Costa L G,Giordano G.Polybrominated diphenyl ethers[M]//Wexler P.Encyclopedia of Toxicology.3rd ed.Amsterdam:Elsevier,2014:1032-1034.
[2] 齐彭德,陆光华,梁艳,等.多溴联苯醚的生物效应研究[J].环境科学与技术,2011,34(11):11-17.
[3] Hites R A.Polybrominated diphenyl ethers in the environment and in people:a meta-analysis of concentrations[J].Environmental Science & Technology,2004,38(4):945-956.
[4] 姚文君,薛文平,国文,等.环渤海近岸海域表层沉积物及底栖生物中PBDEs的赋存特征及富集行为[J].生态毒理学报,2016,11(2):413-420.
[5] Usenko C Y,Robinson E M,Usenko S,et al.PBDE developmental effects on embryonic zebrafish[J].Environmental Toxicology and Chemistry,2011,30(8):1865-1872.
[6] Ivar do Sul J A,Costa M F.The present and future of microplastic pollution in the marine environment[J].Environmental Pollution,2014,185:352-364.
[7] 何旭颖,王冰,张赛赛,等.十溴联苯醚对太平洋鳕精子超微结构的影响[J].大连海洋大学学报,2014,29(2):141-146.
[8] Wang Wei,Hao Jia,Zhang Saisai,et al.Effect of polybrominated diphenyl ether exposure on Gadus macrocephalus Tilesius[J].Chemical Speciation & Bioavailability,2015,27(4):183-190.
[9] 张子峰,单群,庄娟,等.2,2′,4,4′-四溴联苯醚的环境毒理学研究进展[J].江苏师范大学学报:自然科学版,2015,33(2):65-70,94.
[10] 王春蕾,刘路,马腾,等.胡敏酸、富里酸对土壤-地下水系统中BDE-47迁移的影响[J].生态毒理学报,2016,11(2):501-508.
[11] 曹莹,朱岩,张亚辉,等.基于我国物种毒性数据的多溴联苯醚预测无效应浓度分析[J].生态毒理学报,2016,11(2):609-619.
[12] 李振伟,刘畅,李春娜,等.BDE-47对 Neuro-2a细胞毒性效应及作用机制[J].生态毒理学报,2016,11(3):145-150.
[13] 李莹,王伟,孟凡平,等.利用线粒体DNA控制区部分序列分析不同地理群体大泷六线鱼遗传多样性[J].海洋科学,2012,36(8):40-46.
[14] 孙诗萌,安百胜,蔡明城,等.大泷六线鱼不同群体的形态差异分析[J].水产学杂志,2015,28(4):6-11.
[15] 于亚群,田涛,陈勇,等.獐子岛深水人工鱼礁区大泷六线鱼生长特性研究[J].大连海洋大学学报,2016,31(2):205-210.
[16] Zhao Yanbin,Luo Kai,Fan Zhanlan,et al.Modulation of benzo[a]pyrene-induced toxic effects in Japanese medaka(Oryzias latipes)by 2,2′,4,4′-tetrabromodiphenyl ether[J].Environmental Science & Technology,2013,47(22):13068-13076.
[17] Noyes P D,Stapleton H M.PBDE flame retardants:toxicokinetics and thyroid hormone endocrine disruption in fish[J].Endocrine Disruptors,2014,2(1):e29430.
[18] Song Ying,Miao Jingjing,Pan Luqing,et al.Exposure to 2,2′,4,4′-tetrabromodiphenyl ether(BDE-47)alters thyroid hormone levels and thyroid hormone-regulated gene transcription in Manila clam Ruditapes philippinarum[J].Chemosphere,2016,152:10-16.
[19] Chipman J K,Marsh J W,Livingstone D R,et al.Genetic toxicity in dab Limanda limanda from the North Sea[J].Marine Ecology Progress Series,1992,91(1-3):121-126.
[20] Roberts Jr M H,Sved D W,Felton S P.Temporal changes in AHH and SOD activities in feral spot from the Elizabeth River,a polluted sub-estuary[J].Marine Environmental Research,1987,23(2):89-101.
[21] Burgeot T,Bocquéné G,Porte C,et al.Bioindicators of pollutant exposure in the northwestern Mediterranean Sea[J].Marine Ecology Progress Series,1996,131:125-141.
[22] 张喆,马胜伟,王贺威,等.十溴联苯醚(BDE-209)对菲律宾蛤仔外套膜抗氧化酶活力的影响[J].生态学杂志,2013,32(1):122-128.
[23] Zhang Jing,Wang You,Sun Kaiming,et al.A study of oxidative stress induced by two polybrominated diphenyl ethers in the rotifer Brachionus plicatilis[J].Marine Pollution Bulletin,2016,113(1-2):408-413.
[24] Cheung C C C,Siu W H L,Richardson B J,et al.Antioxidant responses to benzo[a]pyrene and Aroclor 1254 exposure in the green-lipped mussel,Perna viridis[J].Environmental Pollution,2004,128(3):393-403.
[25] Pascual P,Pedrajas J R,Toribio F,et al.Effect of food deprivation on oxidative stress biomarkers in fish(Sparus aurata)[J].Chemico-Biological Interactions,2003,145(2):191-199.
[26] Ng C Y P,Cheng S H,Yu K N.Hormetic effect induced by depleted uranium in zebrafish embryos[J].Aquatic Toxicology,2016,175:184-191.
[27] Moreira R A,da Silva Mansano A,Rocha O.The toxicity of carbofuran to the freshwater rotifer,Philodina roseola[J].Ecotoxicology,2015,24(3):604-615.
[28] 张鼎元,曹潇,郭春阳,等.乙酸铜对银鲳幼鱼急性毒性及抗氧化酶活力的影响[J].生态毒理学报,2016,11(4):280-286.
[29] 王辅明,朱祥伟,马永鹏,等.低浓度五氯酚暴露对稀有鮈鲫体内SOD活力、GSH和HSP70含量的影响[J].生态毒理学报,2009,4(3):415-421.
[30] 周科,马陶武,朱程,等.2,2′,4,4′-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活力的影响[J].环境科学学报,2010,30(8):1666-1673.
[31] 唐学玺,张培玉.蒽对黑鲪超氧化物歧化酶活力的影响[J].水产学报,2000,24(3):217-220.
[32] Ji K,Choi K,Giesy J P,et al.Genotoxicity of several polybrominated diphenyl ethers(PBDEs)and hydroxylated PBDEs,and their mechanisms of toxicity[J].Environmental Science&Technology,2011,45(11):5003-5008.
[33] 柯德森,史椰灯,王正询.环境因素对龙须菜过氧化物酶活力的影响[J].广州大学学报:自然科学版,2007,6(4):26-29.
[34] 张雨鸣.四溴联苯醚(BDE-47)对海洋鱼类毒性和抗氧化酶活力的影响[D].青岛:中国海洋大学,2014:7-8.
[35] 孔强,赵岩,付荣恕.3种重金属联合对孔雀鱼肝脏抗氧化酶系统的影响[J].供水技术,2010,4(6):10-13.
[36] 吴伟,聂凤琴,瞿建宏.多溴联苯醚对鲫鱼离体肝脏组织中CAT和 GSH-Px的影响[J].生态环境学报,2009,18(2):408-413.
[37] 瞿建宏,陈家长,胡庚东,等.苯酚胁迫下罗非鱼组织中过氧化氢酶与谷胱甘肽-S-转移酶的动态变化[J].生态环境,2006,15(4):687-692.
Effects of chronic tetrabromodiphenyl ether stress on growth and antioxidant enzyme activity in fat greenling Hexagrammos otakii
ZHANG Sai-sai1,2, SUN De-qi1, JIANG Xin-tong1, DONG An-ran1, WANG Wei1
(1.Key Laboratory of Mariculture& Stock Enhancement in North China's Sea,Ministry of Agriculture, Dalian Ocean University,Dalian 116023,China;2.Fisheries Technical Extension Station of Dalian, Dalian 116023, China)
The growth and activities of related antioxidant enzymes were determined in fat greenling Hexagrammos otakii in plastic tanks of each 70 cm×40 cm×32 cm exposed to tetrabromodiphenyl ether(BDE-47)at concentration of 0 ng/L(blank control group), 5 ng/L(Group A), 50 ng/L(Group B), 500 ng/L(Group C), 5 μg/L(Group D)and 50 μg/L(Group E)and to dimethyl sulfoxide(DMSO)at a dose of 25 μg/L(DMSO control group)at water temperature of(21±1)℃ for 42 days to investigate the biological toxic effects of BDE-47 on fat greenling.The results showed that there was a dose-dependent relationship between growth of fat greenling and BDE-47 concentration, degrowth in body weight in fat greenling in groups D(-38.66%)and E(-23.41%), even 100%of survival.Significant inductive effects have been observed in the activities of superoxide dismutase(SOD)and catalase(CAT)in liver of fat greenling(p<0.05), the activities of SOD and CAT showing increase first and then decrease in each treatment group.The SOD activities in muscle tissue were shown to be elevated first and then declined in Group C,Group D and Group E,without significant difference in CAT activity in Group B.The findings indicate that high concentration of BDE-47 results in inhibition of growth of fat greenling, specially body weight and activities of SOD and CAT in liver.
tetrabromodiphenyl ether(BDE-47); Hexagrammos otakii; growth; superoxide dismutase(SOD)
X171.5
A
10.16535/j.cnki.dlhyxb.2017.06.011
2095-1388(2017)06-0700-08
2017-03-29
国家自然科学基金资助项目 (41101481);辽宁省百千万人才支持计划项目 (2014921067)
张赛赛 (1989—),男,工程师。E-mail:finfish@yeah.net
王伟 (1978—),男,博士,教授。E-mail:wangwei@dlou.edu.cn
