苦参碱通过TRAIL/BAX途径抑制大鼠肝缺血-再灌注损伤后肝细胞凋亡
2017-12-26张磊宋晓静汪名飞朱晓亮朱骏李汛
张磊,宋晓静,汪名飞,朱晓亮,朱骏,李汛
(兰州大学第一医院普外科,甘肃 兰州 730000)
苦参碱通过TRAIL/BAX途径抑制大鼠肝缺血-再灌注损伤后肝细胞凋亡
张磊,宋晓静,汪名飞,朱晓亮,朱骏,李汛
(兰州大学第一医院普外科,甘肃 兰州 730000)
目的:探讨苦参碱抑制肝脏缺血-再灌注损伤后肝细胞凋亡的分子机制。方法:选用健康成年SD大鼠50只,通过夹闭门静脉和肝动脉血流,缺血70 min后进行再灌注的方法建立HIRI模型(缺血-再灌注损伤模型)。模型动物随机分为两组,实验组(MT组)大鼠在夹闭门静脉和肝动脉前经门静脉主干注入苦参碱30 mg/kg,对照组(NS组)注入生理盐水3 mL/kg。阻断血流1 h后恢复再灌注,在恢复再灌注2 h后采集血、肝组织标本行免疫组织化学及Western blot检测。结果:HE染色结果显示,MT组肝组织损伤程度较对照组轻,免疫组织化学、Western blot结果均显示,MT组TRAIL蛋白表达水平、BAX表达水平显著低于NS组。结论:TRAIL/BAX信号通路是缺血再灌注损伤引起细胞凋亡中的重要环节,苦参碱可通过抑制TRAIL/BAX信号通路,调节大鼠缺血再灌注损伤后肝细胞凋亡。
TRAIL;BAX;缺血-再灌注损伤;肝脏;苦参碱
在大多数肝脏手术中,如肝移植,规则肝叶切除等,需分次分段阻断肝脏血流控制术中出血。该过程可造成肝脏的缺血-再灌注损伤,引起肝细胞功能失调[1]。大量研究表明,肝脏缺血再灌注损伤常造成肝窦内细胞损伤,从而诱导活性氧自由基富集,释放促炎症反应细胞因子,引起肝细胞坏死[2-3],也会引起肝细胞凋亡及自噬,表现出肝功能异常[4]。国内外多项研究证实中药单体苦参碱(Sophocarpidine, matrine)具有抗炎、抗氧化、保肝等作用[5],对缺血-再灌注损伤引起的炎症反应、细胞凋亡、自噬及抗癌等可能有重要的调节作用[6-7]。另有研究发现,苦参碱对肝缺血再灌注损伤引起的炎症反应、肝纤维化及肝细胞异常凋亡具有明显的抑制作用[6-8]。但其抑制肝细胞异常凋亡的具体的分子机制尚未阐明。本研究在建立大鼠肝缺血-再灌注损伤模型的基础上,通过检测凋亡相关信号通路TRAIL/BAX关键蛋白表达,来进一步探讨苦参碱参与肝细胞凋亡调控的可能分子机制。
1 材料与方法
1.1 实验试剂
苦参碱(M5319)购于Sigma公司。单克隆抗体anti-TRAIL,anti-BAX及内参anti-β-actin均购买自Abcam公司。
1.2 动物分组
健康成年雄性SD大鼠50只,200~250 g,随机分为两组,每组25只。(1)缺血/再灌注损伤组(NS组):即对照组,在夹闭门静脉和肝动脉前30 min,经门静脉主干注入生理盐水3 mL/kg;(2)苦参碱不同剂量预处理组(MT组):在夹闭门静脉和肝动脉前30 min,经门静脉主干注入苦参碱30 mg/kg。
1.3 模型建立
大鼠术前禁食12 h,自由饮水。腹腔注射4%戊巴比妥钠(40 mg/kg) 麻醉,腹正中切口,暴露肝门部,用血管夹夹闭门静脉和肝动脉,造成70%肝脏缺血。1 h后去除血管夹,恢复缺血肝血流,关腹。继再灌注2 h后,取肝脏组织标本,待测。
1.4 免疫组织化学检测
肝脏组织经过常规石蜡包埋,参照常规抗体免疫组织化学染色步骤。
1.5 Western blot检测
新鲜肝脏组织采用RIPA裂解液冰上完全裂解,12,000 rpm,4℃离心15 min,取上清收集总蛋白。5×上样缓冲液混合煮沸5 min。垂直板电泳分离条带,转膜,一抗(1∶1 000)4℃孵育过夜,二抗(1∶5 000,HRP标记)RT孵育2 h,利用化学发光仪曝光,采集目标蛋白条带。
1.6 统计学方法
采用SPSS13.0软件处理数据,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 苦参碱对大鼠肝脏缺血再灌注损伤后肝细胞的影响
光学显微镜下可见NS组肝细胞肿胀、肝细胞空泡变性和点状坏死,大量炎性细胞浸润;MT组肝组织结构尚清楚,肝细胞轻、中度浊肿,点状嗜酸性变性,轻度肝细胞淤胆,少量炎性细胞浸润,但其损伤程度及范围明显小于对照组(图1),结果显示本研究大鼠肝缺血再灌注损伤模型制造成功,而且苦参碱对肝缺血再灌注损伤及炎症反应具有一定的治疗作用。

图1 苦参碱对大鼠肝脏缺血再灌注损伤后肝细胞病理学影响A.大鼠肝脏缺血再灌注损伤(NS组);B.大鼠肝脏缺血再灌注损伤行苦参碱干预后(MT组)(×200)
2.2 苦参碱对大鼠缺血再灌注损伤后肝细胞凋亡的影响
为了进一步研究苦参碱调节缺血再灌注损伤后肝细胞异常凋亡的分子机制,本研究通过免疫组织化学及Western blot技术检测凋亡相关关键蛋白TRAIL,BAX及Caspase3的表达,以期阐明苦参碱抑制损伤后肝细胞异常凋亡的机理。免疫组织化学检测发现,肝脏缺血再灌注损伤可激活肝细胞TRAIL及BAX蛋白表达,与对照组(NS组)相比,苦参碱干预组(MT组)TRAIL及BAX蛋白显著得到抑制(图2)。Western blot结果与免疫组织化学结果相同:MT组TRAIL及BAX蛋白表达水平显著低于对照组(NS组)(图3)。
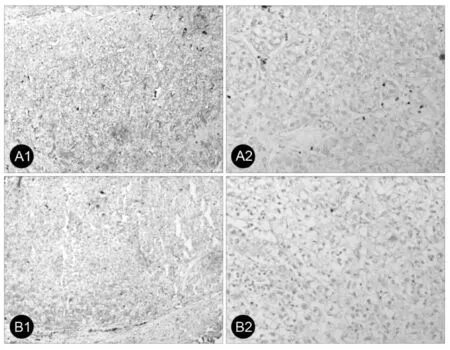
图2 肝缺血再灌注损伤后及苦参碱干预后TRAIL及BAX蛋白表达免疫组织化学分析A:TRAIL表达水平;B:BAX表达水平;1:NS组;2:MT组(×200)
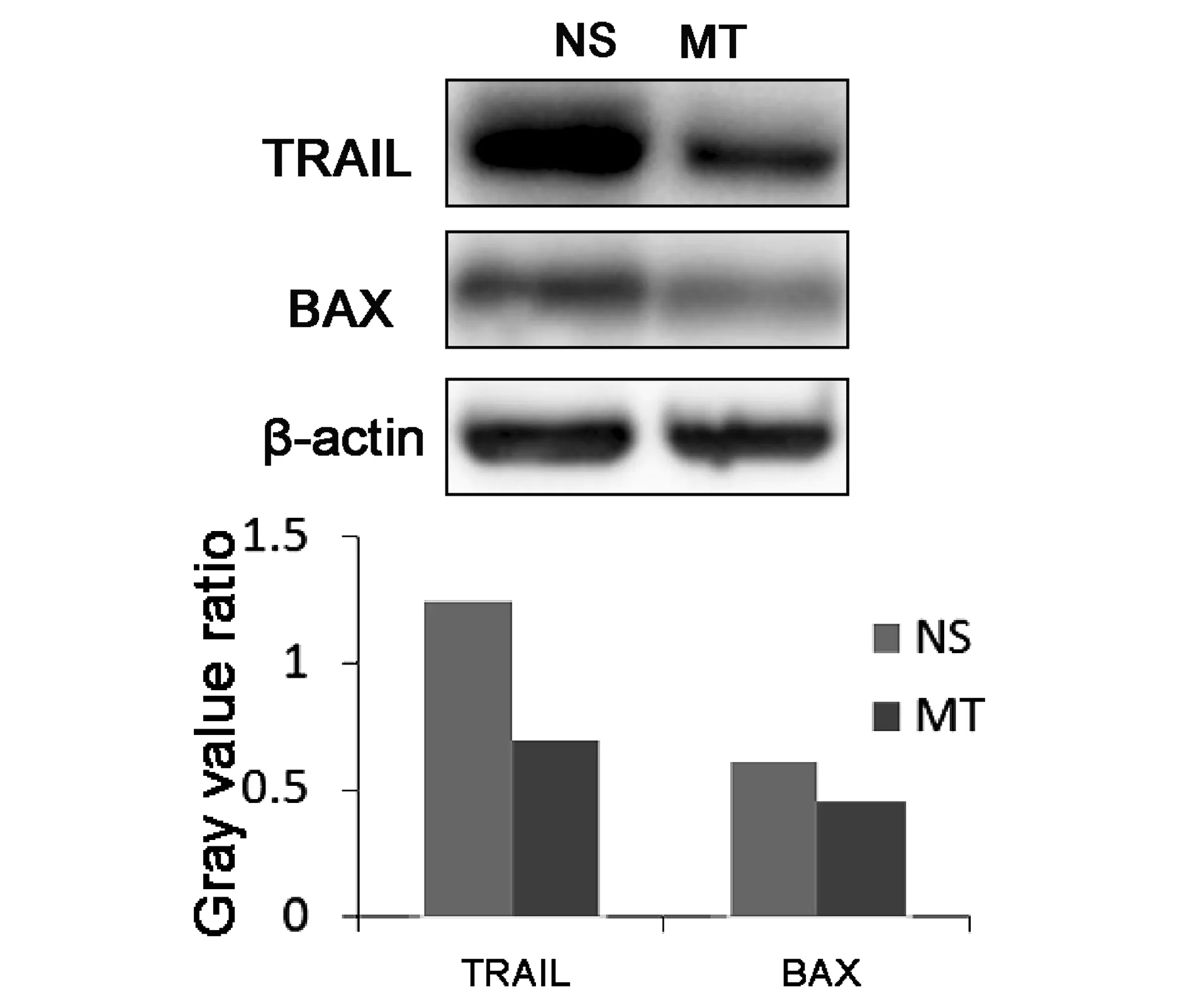
图3 肝缺血再灌注损伤后及苦参碱干预后TRAIL及BAX蛋白表达Western blot分析
3 讨论
细胞凋亡是动物界及人类重要的生命现象之一。肿瘤坏死因子相关的凋亡诱导配体(TRAIL)是近年来发现的新的TNF家族成员[9],TRAIL 通过结合靶细胞相应的受体, 发挥凋亡诱导作用。诸多研究证实,TRAIL对多种实体肿瘤细胞存在杀伤作用,如NF-κB可诱导TRAIL信号调节肝癌细胞凋亡[10],肿瘤免疫耐受过程中,TRAIL起重要的调节作用,许多海洋类药物可通过TRAIL途径调节细胞凋亡[11]。近年越来越多的证据显示,在正常人细胞中,TRAIL具有调节细胞凋亡的作用。梁艳等研究发现,TRAIL可诱导正常人肝细胞线粒体损伤,促进肝细胞凋亡[12],而且人角质细胞凋亡可通过TRAIL途径[13]。本研究结果发现,TRAIL途径在模型大鼠缺血再灌注引起的肝细胞凋亡过程中也起重要作用。
中药单体苦参碱(matrine,MT)具有抗炎、抗氧化、抗肿瘤、免疫抑制和保肝等作用[5]。已用于临床治疗,主要用于治疗慢性乙型病毒性肝炎[6],对多种原因引起的肝损伤及肝纤维化均有较好的治疗作用[6-7]。本研究中发现单体苦参碱可通过抑制TRAIL途径关键因子TRAIL蛋白及BAX蛋白抑制肝细胞凋亡。TRAIL分子可通过影响BAX从而减轻缺血灌注损伤。而BAX的激活可抑制肝细胞线粒体转膜能力,进而释放细胞色素C,促进凋亡关键因子Caspase3,8,9,最终引起细胞凋亡[13]。可见,苦参碱通过调节TRAIL/BAX途径,可减轻大鼠肝缺血-再灌注后肝细胞损伤,改善肝细胞变性。
[1] Liu A, Jin H, Dirsch O, et al. Release of danger signals during ischemic storage of the liver: a potential marker of organ damage? [J].Mediators Inflamm,2010,2010:436145.
[2] Kloek JJ, Maréchal X, Roelofsen J, et al. Cholestasis is associated with hepatic microvascular dysfunction and aberrant energy metabolism before and during ischemia-reperfusion[J].Antioxid Redox Signal,2012,17:1109-1123.
[3] Hao BB, Pan XX, Fan Y, et al. Oleanolic acid attenuates liver ischemia reperfusion injury by HO-1/Sesn2 signaling pathway[J]. Hepatobiliary Pancreat Dis Int,2016,15(5):519-524.
[4] Shen M, Lu J, Dai W, et al. Corrigendum to "Ethyl Pyruvate Ameliorates Hepatic Ischemia-Reperfusion Injury by Inhibiting Intrinsic Pathway of Apoptosis and Autophagy"[J]. Mediators Inflamm,2016,2016:5434275.
[5] Liou CJ, Lai YR, Chen YL, et al. Matrine Attenuates COX-2 and ICAM-1 Expressions in Human Lung Epithelial Cells and Prevents Acute Lung Injury in LPS-Induced Mice[J]. Mediators of Inflammation,2016,2016:3630485.
[6] Pu J, Fang FF, Li XQ, et al. Matrine Exerts a Strong Anti-Arthritic Effect on Type II Collagen-Induced Arthritis in Rats by Inhibiting Inflammatory Responses[J]. Int J Mol Sci,2016,17(9):E1410.
[7] Ma K, Huang MY, Guo YX, et al. Matrine-induced autophagy counteracts cell apoptosis via the ERK signaling pathway in osteosarcoma cells[J]. Oncol Lett, 2016,12(3):1854-1860.
[8] Feng Y, Ying HY, Qu Y, et al. Novel matrine derivative MD-1 attenuates hepatic fibrosis by inhibiting EGFR activation of hepatic stellate cells[J]. Protein Cell,2016,7(9):662-672.
[9] Sosna J, Philipp S, Fuchslocher Chico J, et al. Differences and Similarities in TRAIL- and Tumor Necrosis Factor-Mediated Necroptotic Signaling in Cancer Cells[J]. Mol Cell Biol,2016,36(20): 2626-2644.
[10] Fu K, Pan H, Liu S, et al. Glycogen synthase kinase-3β regulates tumor necrosis factor-related apoptosis inducing ligand (TRAIL)-induced apoptosis via the NF-κB pathway in hepatocellular carcinoma[J].Oncol Lett,2015,10(6):3557-3564.
[11] Elmallah MI, Micheau O. Marine Drugs Regulating Apoptosis Induced by Tumor Necrosis Factor-Related Apoptosis-Inducing Ligand (TRAIL)[J].Mar Drugs,2015,13(11):6884-6909.
[12] 梁艳,杨再兴,王皓,等.TRAIL诱导正常人肝细胞线粒体损伤的实验研究[J].现代免疫学,2009,29(2):143-147.
[13] Lee DH, Nam YJ, Kim YJ, et al. Rotundarpene prevents TRAIL-induced apoptosis in human keratinocytes by suppressing the caspase-8- and Bid-pathways and the mitochondrial pathway[J].Naunyn Schmiedebergs Arch Pharmacol,2014,387(12):1209-1219.
InhibitionofHepatocyteApoptosiswithMatrineafterIschemia-ReperfusionInjuryinRatsthroughTRAIL/BAXSignalingPathway
ZHANG Lei, SONG Xiao-jing, WANG Ming-fei, ZHU Xiao-liang, ZHU Jun, LI Xun
(TheFirstHospitalofLanzhouUniversity,Lanzhou730000,China)
To investigate the molecular mechanism of Matrine on hepatocyte apoptosis after hepatic ischemia-reperfusion injury in rats. Methods: 50 SD rats were randomly divided into the control group(n=25) and the Matrine group(n=25), HIRI(hepatic ischemia reperfusion injury) models were established by the method of clip-closed portal vein and hepatic artery for 70min then followed by reperfusion. The Matrine group was injected with Matrine(30 mg/kg) through main portal vein before modeling, whereas the control group was injected with normal saline(3 ml/kg). The blood reperfusion was carried out one hour after blocking blood supply. Blood sample and liver tissues were collected for relative tests two hours after the reperfusion. Results: HE results showed that the degree of liver damage was less in the Matrine group than that in the control group. Both immunohistochemistry test and Western blot results showed that the expression levels of TRAIL protein and BAX were significantly lower in the Matrine group than those in the control group. Conclusion: TRAIL/BAX signaling pathway is an important link of cell apoptosis in ischemia-reperfusion injury, Matrine can regulate the hypatocyte apoptosis after ischemia-reperfusion injury in rats, by inhibiting the TRAIL/BAX signaling pathway.
TRAIL; BAX; Ischemia-reperfusion injury; Liver; Matrine
R285.5
A
1002-2392(2017)06-0062-03
2017-03-30
2017-04-16
甘肃省中医药管理局科研课题(G2K-2016-52)
张磊(1978-),男,博士研究生,主要从事肝胆胰外科临床工作。
