紫草素对荷肝癌裸小鼠移植瘤生长的影响及其机制研究
2017-12-26张萍
张萍
(邯郸市传染病医院肝五科,河北 邯郸 056002)
紫草素对荷肝癌裸小鼠移植瘤生长的影响及其机制研究
张萍
(邯郸市传染病医院肝五科,河北 邯郸 056002)
目的:研究紫草素(Shikonin)对荷肝癌裸小鼠移植瘤生长的影响,并探讨其机制。方法:采用皮下注射接种肝癌HepG2细胞的方法建立荷肝癌裸小鼠模型,分别腹腔注射给予不同剂量紫草素(0.5、1、2 mg/kg)和顺铂(2 mg/kg)进行干预治疗,隔天一次,共给药6次。治疗完成后,观察各组裸小鼠一般生存状态及肿瘤生长状况,称取瘤体质量并计算抑瘤率;通过苏木精-伊红(HE)染色观察肿瘤组织形态结构改变,末端标记法(TUNEL)检测肿瘤组织细胞凋亡状况,免疫组织化学法(IHC)观察肿瘤组织凋亡相关蛋白(caspase-3、Bax、bcl-2)表达。结果:经紫草素治疗后荷肝癌裸小鼠饮食状况和精神状态明显改善,瘤体减小、活动度和硬度降低,肿瘤组织呈现细胞皱缩、片状坏死等病理性改变、凋亡细胞数量明显增多;瘤体质量显著减轻、抑瘤率显著升高;肿瘤组织中caspase-3和Bax表达显著上调而bcl-2显著下调,Bax/bcl-2比值显著升高;紫草素上述作用均具有一定的剂量依赖性。结论:紫草素对荷肝癌裸小鼠移植瘤生长具有一定的抑制作用,其机制可能与紫草素调节凋亡相关基因蛋白表达而促进肿瘤组织细胞凋亡有关。
紫草素;肝癌;移植瘤;抑制;机制
肝癌是发病率最高的恶性肿瘤之一,全球每年以约50万新发患者的速度在增长;我国每年约11万人死于肝癌,居恶性肿瘤致死率第二位,严重威胁着人类的生命健康。紫草是我国传统中药品种之一,《本草纲目》和《唐本草》等医学典籍均有记载,具有凉血,活血,解毒透疹之功效;紫草素是中药紫草的主要活性成分,具有抗炎、增强机体免疫力等广泛的生物学活性[1-2]。近年来,紫草素抗肿瘤作用逐渐得到人们的关注,既往研究发现紫草素对乳腺癌、喉癌、子宫内膜癌、宫颈癌、白血病等均具有一定的抑制作用[3-7],但紫草素对人肝癌是否具有治疗作用尚未见文献报道。本研究将通过皮下注射接种人肝癌HepG2细胞的方法建立荷肝脏裸小鼠模型并给予不同剂量的紫草素进行干预治疗,探讨紫草素对荷肝癌裸小鼠移植瘤生长的影响及其作用机制。
1 材料与方法
1.1 动物与细胞
雄性Balb/C裸小鼠(鼠龄4~6周龄,体质量18~22 g)购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2012-0005;人肝癌HepG2细胞株由河北医科大学细胞生物研究室惠赠。
1.2 药物与试剂
紫草素购自中国药品生物制品检定所(纯度≥98%);注射用顺铂购自山东齐鲁制药有限公司;DMEM 高糖培养基、胰蛋白酶、胎牛血清购自美国Gibco公司;HE、TUNEL试剂盒购自南京建成生物研究所;caspase-3、Bax、bcl-2单抗和SP试剂盒均购自碧云天生物技术有限公司。
1.3 荷肝癌裸小鼠模型的制备、分组与给药
参照左朝晖等[8]报道的方法制备荷肝癌裸小鼠模型的制备:人肝癌HepG2细胞株经解冻复苏后植入DMEM高糖培养基进行培养,待生长至对数生长期后取细胞,调整浓度为2×107个/mL,注射接种(0.5 mL)于裸小鼠背部右后腿外侧皮下,7 d后接种部位出现>0.3 cm2移植瘤即可认定为造模成功。取60只荷肝癌裸小鼠模型随机分为模型组、紫草素(0.5、1、2 mg/kg)组和顺铂(2 mg/kg)组,每组各12只;隔天腹腔注射给药一次,共给药6次,模型组给予等体积生理盐水。
1.4 观察裸小鼠生存状态和肿瘤组织生长状况
观察裸小鼠饮食状况、精神状态等生存状态,观察瘤体大小、活动度、硬度等瘤体特征。
1.5 瘤体质量和抑瘤率的测定
颈椎脱臼处死动物后剥取肿瘤组织并称重,抑瘤率的计算公式:抑瘤率(%)=(模型组瘤重-治疗组瘤重)/模型组瘤重×100%
1.6 肿瘤组织形态结构改变和细胞凋亡状况的观察
取称重后肿瘤组织置于4%多聚甲醛溶液中进行固定后,依次行石蜡包埋、切片、脱蜡水化、常规HE染色和复染,然后通过显微镜观察肿瘤组织形态结构改变。肿瘤组织石蜡切片经常规脱蜡水化处理后,按照TUNEL试剂盒说明书步骤进行处理,然后通过显微镜观察细胞凋亡状况;凋亡指数(Apoptosis Index, AI)的计算:计数每张染色切片中细胞总数和凋亡细胞数,然后计算AI:AI(%)=(凋亡细胞数/细胞总数)×100%
1.7 肿瘤组织凋亡相关蛋白表达的检测
取肿瘤组织石蜡切片,按照SP试剂盒说明书步骤,采用免疫组织化学法(IHC)检测凋亡相关蛋白(caspase-3、Bax、bcl-2)表达;半定量分析:每张染色组织切片随机选取5个视野,通过医学图像分析软件测定每个视野平均光密度(Optical Density,OD),以OD值代表caspase-3、Bax、bcl-2蛋白表达密度;并根据Bax、bcl-2表达OD值计算Bax/bcl-2比值。
1.8 统计学方法
运用SPSS15.0进行数理统计分析,计量资料组间均数比较采用one-way ANOVA分析,两两比较采用LSD检验;计数资料采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 紫草素对荷肝癌裸小鼠生存状态及肿瘤特征的影响
模型组荷肝癌裸小鼠呈现精神萎靡、饮食状况差等状态,肿瘤组织质硬、活动、与胸壁不粘连。紫草素各剂量组和顺铂组荷肝癌裸小鼠饮食状况、精神状态等较模型组均呈不同程度好转,并且与模型组比较瘤体减小、活动度和硬度降低,紫草素该作用具有一定剂量依赖性。
2.2 紫草素对荷肝癌裸小鼠移植瘤瘤体质量和抑瘤率的影响
结果如表1所示:与模型组比较发现经紫草素或顺铂治疗能够显著降低荷肝癌裸小鼠移植瘤质量并显著提高抑瘤率(P<0.05,P<0.01);紫草素2 mg/kg组瘤体质量和抑瘤率与顺铂2 mg/kg组比较均无显著性差异(P>0.05)。
注:与模型组比较,*P<0.05,**P<0.01
2.3 紫草素对荷肝癌裸小鼠肿瘤组织形态结构改变的影响
结果如图1所示:与模型组比较发现,经紫草素各剂量或顺铂干预治疗后荷肝癌裸小鼠移植瘤组织细胞呈现程度皱缩、数量减少、间隙增大、片状坏死等病理性改变,紫草素该作用呈现一定剂量依赖性。

图1 紫草素对荷肝癌裸小鼠肿瘤组织形态结构改变的影响(HE)注:A-模型组;B-紫草素0.5 mg/kg组;C-紫草素1 mg/kg组;D-紫草素2 mg/kg组;E-顺铂2 mg/kg组(下同)
2.4 紫草素对荷肝癌裸小鼠肿瘤组织细胞凋亡状况的影响
结果如图2所示:与模型组比较发现,经紫草素各剂量或顺铂干预治疗后荷肝癌裸小鼠移植瘤组织凋亡细胞数量明显增多,以紫草素2 mg/kg组效果最为显著。AI结果如表2所示:与模型组比较发现,经紫草素各剂量或顺铂干预治疗能够显著提高荷肝癌裸小鼠移植瘤细胞AI(P<0.01);紫草素2 mg/kg组AI较顺铂2 mg/kg组显著升高(P<0.05)。

表2 紫草素对荷肝癌裸小鼠肿瘤组织细胞AI的影响
注:与模型组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
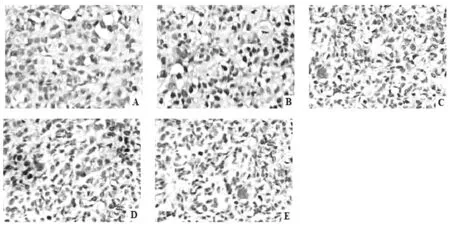
图2 紫草素对裸小鼠肿瘤组织细胞凋亡状况的影响(TUNEL)
2.5 紫草素对荷肝癌裸小鼠移植瘤组织中caspase-3蛋白表达的影响
结果如图3所示:与模型组比较发现,经紫草素各剂量组或顺铂治疗后荷肝癌裸小鼠移植瘤组织中caspase-3蛋白表达显著上调,以紫草素2 mg/kg组效果最为显著。半定量分析结果如表3所示:与模型组比较发现,经紫草素(1、2 mg/kg)或顺铂干预治疗6次后荷肝癌裸小鼠移植瘤组织IHC染色切片caspase-3蛋白表达OD值显著升高(P<0.05,P<0.01);紫草素2 mg/kg组caspase-3蛋白表达OD值显著高于顺铂2 mg/kg组(P<0.05)。
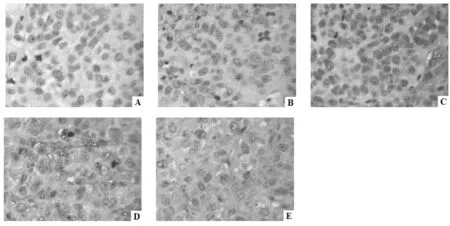
图3 紫草素对荷肝癌裸小鼠移植瘤组织中caspase-3蛋白表达的影响(IHC)
2.6 紫草素对荷肝癌裸小鼠移植瘤组织Bax蛋白和bcl-2蛋白表达的影响
结果如图4和图5所示:与模型组比较发现,经紫草素各剂量组或顺铂干预治疗后荷肝癌裸小鼠移植瘤组织中Bax蛋白表达呈不同程度上调、而bcl-2蛋白表达呈不同程度下调,以紫草素2 mg/kg组效果最为显著。半定量分析结果如表3所示:与模型组比较发现,经紫草素(1、2 mg/kg)或顺铂干预治疗6次后荷肝癌裸小鼠移植瘤组织IHC染色切片Bax蛋白表达OD值显著升高、bcl-2蛋白表达OD值显著降低,紫草素该作用具有一定的剂量依赖性(P<0.05,P<0.01);紫草素2 mg/kg组bcl-2蛋白和Bax蛋白表达OD值较顺铂组均无显著性差异(P>0.05)。

图4 紫草素对荷肝癌裸小鼠移植瘤组织Bax蛋白表达的影响(IHC)

图5 紫草素对荷肝癌裸小鼠移植瘤组织bcl-2蛋白表达的影响(IHC)
2.7 紫草素对荷肝癌裸小鼠移植瘤组织中Bax/bcl-2比值的影响
结果如表3所示:与模型组比较发现,经紫草素各剂量或顺铂治疗能够显著提高荷肝癌裸小鼠移植瘤组织Bax/bcl-2比值(P<0.05,P<0.01);紫草素2 mg/kg组Bax/bcl-2比值显著高于顺铂组(P<0.05)。

表3 紫草素对荷肝癌裸小鼠移植瘤组织中caspase-3、Bax、bcl-2表达OD值及Bax/bcl-2比值
注:与模型组比较,*P<0.05,**P<0.01;与顺铂组比较,△P<0.05
3 讨论
肝癌具有发病隐匿、发展迅速、转移及侵袭能力强、恶性度高的特点[9-10],目前临床上对于肝癌的治疗主要采取手术切除结合术后放化疗的综合治疗方案[11],但大多数患者就诊时已达病程中晚期、失去手术机会,目前临床上手术切除率仅为20%[12],且5年复发率高达60%以上,所以研发能够有效抑制肝脏肿瘤生长和复发的新型药物是急待解决的临床难题。
紫草素是一种具有广泛生物学活性的萘醌类化合物[1-7],于海荣等[5]研究发现紫草素能够通过改变膜电位以及促进内源性活性氧的生成而抑制人宫颈癌Hela细胞增殖;鲁昊等[6]通过体外培养人喉癌 Hep-2细胞并给予紫草素进行干预研究发现,紫草素能够通过改变细胞周期而起到抑制Hep-2细胞增殖的作用;此外,陈菊英等[3]研究发现紫草素具有促进人乳腺癌 MCF-7细胞自噬的作用,陈志炉等[7]研究发现紫草素具有抑制白血病细胞HL-60增殖并促进其凋亡的作用。本研究发现:经紫草素干预治疗能够有效改善荷肝癌裸小鼠生存状态、降低瘤体硬度和活动度,抑制移植瘤生长、提高抑瘤率;能够有效诱导移植瘤组织细胞凋亡和坏死;并且紫草素2 mg/kg组细胞凋亡指数(AI)显著高于顺铂组;提示紫草素对荷肝癌裸小鼠移植瘤生长具有一定的抑制作用。
细胞凋亡是一种细胞程序性死亡,是一个由多种基因参与的复杂的调控过程。其中caspase-3是激活各种凋亡刺激因子(Apaf-1)的关键蛋白酶,参与细胞凋亡的启动及整个凋亡过程的调节;bcl-2能够抑制线粒体破裂,可直接与Apaf-1结合而抑制caspase-3激活,抑制促凋亡蛋白Bax细胞毒性作用,调节细胞内钙浓度,从而起到抑制细胞凋亡的作用[13];Bax属于Bcl-2基因家族成员,具有诱导线粒体渗透性改变而释放细胞色素C、激活促凋亡蛋白caspase-9,而表现出促细胞凋亡作用[14]。此外,Bax能够与bcl-2聚合成二聚体,从而抑制bcl-2活性而促进细胞凋亡,所以Bax/bcl-2比值更加能够体现Bcl-2基因家族对细胞凋亡的调控作用[15]。本研究发现,经紫草素干预治疗能够有效上调荷肝癌裸小鼠移植瘤组织caspase-3蛋白和Bax蛋白表达、下调bcl-2表达、提高Bax/bcl-2比值,这可能是紫草素诱导荷肝癌裸小鼠移植瘤组织细胞凋亡的重要分子机制。
总之,紫草素可能通过诱导移植瘤细胞凋亡而对荷肝癌裸小鼠移植瘤生长起到一定的抑制作用,其机制可能与紫草素调节凋亡相关蛋白表达有关。
[1] 赵雪梅,王桂玲,费洪荣,等.紫草有效成分的提取及其抗炎作用研究[J].中药药理与临床,2008,24(4):36-38.
[2] 代巧妹,李冀,颜培宇.紫草素免疫调节作用研究进展[J].中医药信息,2012,29(6):116-118.
[3] 陈菊英,刘朝纯,曾智,等.紫草素通过PI3K/Akt通路促进人乳腺癌MCF-7细胞自噬[J].中国药理学通报,2013,29(2):194-198.
[4] 杨京哲,张凌霄,邢永静,等.紫草素对子宫内膜癌Ishikawa细胞生长的作用研究[J].现代中西医结合杂志,2013,22(23):2520-2523.
[5] 于海荣,苗浩,庞冲,等.紫草素对人宫颈癌Hela细胞增殖的影响及其作用机制研究[J].中国生化药物杂志,2015,35(4):16-18.
[6] 鲁昊,康健.紫草素对人喉癌Hep-2细胞生长的作用研究[J].东南大学学报(医学版),2011,30(2):350-354.
[7] 陈志炉,戴其舟,王勇,等.紫草素对白血病细胞HL-60增殖及凋亡作用的影响[J].中国中西医结合杂志,2012,32(2):239-243.
[8] 左朝晖,黎祖荣,周晓,等.环氧合酶-2抑制剂塞来昔布对人肝癌HepG2裸小鼠移植瘤生长和肿瘤血管生成的抑制作用[J].癌症,2006,25(4):414-420.
[9] Saleem M, Alam A, Arifin S, et al. Lupeol, atriterpene, inhibits early responses of tumor promotion induced by benzoyl peroxide in murine skin[J].Pharmacol Res,2001,43(2):127-134.
[10] Beveridge TH, Li TS, Drover JC. Phytosterol content in American ginsengseed oil[J]. Journal of agricultural and food chemistry,2002,50(4):744-750.
[11] Tokuzawa Y, Kaiho E, Maruyama M, et al. Fbxls is a novel target of Oct3/4 butis dispensable for embryonic stem cell self-renewal and mouse development[J]. Mol Cell Biol,2003,23(8):2699-2708.
[12] Ansari D, Andersson R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors[J]. world J Gastroenterol,2012,18:1003-1008.
[13] Ogura T, Tanaka Y, Tamaki H, et al. Docetaxel induces Bcl-2- and pro-apoptosis caspase-independent death of human prostate cancer DU145 cells[J].Int J Oncol,2016,48(6):2330-2338.
[14] Farhadi F, Jahanpour S, Hazem K, et al. Garlic (Allium sativum) fresh juice induces apoptosis in human oral squamous cell carcinoma: the involvement of caspase-3,bax and bcl-2[J]. J Dent Res Dent Clin Dent Prospects, 2015,9(4):267-273.
[15] Saeedi Borujeni MJ, Hami J, Haghir H, et al. Evaluation of Bax and Bcl-2 Proteins Expression in the Rat Hippocampus due to Childhood Febrile Seizure[J].Iran J Child Neurol,2016,10(1):53-60.
EffectsandMechanismofShikoninonTumorGrowthofNudeMiceBearingHepaticCarcinoma
ZHANG Ping
(TheInfectiousDiseasesHospitalofHandanCity,Handan056002,China)
Objective: To investigate the effects and mechanism of Shikonin on the growth of transplanted tumor in nude mice bearing hepatic carcinoma. Methods: HepG2 cell of hepatic carcinoma was used to make the models. Shikonin (0.5mg/kg, 1 mg/kg, 2 mg/kg) and Cisplatin (2mg/kg) were applied as the intervention, they were used once every other day for 6 times. The general state and tumor growth were observed, and the tumor was weighed to calculate the tumor inhibition rate in each group. The tumor histology was observed with HE staining; the apoptosis of tumor cells was detected by TUNEL; and the expression of caspase-3, Bax, bcl-2 were detected by IHC. Results: The diet, mental condition, and tumor indicators were all improved in the nude mice intervened with Shikonin; also, in this group, tumor cell shrinkage and other pathological morphological changes appeared, the number of apoptotic cells in tumor tissue was significantly increased; the tumor weight were significantly decreased and tumor inhibition rate were significantly increased; the expression of Bax and caspase-3 were significantly increased, the expression of bcl-2 protein was significantly decreased, and the ratio of Bax/bcl-2 were significantly increased. All of above effects of Shikonin were dose-dependent. Conclusions: Shikonin has inhibitive effects on tumor growth in nude mice bearing hepatic carcinoma, which is perhaps related to its effects of regulating the expression of apoptosis-related genes and protein to promote tumor cell apoptosis.
Shikonin; Hepatic carcinoma; Transplanted tumor; Inhibition; Mechanism
R273.052
A
1002-2392(2017)06-0045-04
2016-09-12
2016-10-20
张萍(1979-),女,主治医师,从事肝脏疾病研究。
