肾脏血管母细胞瘤1例并文献复习
2017-12-26孙平丽许传杰高洪文
贾 梦,姚 敏,孙平丽,许传杰,高洪文
(吉林大学第二医院 病理科,吉林 长春130041)
肾脏血管母细胞瘤1例并文献复习
贾 梦,姚 敏,孙平丽,许传杰,高洪文*
(吉林大学第二医院 病理科,吉林 长春130041)
1 临床资料
患者,男性,60岁,体检行CT检查发现左肾肿瘤,于2017年2月入我院泌尿外科诊治。患者无明显临床症状。入院后,实验室检查肾功能:血尿素氮7.57 mmol/L(正常值1.79 mmol/L-7.14 mmol/L)、血肌酐117.0 μmol/L(正常值44.0 μmol/L-106.0 μmol/L)、血尿酸580 μmol/L(正常值90 μmol/L-410 μmol/L)均有不同程度升高;血常规:白细胞总数、淋巴细胞计数和血小板压积有升高,红细胞计数无增多;尿常规:尿比重1.010(正常值1.015-1.025)下降,尿红细胞计数正常。既往患者有高血压及心衰病史。B超检查示“左肾下极探及5.0 cm×4.1 cm略低回声光团,内部回声不均”,外院CT检查示“左肾下极占位,考虑肾癌,肾动脉粥样硬化”。临床诊断为肾癌,患者行左侧肾脏根治手术。
病理标本大体检查:切除左侧肾脏,体积11 cm×8 cm×5cm,于肾下极见一圆形肿物(图略),直径约3.5 cm,境界清楚,无包膜;肿物切面实性,灰红灰黄色,局部有出血,未见坏死及囊性变。肿物累及肾被膜,但未侵犯肾盂及肾周脂肪组织。
组织学检查:肿瘤与周围肾实质分界清,局部肿瘤成分紧邻周围肾小管。肿瘤由富于细胞区和寡细胞区构成(图 1-A)。在富于细胞区,肿瘤细胞呈片状、巢状或小梁状排列,其间穿插丰富的薄壁毛细血管网(图 1-B)。肿瘤细胞呈多角形或卵圆形。胞浆淡染或嗜酸,胞质内可见透明空泡(图1-B)。细胞核有轻到中度多形性,偶见核仁及核内假包涵体,未见核分裂象。在寡细胞区可见有玻璃样变纤维化的间质,局灶有粘液变及钙化,其间散在分布粗大的厚壁血管,肿瘤细胞稀少。另外,在富于细胞区和寡细胞区局灶均可见有含铁血黄素颗粒。肿物周围肾实质肾小管有萎缩,肾小球纤维化,同时见有慢性炎细胞浸润。
免疫组化染色结果:肿瘤细胞弥漫表达α-inhibin(图2-A)、Vimentin、S-100(图2-B)和NSE(图2-C),局灶表达PAX-8、EMA和CD10,不表达HMB45。极少数肿瘤细胞中CK(AE1/AE3)呈现弱阳性。毛细血管网CD31(图2-D)、CD34和ERG阳性。Ki67增殖指数为3%-4%。
病理诊断:肾脏血管母细胞瘤。
术后患者恢复良好,随访6个月无复发和转移。
2 讨论
血管母细胞瘤是主要发生于中枢神经系统的肿瘤。中枢神经系统的血管母细胞瘤多为散发性病变,而约25%的病变与von Hippel-Lindau (VHL)病相关[1]。除中枢神经系统外,血管母细胞瘤也可发生于身体其他部位,例如肝脏[2]、肺[3]、胰腺[4]、后腹膜[5]、软组织[6]、皮肤[7]等,这些中枢神经系统外的血管母细胞瘤与VHL病相关的可能性更大[8]。

图1肾脏血管母细胞瘤形态特征(A-B,HE染色)A:肿瘤由富于细胞区和寡细胞区构成(40×);B:肿瘤细胞(箭头所示)位于丰富的薄壁毛细血管网之间,胞浆透明、空泡状(200×)
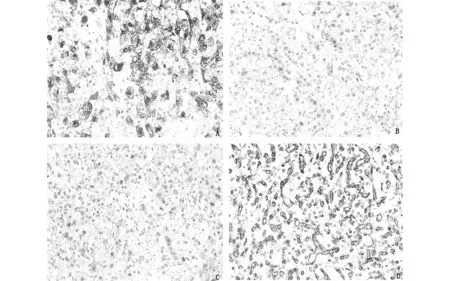
图2肾脏血管母细胞瘤免疫组化染色(A-D,200×)A:肿瘤细胞显示α-inhibin胞浆阳性;B:肿瘤细胞显示S-100胞浆及胞核阳性;C:肿瘤细胞显示NSE胞浆阳性;D:CD31显示丰富的毛细血管网
肾脏血管母细胞瘤罕见,目前国内外有报道20余篇,大部分病例与VHL病无关。查阅文献,在英文文献中共有11篇文献详细描述了16例肾脏血管母细胞瘤[9-19]。这些病例中,患者年龄从16岁到71岁不等(中位年龄53岁,平均年龄46.7岁)。右肾发生率高于左肾(右肾11例,左肾5例)。男性患者多于女性(男性患者10例,女性患者6例)。多数病例无明显症状,但也有少数病例报道患者出现肉眼血尿(2例)[10, 12]和背部下方疼痛(3例)[10, 12, 17],1例患者血红细胞计数有增多[10]。所有被报道病例经手术治疗后随访3个月到9年不等,均无复发和转移。
大体上,肿瘤直径从1.2 cm到6.8 cm不等。肿瘤与周围组织分界清楚,切面灰红或灰黄色,部分病例可见有出血和囊性变区域。另外,多中心病例也有(1例)报道[8]。镜下,该肿瘤均由富于细胞区和寡细胞区构成。富于细胞区肿瘤细胞呈片状或巢状排列,其间穿插丰富的薄壁毛细血管网,而在寡细胞区,肿瘤细胞稀少,间质显著玻璃样变纤维化。在既往被报道过的病例中,3例富于细胞区可见有大小不一的嗜酸性透明小球[10, 17, 18],1例有砂砾体[17]。更少见的情况是,肿瘤细胞呈现横纹肌样改变,具体表现为细胞增大、胞质显著嗜酸以及细胞核偏位[14]。可出现坏死和核分裂象。免疫组化染色结果:大部分病例肿瘤细胞表达α-inhibin、S-100、Vimentin和NSE。少部分病例中,肿瘤细胞EMA(4例)、CA9(3例)、CD10(3例)、EGFR(3例)、PAX-8(2例)和PAX-2(2例)呈阳性或局灶阳性。其他抗体包括AE1/AE3[17]、GLUT1[10]和HIF-1α[15]仅在单个个案中被报道呈阳性或局灶阳性。本例形态学特征及免疫组化染色结果均与文献报道一致,诊断为肾脏血管母细胞瘤明确。
肾脏血管母细胞瘤易与其他肿瘤混淆,如:肾透明细胞癌、肾上腺皮质癌、嗜铬细胞瘤等,其中最易混淆的是肾透明细胞癌。由于血管母细胞瘤肿瘤细胞胞浆淡染或嗜酸,胞质内可见有透明空泡,且具有丰富的毛细血管网,与透明细胞癌肿瘤细胞十分相似,因而有时在形态学上很难区分。免疫组织化学染色对区分这两种肿瘤有帮助。肾血管母细胞瘤肿瘤细胞α-inhibin、S-100、Vimentin和NSE阳性,而上皮标志物CK(AE1/AE3)和EMA常为阴性或仅局灶阳性,而肾透明细胞癌CK(AE1/AE3)和EMA通常为阳性。
肾脏血管母细胞瘤在2016版WHO肿瘤分类中为生物学行为不确定的肿瘤[20]。从文献报道来看,该肿瘤预后普遍较好,至今无复发和转移的报道。然而,由于病例数量有限,对于该肿瘤的生物学行为还需进一步随访观察。
肾脏血管母细胞瘤的组织来源至今不明。目前普遍认为肿瘤细胞来源于间充质器官特异性多能细胞,理由是肾血管母细胞瘤肿瘤细胞表达某些器官特异性抗原,如CD10、PAX-2和PAX-8,这些抗原在中枢神经系统血管母细胞瘤肿瘤细胞中均不表达[9, 14, 15, 17]。对于肿瘤内丰富的毛细血管网,一些学者认为其来源于反应性过程而非肿瘤本身,理由是中枢神经系统内的血管内皮细胞通常表达GLUT1而外周组织血管内皮细胞不表达,同时,中枢神经系统血管母细胞瘤的毛细血管网呈现GLUT1阳性而肾血管母细胞瘤血管内皮GLUT1阴性[10]。对于该肿瘤的发病机制目前尚无结论。不同于中枢神经系统血管母细胞瘤,肾脏血管母细胞瘤似乎与VHL基因改变无关[10,13,15,18,19]。另外,虽然曾有报道肾血管母细胞瘤肿瘤细胞EGFR免疫组化染色阳性,但却并未检测到EGFR基因突变[18]。关于这一肿瘤的发病机制,还有待进一步研究。
肿物周围肾实质肾小管萎缩、肾小球纤维化,同时见有慢性炎细胞浸润,这些特征在既往文献中未曾报道。我们尚不清楚周围肾实质的这种变化与肿瘤本身是否有关系。虽然肾实质的改变可以来自于肿瘤生长对周围肾脏的挤压,但是我们不能排除其他更深在的原因。例如,慢性炎症的刺激可能会活化间充质器官特异性多能细胞,从而导致肿瘤的发生。对于这种变化与肿瘤的关系,未来还需继续探索。
综上所述,肾脏血管母细胞瘤是一种罕见的肿瘤,该肿瘤有着独特的临床病理学特征,目前发现经手术切除后一般预后较好。在日常诊治工作中,医师应加强对该肿瘤的认识,避免将其误诊为恶性肿瘤从而导致不必要的治疗。
[1]Boughey AM, Fletcher NA, Harding AE. Central nervous system haemangioblastoma: a clinical and genetic study of 52 cases[J].J Neurol Neurosurg Psychiatry,1990,53(8):644.
[2]Rojiani AM, Owen DA, Berry K, et al. Hepatic hemangioblastoma. An unusual presentation in a patient with von Hippel-Lindau disease[J]. Am J Surg Pathol,1991,15(1):81.
[3]McGrath FP,Gibney RG,Morris DC,et al.Case report:multiple hepatic and pulmonary haemangioblastomas-a new manifestation of von Hippel-Lindau disease[J].Clin Radiol,1992,45(1):37.
[4]Bird AV, Mendelow H. Lindau's disease in a South African family:a report on three further cases[J]. Br J Surg,1959,47:173.
[5]Fanburg-Smith JC, Gyure KA, Michal M, et al. Retroperitoneal peripheral hemangioblastoma: a case report and review of the literature[J]. Ann Diagn Pathol,2000,4(2):81.
[6]Patton KT, Satcher RL, Jr.Laskin WB. Capillary hemangioblastoma of soft tissue: report of a case and review of the literature[J]. Hum Pathol,2005,36(10):1135.
[7]Boyd AS, Zhang J. Hemangioblastoma arising in the skin[J]. Am J Dermatopathol,2001,23(5):482.
[8]Doyle LA, Fletcher CD. Peripheral hemangioblastoma: clinicopathologic characterization in a series of 22 cases[J]. Am J Surg Pathol. 2014,38(1):119.
[9]Nonaka D, Rodriguez J, Rosai J. Extraneural hemangioblastoma: a report of 5 cases[J]. Am J Surg Pathol,2007,31(10):1545.
[10]Ip YT, Yuan JQ,Cheung H,et al.Sporadic hemangioblastoma of the kidney: an underrecognized pseudomalignant tumor[J]. Am J Surg Pathol,2010,34(11):1695.
[11]Verine J, Sandid W, Miquel C, et al. Sporadic hemangioblastoma of the kidney: an underrecognized pseudomalignant tumor[J].Am J Surg Pathol,2011,35(4):623.
[12]Liu Y, Qiu XS, Wang EH. Sporadic hemangioblastoma of the kidney: a rare renal tumor[J]. Diagn Pathol,2012,7:49.
[13]Wang CC, Wang SM, Liau JY. Sporadic Hemangioblastoma of the Kidney in a 29-Year-Old Man[J]. Int J Surg Pathol,2012,20(5):519.
[14]Yin WH, Li J, Chan JK. Sporadic haemangioblastoma of the kidney with rhabdoid features and focal CD10 expression: report of a case and literature review[J]. Diagn Pathol,2012,7:39.
[15]Jiang JG, Rao Q, Xia QY, et al. Sporadic hemangioblastoma of the kidney with PAX2 and focal CD10 expression: report of a case[J]. Int J Clin Exp Pathol,2013,6(9):1953.
[16]Wang Y, Wei C, Mou L, et al. Sporadic renal haemangioblastoma: Case report and review of the literature[J]. Oncol Lett,2013,5(1):360.
[17]Zhao M, Williamson SR, Yu J, et al. PAX8 expression in sporadic hemangioblastoma of the kidney supports a primary renal cell lineage: implications for differential diagnosis[J]. Hum Pathol,2013,44(10):2247.
[18]Kuroda N, Agatsuma Y, Tamura M, et al. Sporadic renal hemangioblastoma with CA9, PAX2 and PAX8 expression: diagnostic pitfall in the differential diagnosis from clear cell renal cell carcinoma[J]. Int J Clin Exp Pathol,2015,8(2):2131.
[19]Wu Y, Wang T, Zhang P-P, et al. Extraneural hemangioblastoma of the kidney: the challenge for clinicopathological diagnosis[J]. J Clin Pathol,2015,68(12):1020.
[20]Moch H, Humphrey PA, Ulbright TM, et al. WHO Classification of Tumours of the Urinary System and Male Genital Organs[M]. Lyon: IARC Press,2016:67.
*通讯作者
1007-4287(2017)12-2197-03
2017-04-23)
