毛竹叶片衰老特性及衰老相关基因的筛选和鉴定
2017-12-25任育军杨树伟吴栋雄黄晨星管亦荣
任育军, 杨树伟, 吴栋雄, 黄晨星, 管亦荣, 缪 颖
(福建农林大学生命科学学院分子细胞和系统生物学中心,福建 福州 350002)
毛竹叶片衰老特性及衰老相关基因的筛选和鉴定
任育军, 杨树伟, 吴栋雄, 黄晨星, 管亦荣, 缪 颖
(福建农林大学生命科学学院分子细胞和系统生物学中心,福建 福州 350002)
收集野外定植3年的毛竹秆上具有明显衰老渐进特征的叶片簇,测量这些叶片的光合代谢效率(Fv/Fm)及叶绿素含量,建立毛竹不同衰老阶段叶片形态与其光合效率之间的关系.在此基础上,通过生物信息学方法(BLASTn)筛选出113个毛竹基因组中与水稻叶片衰老调控相关的同源基因,并检测这些基因在毛竹叶片发育和衰老过程中的表达趋势,鉴定一些与毛竹叶片衰老相关的标志基因.结果显示,毛竹叶片在衰老过程中其叶片的光合效率和叶绿素含量均出现显著下降;在筛选的113个基因中有86个基因在叶片中表达,其中32个基因在叶片衰老过程中没有变化,41个基因随着叶片衰老出现显著下调,13个基因出现明显上调.这些表达变化的基因与水稻中鉴定的同源基因在旗叶衰老过程中的表达模式基本一致,因此这些基因很可能在毛竹叶片衰老过程中也发挥同样的功能.
毛竹; 叶片衰老; 叶绿素; 光合作用效率; 衰老相关基因; 同源分析; 基因表达
毛竹是禾本目禾本科刚竹属单轴散生型常绿乔木状竹类植物,其资源丰富、生长快、成林早、产量高和材质优,被广泛应用于食品、药品、建筑材料、制作工艺品以及日常生活用品等,产生了巨大的经济和社会效益,是我国最重要的经济竹类.同时,毛竹也是世界上分布最广,森林覆盖率最高的竹种,因其具有强大的地下根系和高大的冠层[1,2],在调节气候、涵养水源、防风固沙和维持生态平衡等方面都发挥着重要功能,具有极强的生态效益[3-6].鉴于以上优点,毛竹在世界范围内都受到重视.但因毛竹开花和衰老的特异性,一生只开一次花,开花周期长,花期难以预测,并且随着开花和结实,毛竹迅速进入衰老和死亡.竹林的大面积开花将导致严重的经济损失和生态环境破坏,因此开展毛竹开花和花后衰老机制的研究将为控制毛竹开花时间、延长毛竹营养生长期和培育毛竹抗衰新品种提供依据.
由于受毛竹开花特性及试材获取等方面的限制,目前关于毛竹开花及花后衰老生理和分子机制方面的研究都非常少,严重制约着竹类衰老生物学的发展.叶片是植物进行光合作用合成各种生长所需有机化合物的重要场所,也是衰老最敏感的器官之一[7-9],其衰老机制在其它器官和组织的衰老调控中存在一定的共性[10-12].毛竹虽为多年生常绿植物,但其叶片有着明显的老幼更替过程,叶片的更迭具有典型的衰老渐进特征,因此解析毛竹叶片的衰老可能是揭示毛竹花后衰老分子机制的突破口.目前已经有一些生理学的试验检测了毛竹叶片衰老过程中的叶重、叶面积及元素内吸收率的动态[13],同时也监测了碳氮元素及灰分含量的变化[14],发现随着毛竹叶的衰老,叶重和叶面积等都会有一定比例的降低,灰分含量有所增加,氮和钾元素从衰老叶向其它部位转移,钙在衰老叶中聚集,而碳的含量则保持相对稳定[13,14],但其中涉及的分子机制尚未提及.本试验利用野外定植生长的毛竹叶作为材料,测量叶片衰老过程中的光合代谢效率和叶绿素含量变化,同时通过生物信息学方法筛选一些在毛竹叶片中可能存在的衰老相关基因,检测这些基因在叶片衰老过程中的表达趋势,从而初步鉴定一些与毛竹叶片衰老相关的调控基因,为后期进行竹类植物开花及花后衰老分子机制的研究提供依据.
1 材料与方法
1.1 材料
取定植于福建农林大学中华名特优植物园内3年的毛竹(Phyllostachysheterocyclavar.pubescens)竹竿枝条上着生的叶片,取材时间为2016年10月.挑选具有典型衰老渐进特征的叶片簇,用干净的湿布擦拭去除表面的污垢和灰尘,放置于铺有潮湿滤纸的保存盒中.收集的材料一部分用于测定叶片光合作用效率的相关参数;另一部分用于进行衰老基因的表达鉴定,材料置液氮中速冻后于-80 ℃保存.
1.2 方法
1.2.1 毛竹衰老叶片的形态观察 将取下的叶片簇置于EPSON Expression 11000XL扫描仪上进行扫描以获取叶片衰老的形态特征.
1.2.2 叶绿素荧光测定(Fv/Fm) 用英国Hansatech公司生产的Pocket PEA植物效率分析仪测定毛竹叶片光合系统Ⅱ的最大光合效率(Fv/Fm).对于整片叶的测量,选取离叶尖约0.5 cm的部位进行随机取点测定,每片叶取3个点,每种衰老状态的叶取12片进行测定.对于1片叶均分成上、中和下3段分别测定光合效率,取每段靠中间的部位进行测定,每个部位取3个点,取12片同一衰老状态的叶片进行测量.
1.2.3 叶绿素测定 用95%乙醇浸提法测量毛竹叶的叶绿素含量[15].每种衰老状态下的叶取12片进行测定.对于1片叶子均分为上、中和下3段分别测定叶绿素含量,取12片叶全部均分为上、中和下3段后分别测定,计算每个部位的平均值和标准差.
1.2.4 生物信息学分析 在植物叶片衰老数据库(LSD,http://psd.cbi.pku.edu.cn/)中找到以物种命名的项目(Species Table),下载所有水稻(Oryzasativa)衰老相关基因的基因座,同时参考已发表的水稻和小麦旗叶衰老转录组数据[16-18].利用植物基因组资源数据库(Phytozome,https://phytozome.jgi.doe.gov/pz/portal.html#)中收录的水稻基因组数据获取相关基因座的序列信息.利用这些序列在毛竹基因组数据库(BambooGDB,http://www.bamboogdb.org/)中进行BLASTn分析,寻找毛竹中可能存在的与水稻基因同源的基因.利用水稻eFP浏览器(http://bar.utoronto.ca/efprice/cgi-bin/efpWeb.cgi?dataSource=rice_leaf_gradient)对水稻中的相关基因进行叶片表达模式的分类,以便后期验证毛竹中筛选出的叶片衰老相关基因.
1.2.5 总RNA的提取和检测 采用全式金(TransGen)生产的TransZolUp总RNA抽提试剂对1.1中收集的样品进行总RNA提取,电泳检测完整性,并在NanoDrop2000上测定浓度.
1.2.6 cDNA第一链的合成 采用康为生物(CWBIO)生产的HiFiScript快速去基因组cDNA第一链合成试剂盒进行总RNA中基因组的消化和反转录合成第一链cDNA.用1 μg总RNA进行反转录.
1.2.7 引物设计 采用Beacon DesignerTM(Ver.7)专业引物设计软件对毛竹基因进行引物设计,退火温度控制在58~60 ℃,扩增产物控制在80~200 bp.将设计好的引物在毛竹基因组网站上进行BLASTn分析,检测引物特异性,确认无误后送上海生工生物公司合成(表1).内参基因为TIP41,扩增引物参照Fan et al[19]的文章所述.
续表1

基因名称正向引物(5'→3')反向引物(5'→3')MbLSAG56CGGCTATTTCCTCTCCAAAGGAGGTAATGGTGGTGTACTGMbLSAG57GCCTAGGAGTTGGAGACATAGTCGTTCTCAAGGAGTTCAGMbLSAG58GTGTCCTCATCTGAGAAACCGTACCATGTGACCAGAATCGMbLSAG59CTACAGCTCTGATGATCGTGCCCAGCATAAGATTCTCCAGMbLSAG60CTCTGTGTGACATTGACTGGGCTGGATCTGTAGTCTGTTGMbLSAG61CACCATCCGTTGTGACTATGTTACTCTTCCACTCCGCTACMbLSAG62CGGAACAGACCTTCATCATGGACTTCTCCACGTTCACAAGMbLSAG63GCGATATTCCACCTACTGTCCTTCCATGAGCTGGTCATAGMbLSAG64CCATACAACAGTGTCCTCTCCGGCAGATGTCATAGATAGCMbLSAG65CCTTGGTTCTCTTCTCCTTGGACAGGACACTGTTGTATGGMbLSAG66CATCTATGACATCTGCCACCGTGAGGATATGACCTGAGACMbLSAG67CGCCTGTCAGTAGATTATGGTCAGAGAATGAGTGGAGAGCMbLSAG68GTAGATTACGGCAGGAAGTCCTGTTATAAGGCTCGACGACMbLSAG69CAAGGTTCTGACCACCTAAGGATCAAAGGGTTGGAAGTCCMbLSAG70GAGTTGTCTCAGATCGTGTCGGCTGTGAAGTTGTCTCTTGMbLSAG71CAAGGAGAATAAGCAGGAGGGAACCAGCCAGATGATGTACMbLSAG72CAAAGGAGAACAAGCAGGAGCGAGAACCAGCCAGATAATGMbLSAG73CAAGTGAAGAGAGGGAAGAGCTGAGGTTGTACCAGAATCCMbLSAG74CCGACTCGTTCATCATCAACGAATGGAGAACCTGTCCTTCMbLSAG75ATGACCTACATCGGCTACTCCATCATCTGTGCGTACAGTCMbLSAG76GGATGACCTACATTGGCTACGGAGATGGAGAAGTGAACCTMbLSAG77GGCACCTAACTTAACTCCAGGCCATCTGTATCCATCACTCMbLSAG78CTCGATAAGAACCTAGCCACGCTCTGCTCAATGAGGTAAGMbLSAG79CACCCTCGATAAGAATCTGGGCTCTGCTCGATGAGATAAGMbLSAG80CCTTAACCATGTGACCTACCCAATGCAGTAAGGAACCTCCMbLSAG81CAAGAAGACTGCCTCTGTACCACTTCTTCCTGACCTCATCMbLSAG82GGCTGAAGAGAAGACTGTTGGCTCTGCTCAATCAGGTAAGMbLSAG83GGTTCGGCCAATCAGATTAGGACTATCCAATGAGAGCCAGMbLSAG84GCTACGCCATCATCATACTGCCATTGTAGGACTTGCTCTCMbLSAG85GCCACTGGTATTCATCTAGGGGTGATACACGTTCCAGTAGMbLSAG86CGGGTACACCATCATCATACCGACGATATAGGAGGTCTTCMbLSAG87CGTACTGCTCAAGCTAAGTCGCATTCCTGAGAAGATCCAGMbLSAG88CGGAGGTATTGTAGAGGTGTCAGCGTTACTCTCAGCATTCMbLSAG89CTGGCTCTCAAATGACACTCGCATCTCATAGAGTCCCTTCMbLSAG90CAATCCTAAGAAGAGCGAGGGCACCTGAGAGTCATTTGAGMbLSAG91CCAGGAAGGCTTATGATGAGCTTGTACGCGAAGAGATGTGMbLSAG92GGAGATTGGTGAGATGGAAGCTCAGGATTGGTGTCAACTGMbLSAG93GAAGTGGAGGATTCAGTTCCCTCACTCTTCTCAGGATTGGMbLSAG94CAAGAAGAGGTTCAGGAAGGCGAGGACGGAGTAGATAAGAMbLSAG95CCTTATCAGGGTGTCAATGGGGGTGATGTTAATGGAGTCCMbLSAG96GAGAGCTGGTTTCAGTATCCGAAGAGTGGTTGGACTAAGGMbLSAG97CTAACGAGGAGGATGAAAGGGGTGGCAGCAGTAGTAATAGMbLSAG98CATGGTGGAGTTACTGAGACGAGAGTGTTGACGAGACATCMbLSAG99CTACTACATCTTCCGCAAGGGGGAGGTTAGAGTGGAAGTAMbLSAG100CTTCAACCTGACCAAGAACGCCAAAGAGCTTGGAGAACTCMbLSAG101TCGACTACCTCTCATACCACGGTTGAAGAGCTTGTGGATGMbLSAG102GCAGAGTCTGGAAGTCAAACCAGTGTCCTCTCCTTCTCTTMbLSAG103CTGAAGAACTGCACAGTCTGCTTACCTATCTGCTGCTCCAMbLSAG104GACACCTATGCTGGAGAGTACCTCGTATCTATGCCCATTGMbLSAG105CCTTGAAGAGAACGGTACTGCGAGTCCAGAGAAGTTGATGMbLSAG106CTCGGTCGAGGTTATTGAAGCAAGGGTCTCCTGATGATACMbLSAG107GAAGGTGGTTGACATCATCGGCTTGACAGTGAGGTTCTTGMbLSAG108CTACAAGGATGGATCTACCGCAACCGAGAGGGAGATATCAMbLSAG109GCAGAGAAGACCAAGACTACGGGTATCGATTCCCATCATGMbLSAG110GTCTACACTGACAACGAAGGGGATATGCTGTCTGGTCTTGMbLSAG111GGAATCTTACCTGGCTGAAGGCTGGCTTTCCTATCTCTACMbLSAG112GTAACAGAGATGATCGTCGGCTGGTCGGTAGTGATGTAAGMbLSAG113GAATACTCGACTCCAGGTTGGATAATGGTAGGCGTTCTCC
1.2.8 半定量PCR 采用康为生物(CWBIO)生产的2×Es TaqMasterMix系统配制PCR反应体系.内参基因TIP41作为对照,对1.2.6中合成的不同衰老叶片来源的cDNA进行一致化,反应体积为20 μL,标准模板量为1 μL.PCR反应在Thermo ARKTIK热循环仪上进行.每种衰老状态的叶片或叶片部位进行3个生物学重复(每个重复包含4片叶子)和3次技术重复.反应条件为:98 ℃ 30 s,95 ℃ 20 s,57 ℃ 30 s,72 ℃ 30 s,循环数为25~28个.产物于2.0% TAE琼脂糖凝胶上进行分离,并在上海培清JS-780全自动数码凝胶成像分析系统上进行条带大小检测和强度分析.
2 结果与分析
2.1 毛竹叶片簇叶片逐级衰老过程中的形态、光合代谢效率和叶绿素含量变化
选用野外定植3年毛竹竿枝条上着生的具有显著衰老渐进特征的叶片簇,对它们进行衰老形态、光合代谢效率(Fv/Fm)和叶绿素含量的分析.如图1A所示,典型的毛竹竿枝条分支末端一般着生有5~7片叶的叶片簇,叶与叶之间交叉排布,离分支点越近的叶年纪越大(L1),越远的叶越幼嫩(L7).在老叶和幼叶更替的过程中,老叶逐渐衰老(L1-L4),呈现出失绿、枯黄和皱缩的表型,最终干枯和脱落;在老叶和幼叶之间是成熟叶(L5-L6),叶色油绿色深、叶面平展,叶面积也较大;而幼叶(L1) 则颜色较浅,叶片柔软.叶绿素荧光(Fv/Fm)是指示光合代谢效率的重要指标,其数值的大小与叶片的衰老程度正相关.因植物叶片衰老一般从顶端和边缘起始[7,11],因此对整个毛竹叶片簇从老到幼的叶片顶端进行叶绿素荧光测定.结果显示,幼叶的叶绿素荧光值最高,达到0.81,成熟叶比幼叶的值略低一点,但随着叶片进入衰老程序,叶绿素荧光逐渐降低,并且在最老叶中达到最低(图1B).这一结果与叶片衰老的形态特征相对应,表明毛竹叶片的衰老与其光合效率的衰减是一致的.

A.叶片簇叶片的衰老形态,序数代表叶片由老到幼的顺序;B.叶片簇不同叶片的光合代谢效率(Fv/Fm);C.叶片簇不同叶片中叶绿素a、b和总叶绿素含量的比较.图1 毛竹叶片簇叶片逐级衰老形态及衰老相关生理特性Fig.1 Morphology and related physiological characteristics of moso bamboo leaves during leaf senescence process
叶绿素含量也是表征叶片衰老程度的指标之一[20-22].我们检测了毛竹叶片生长和不同衰老程度下整片叶中的叶绿素含量.结果如图1C所示,在叶片从幼叶(L7)到成熟叶(L6-L5)生长的过程中,不论是叶绿素a(Chl a)、b(Chl)还是总叶绿素(total Chl),它们的含量均有较明显的上升,在L5中达到最高,表明叶片在生长的过程中伴随着叶绿素的大量积累(合成>降解);但当叶片进入衰老阶段后(L4-L1),叶片中的叶绿素含量出现明显下降(降解>合成),并随着叶片衰老程度的加深,叶绿素的含量降至最低.以上结果表明,毛竹叶片在生长和衰老的不同阶段叶绿素含量经历了从升高到降低的变化过程,这与观察到的毛竹叶色变化特征相一致.
综合以上试验,结果表明毛竹叶片的衰老与其它植物叶片的衰老一样具有典型的衰老形态和衰老生理特性,可以用一般的叶片衰老标定方法对毛竹叶片的衰老过程进行表征.
2.2 衰老毛竹叶片顶端、中部和基部光合代谢效率和叶绿素含量比较
如上所述,植物叶片的衰老一般从叶的顶端起始并逐级向叶的基部延伸[7,11],在衰老叶片的顶端、中部和基部表现出的衰老表型、光合代谢效率以及叶绿素含量均应存在一定的差异[10].因此,除比较了毛竹叶片簇叶片的整体衰老特征外,还比较了单个衰老叶片在顶端、中部和基部的衰老表型.如图2A所示,衰老叶片的顶端(tip)出现明显的黄化甚至褐化表型,表明叶片顶端已经完全进入衰老模式,而在中部(middle)和基部(base)则还保持着与成熟叶片较为接近的叶色.与叶色的表型一致,叶绿素荧光(Fv/Fm)测定的结果显示衰老叶片的顶端光合代谢效率很低,而中部和基部则较高,特别是基部,其代谢效率几乎与成熟叶中的效率相当(图2B),表明对于整片毛竹叶而言,其衰老从基部到顶端是一个逐渐加剧的过程.同样,叶绿素含量的测定也显示在叶片顶端叶绿素a、b和总叶绿素的含量也最低,其次为中部,在基部的叶绿素含量最高,接近衰老早期叶片中的叶绿素含量(图2C).以上结果表明,对单个毛竹叶片而言,其衰老特征在叶的顶端、中部和基部也存在明显的差别,与毛竹叶片簇中叶片顺序衰老反映的调控机制可能类似.
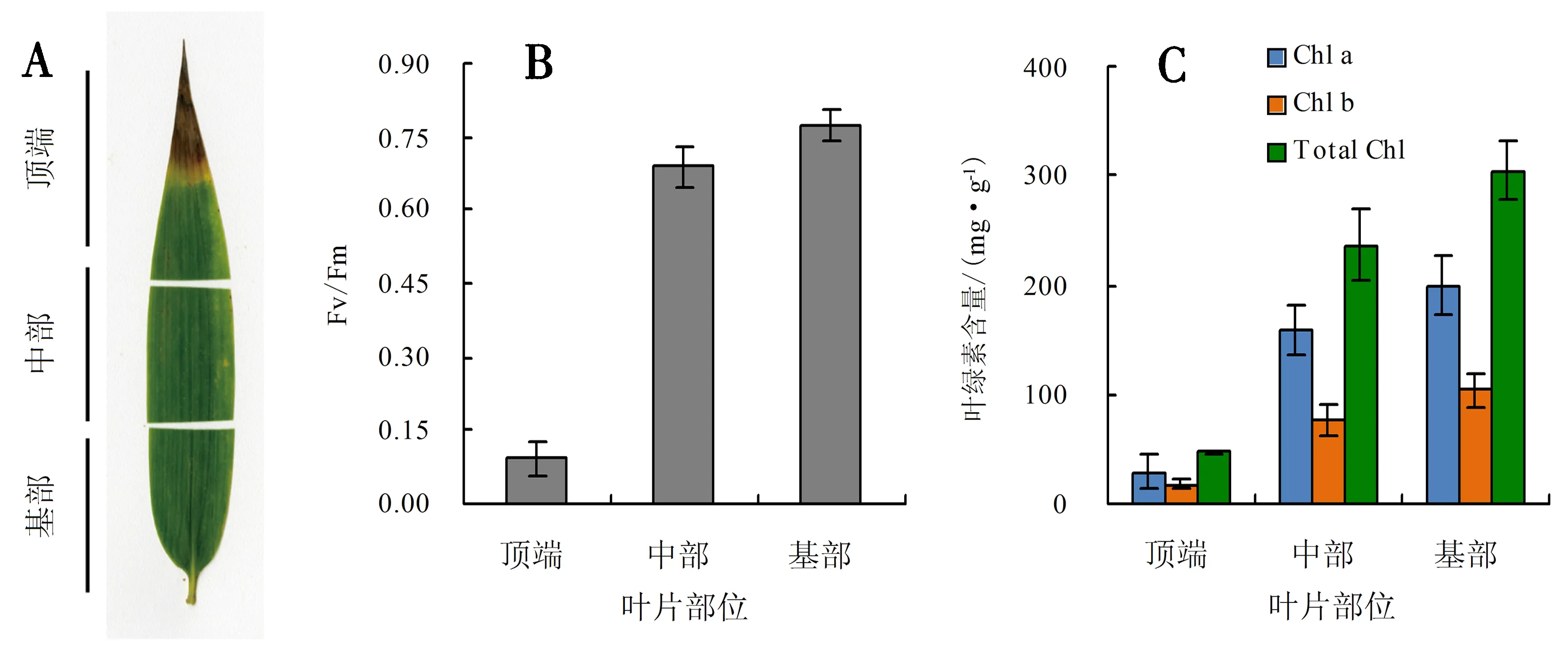
A.衰老叶片顶端、中部和基部的形态;B.衰老叶片顶端、中部和基部的光合代谢效率(Fv/Fm)比较;C.衰老叶片顶端、中部和基部的叶绿素a、b和总叶绿素含量比较.图2 衰老毛竹叶片顶端、中部和基部的形态和衰老相关生理参数比较Fig.2 Comparison of morphology and senescence related physiological parameters in the top, middle and basal parts of senescent moso bamboo leaves
2.3 毛竹叶片衰老相关基因筛选
鉴于毛竹叶片的衰老表型和衰老生理变化与其它植物特别是单子叶植物叶片的衰老特征极为相似[16,17,20],那么在毛竹基因组中存在的与其它植物中鉴定的叶片衰老相关基因的同源基因可能在毛竹叶片的衰老调控中也发挥着同样的功能.因此,根据前人研究发现毛竹基因组和单子叶植物特别是水稻基因组之间有着高度的同源性[23],利用水稻和小麦中鉴定的叶片衰老相关基因对毛竹基因组进行BLASTn分析,筛选一些毛竹基因组中可能存在的叶片衰老相关基因(图3A).对来源于水稻中的112个衰老相关基因利用水稻eFP浏览器进行了表达模式的分类,显示90%以上的基因在衰老叶片中的表达分为6种模式,其中3种是在叶片基部(base)表达最高(type 1-3),随着向叶片中部(middle)和顶端(tip)的延伸表达水平逐渐降低,并在顶部表达最低或完全不表达,这3种表达类型的基因属于叶片衰老负调控或负相关基因(ClassⅠ),另3种情况则正好相反,是在叶片的顶端(tip)表达水平最高(type 4-6),并随着叶片从中部(middle)向基部(base)方向延伸表达水平逐渐降低,并在基部表达水平达到最低或完全不表达,这3种表达类型的基因属于叶片衰老正调控或正相关基因(ClassⅡ)(图3B).将通过同源比对(E值≤10-20)筛选出的320个毛竹基因按照水稻中同源基因的表达模式进行分类,其中228个基因属于ClassⅠ类型,72个基因属于ClassⅡ类型.

A.利用水稻叶片衰老基因数据同源比对筛选毛竹基因组中可能存在的叶片衰老相关基因实验流程;B.衰老相关基因在水稻叶片中的表达模式、分类和数量.图3 同源比对分析筛选毛竹基因组中与叶片衰老相关的基因Fig.3 Blastn analysis to screen candidate leaf senescence-associated genes in moso bamboo genome
2.4 筛选的毛竹叶片衰老相关基因在毛竹叶片簇不同衰老程度叶片中的表达
为了对筛选到的基因进行鉴定,利用半定量PCR对这些基因在毛竹衰老叶片簇不同衰老程度叶片中的表达进行分析.选取针对水稻75个衰老基因的113个毛竹同源基因进行分析,这些基因覆盖了图3B中的所有表达类型.对这些基因利用毛竹叶片簇混合叶片总RNA反转的cDNA作为模板首先检测它们在叶中是否表达以及扩增特异性.结果表明,在抽提的混合叶总RNA质量可靠的前提下(图4A),PCR的结果显示有86个基因在叶中表达并具有扩增特异性(图4B).因此在这些基因中进一步鉴定与毛竹叶片衰老相关的基因.
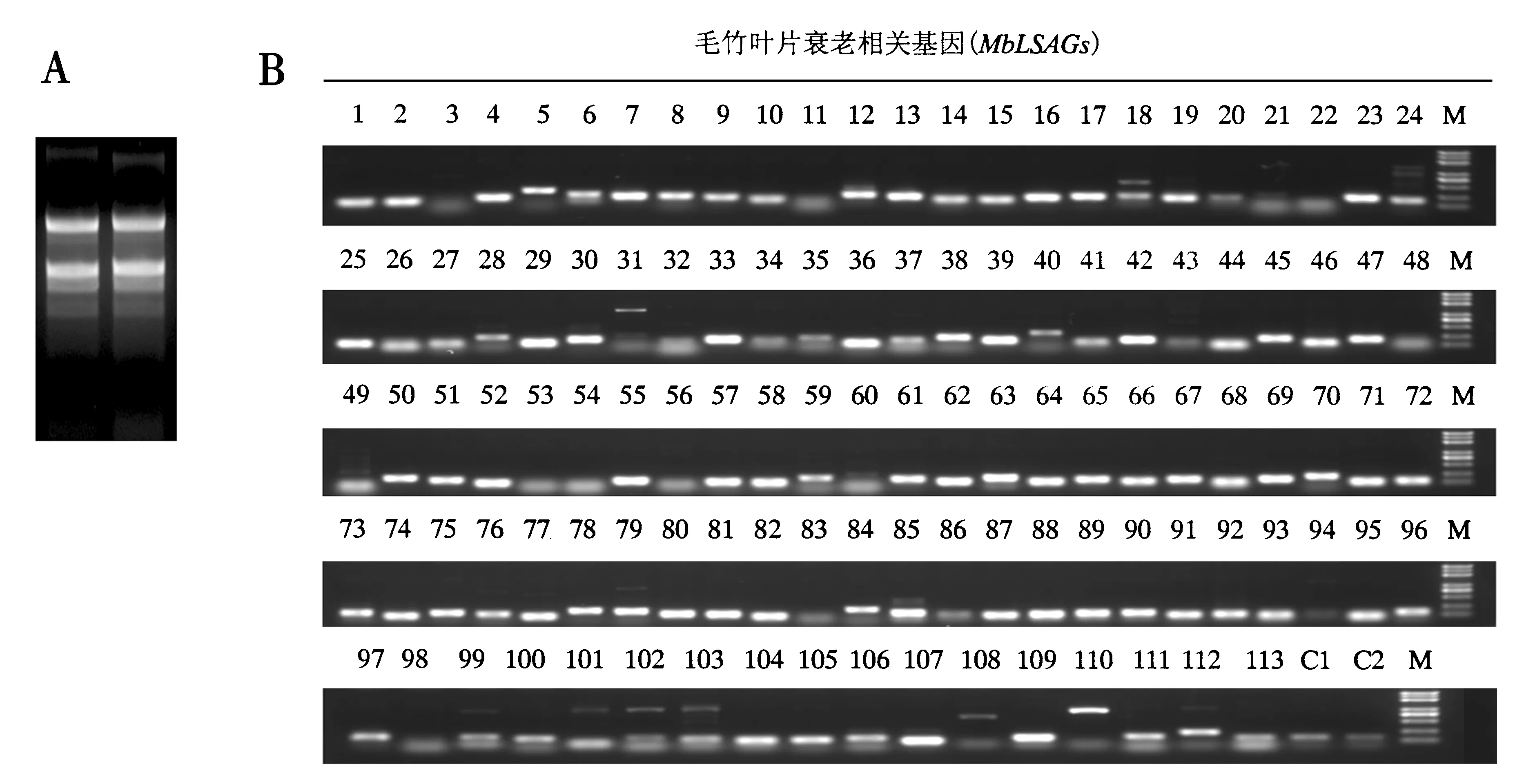
A.毛竹叶总RNA电泳图;B.候选基因PCR扩增产物电泳图.数字1~113代表基因的编号,如1代表MbLSAG 1;C1和C2:对照基因TIP41;M:DL5000.图4 毛竹叶片衰老相关候选基因半定量PCR引物验证Fig.4 Expression and primer amplification specificity verification of screened moso bamboo leaf senescence-associated genes in a mixed leaf cluster
分别提取衰老叶片簇第2(L2)、4(L4)和6(L6)片叶片的总RNA,以内参基因TIP41作为对照,比较这86个基因在3种衰老状态叶片中的表达水平.结果如图5所示,这些基因在3种衰老程度叶片中均有表达,它们的表达模式主要集中在与水稻衰老叶片表达模式中类似的第3和第4种类型(图3B),并未出现第1和第6种的极端类型,也有少量类似第2种类型(如MbLSAG67和MbLSAG100).将这些基因的表达变化进行叶片衰老关联分析,发现有39个基因在成熟叶中的表达水平明显高于衰老叶,并且随着叶片衰老的进程呈下调趋势(ClassⅠ)(图5A);同时,有13个基因在成熟叶中的表达水平明显低于衰老叶,并且随着叶片衰老的进程呈上调趋势(ClassⅡ)(图5B);除此之外,剩余的34个基因在3种衰老程度叶片中没有显著的表达差异(图5C).以上结果表明,在毛竹叶片簇叶片衰老过程中至少有52个筛选的叶片衰老相关基因发生了显著的表达变化,这些基因很可能在毛竹叶片衰老过程中发挥作用.

A.叶片基部中表达高于顶部的基因;B.叶片基部中表达低于顶部的基因;C.叶片基部和顶部中表达无差异的基因.图5 叶片衰老相关候选基因在毛竹叶片簇不同衰老程度叶片中的表达水平比较Fig.5 Comparison of the expression level of candidate leaf senescence-associated genes in leaves with different senescence degrees in a moso bamboo leaf cluster
2.5 筛选的衰老相关基因在毛竹衰老叶片基部、中部和顶端的表达
单片毛竹衰老叶片不同部位的光合代谢效率及叶绿素含量的数据显示其与毛竹叶片簇中不同叶龄叶片的衰老变化趋势类似(图1和图2),表明即使是单片毛竹叶片,其不同部位也可能在分子水平上存在衰老调控的差异.因此,在衰老叶片的基部、中部和顶端区域分别检测以上86个基因的表达情况,从而鉴定在叶片不同部位中有表达差异的基因.结果如图6所示,以内参基因TIP41作为对照,所有86个基因在衰老叶片的所有部位中都表达,而且表达模式与水稻叶片中衰老相关基因表达模式的第3和第4种类型相似,没有看到其它表达类型的存在,表明这些基因在毛竹衰老叶片不同部位中的表达具有连续性. 同样,将这些基因的表达水平与对应叶片部位所处的衰老程度进行关联,发现有41个基因在叶片基部(base)的表达明显高于叶片顶端(tip),并且随着叶片从基部向顶端的延伸呈下调趋势(ClassⅠ)(图6A);与此相反,有13个基因在叶片基部的表达水平明显低于叶片顶端,而且随着叶片从基部向顶端延伸呈上调趋势(ClassⅡ)(图6B);除此之外,剩余的32个基因在衰老叶片基部、中部和顶端中没有显著的表达差异(图6C).有趣的是,在毛竹叶片簇不同衰老叶龄叶片中鉴定的所有有表达差异的衰老相关基因也在衰老叶片的不同部位中存在差异表达,表明不论是毛竹叶片簇的不同衰老叶片还是单独衰老叶片的不同部位,这些与叶片衰老相关的基因可能都发挥着同样的功能,它们在毛竹叶片的衰老调控中发挥着重要作用.另外,从结果可以看出,单片衰老叶片中鉴定的衰老相关基因数量要比叶片簇整体衰老叶片中鉴定的数量多(图5和图6),表明随着对毛竹叶片衰老程度的进一步细分(如像水稻中将叶片从基部到顶部细分成11个区域),应该可以鉴定出更多与毛竹叶片衰老相关的基因.

图6 叶片衰老相关候选基因在衰老叶片不同部位中的表达水平比较Fig.6 Comparison of the expression level of candidate leaf senescence-associated genes in the top, middle and basal parts of senescent moso bamboo leaves
3 讨论
衰老是植物感应生长和发育的需要以及响应外界环境的变化实现自保和快速繁衍后代的生存机制,可以是某个组织或器官的衰老也可以是整个个体功能丧失从而走向死亡的过程[7,11,24].叶片作为植物进行光合作用从而提供生长所需物质和能量的重要场所,是植物衰老最敏感的器官之一.叶片衰老是一种程序性细胞死亡的过程,但与其它程序性细胞死亡不同,叶片衰老会导致整个叶片的死亡.对一年生植物而言,叶片衰老代表了植株整体的衰老状态,而对多年生植物而言,叶片衰老代表着对季节更替和对极端环境的响应[7,11].叶片衰老的速度比较慢,主要作用是动员衰老叶片中的碳、氮和矿质营养等转移到其它器官如新生组织、块茎和种子中重新分配[25-27].除受内部遗传因素影响外,叶片衰老还受到多种环境因子的诱导[11].目前已经分离出多种调控植物衰老的基因,如SAG12、SPA15、Osl2、See1、WRKY53和LSC7等[24].植物体内的激素如细胞分裂素、生长素和赤霉素等具有延缓叶片衰老的作用,而茉莉酸、水杨酸、乙烯和脱落酸等则能促进叶片的衰老.另外,环境因子如黑暗、干旱、高温、高盐以及病原体侵袭等也会加速叶片衰老的进程[11].因此,解析叶片衰老的机制不仅对调控叶片衰老进程和延长功能叶的持绿期具有重要指导意义,也是从局部到整体了解植物在整个生命周期中感受内部遗传调控和响应外部环境变化协同作用最终决定自身发育命运的基础.
毛竹开花引起的植株迅速衰老和死亡是世界性难题.因毛竹生命周期长、开花时间不可预期以及材料获取困难等因素限制,目前只有零星的报道其叶片衰老过程中碳氮元素和灰分含量的变化分析[13-14],对毛竹花后衰老分子机制的解析一直未取得实质性进展.本研究根据前人工作的基础和自身长期的观察,发现毛竹花后衰老植株整体死亡的过程和一年生植物如水稻等花后衰老和死亡的过程非常类似[16-17].尽管毛竹有漫长的营养生长期,但其植株花后衰老最先展现的特征就是叶片由绿变黄然后全部枯萎和脱落,因此提出从毛竹叶片的衰老机制入手寻找一些花后植株整体衰老分子调控的线索.本研究比较了野外定植毛竹叶片簇中的不同衰老程度叶片以及单片衰老叶基部、中部和顶端不同区域的衰老形态和生理特性变化,发现不论在哪种情况,毛竹叶片均展现出典型的衰老渐进特性,在年轻叶和成熟叶中具有较高的光合代谢效率和叶绿素含量,而在衰老叶中这些指标均出现显著的下降(图1和图2),表明毛竹叶片的衰老过程存在精细的分子调控机制.有趣的是,毛竹叶片衰老的形态和生理特征和单子叶植物水稻和小麦等旗叶的衰老特征相似[16-17],而且毛竹基因组和水稻基因组在进化上存在高度的保守性[23],表明水稻和小麦旗叶中鉴定的衰老相关基因以及衰老调控机制很可能也适用于毛竹叶片的衰老研究.通过转录组分析,前人发现水稻和小麦旗叶衰老过程中存在大量功能相同基因的表达变化,这其中的很多基因已经在其它植物中被证明与衰老直接相关,而且这些基因主要涉及大分子的降解和营养元素的转移,特别是碳氮元素和氨基酸的代谢等[16-17].本课题利用水稻中获得的衰老基因数据作为前体,通过同源比对在毛竹基因组中筛选到大量与水稻衰老基因同源的基因,并利用半定量PCR在野外定植毛竹的两套叶片衰老系统中对这些可能的衰老基因进行表达鉴定(图5和图6),筛选出54个表达有显著变化的基因,其中41个为衰老负相关基因,13个为衰老正相关基因,并且这些基因在衰老叶片中的表达趋势与它们在水稻中同源基因的表达趋势基本一致(图3,从Class的角度),这也进一步说明这些有表达差异的基因在毛竹和水稻中的功能可能具有保守性,后期可以借助水稻系统对这些毛竹中的衰老相关基因进行进一步的功能分析.
[1] 陈凤和.毛竹丰产林培育与合理经营的探讨[J].中国林业产业,2016(10):110.
[2] 顾琪,陈霜霜,彭悦,等.集约经营模式下毛竹的空间分布格局[J].南京林业大学学报(自然科学版),2016(1):162-168.
[3] 黄德龙,黄秀美,邱尔发.不同密度近熟杉木林套种毛竹生态效应研究[J].内蒙古林学院学报,1999(3):69-74.
[4] 王艳红,宋维峰,李财金.不同森林类型林冠截留效应研究[J].亚热带水土保持,2008(3):5-10.
[5] 张国良,张玉军.基于生态、经济与文化相协同的竹产业集群发展模式研究[J].科学管理研究,2013(1):61-65.
[6] 李睿.历史时期中国竹林分布对气候变化的响应[J].竹子研究汇刊,2002(2):67-70.
[7] THOMAS H. Senescence, ageing and death of the whole plant[J]. New Phytol, 2013,197(3):696-711.
[8] GAN S S, HORTENSTEINER S. Frontiers in plant senescence research: from bench to bank[J]. Plant Molecular Biology, 2013,82(6):503-504.
[9] LIM P O, KIM H J, NAM H G. Leaf senescence[J]. Annual Review of Plant Biology, 2007,58:115-136.
[10] THOMAS H, HUANG L, YOUNG M, et al. Evolution of plant senescence[J]. BMC Evolutionary Biology, 2009,9:163.
[11] PENNAZIO S. Plant senescence. A complex lesson of biology of development[J]. Biology Forum, 2009,102(3):399-419.
[12] GUO Y, GAN S. AtMYB2 regulates whole plant senescence by inhibiting cytokinin-mediated branching at late stages of development in Arabidopsis[J]. Plant Physiol, 2011,156(3):1 612-1 619.
[13] 林益明,彭在清,林鹏.毛竹叶片衰老过程的叶重量、叶面积及元素内吸收率的动态[J].植物学报,2004,46(11):1 316-1 323.
[14] 潘贤强.毛竹叶片衰老过程碳氮元素及灰分含量的季节动态[J].福建林业科技,2011,38(4):38-40.
[15] WELLBURN A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology, 1994,144(3):307-313.
[16] GREGERSEN P L, HOLM P B. Transcriptome analysis of senescence in the flag leaf of wheat (TriticumaestivumL.)[J]. Plant Biotechnol J, 2007,5(1):192-206.
[17] LIU L, ZHOU Y, ZHOU G, et al. Identification of early senescence-associated genes in rice flag leaves[J]. Plant Mol Biol, 2008,67(1-2):37-55.
[18] LIU L, XU W, HU X, et al. W-box and G-box elements play important roles in early senescence of rice flag leaf[J]. Sci Rep, 2016,6:20 881.
[19] FAN C, MA J, GUO Q, et al. Selection of reference genes for quantitative real-time PCR in bamboo (Phyllostachysedulis)[J]. PLoS One, 2013,8(2):e56573.
[20] TANG Y, WEN X, LU C. Differential changes in degradation of chlorophyll-protein complexes of photosystem Ⅰ and photosystem Ⅱ during flag leaf senescence of rice[J]. Plant Physiol Biochem, 2005,43(2):193-201.
[21] MIAO Y, LAUN T M, SMYKOWSKI A, et al. Arabidopsis MEKK1 can take a short cut: it can directly interact with senescence-related WRKY53 transcription factor on the protein level and can bind to its promoter[J]. Plant Molecular Biology, 2007,65(1-2):63-76.
[22] REN Y, LI Y, JIANG Y, et al. Phosphorylation of WHIRLY1 by CIPK14 shifts its localization and dual functions inArabidopsis[J]. Molecular Plant, 2017,10(5):749-763.
[23] PENG Z, LU Y, LI L, et al. The draft genome of the fast-growing non-timber forest species moso bamboo (Phyllostachysheterocycla)[J]. Nat Genet, 2013,45(4):456-461,461e.
[24] THOMAS H, OUGHAM H. Introduction to a virtual issue on plant senescence[J]. New Phytol, 2016,212(3):531-536.
[25] PROCHAZKOVA D, WILHELMOVA N. Nitric oxide, reactive nitrogen species and associated enzymes during plant senescence[J]. Nitric Oxide, 2011,24(2):61-65.
[26] AVILA-OSPINA L, MOISON M, YOSHIMOTO K, et al. Autophagy, plant senescence, and nutrient recycling[J]. Journal of Experimental Botany, 2014,65(14):3 799-3 811.
[27] KROGER R, HOLLAND M M, MOORE M T, et al. Plant senescence: a mechanism for nutrient release in temperate agricultural wetlands[J]. Environ Pollut, 2007,146(1):114-119.
Leafsenescencecharacteristicsandthescreenandidentificationofleafsenescenceassociatedgenesinmosobamboo
REN Yujun, YANG Shuwei, WU Dongxiong, HUANG Chenxing, GUAN Yirong, MIAO Ying
(Center for Molecular Cell and Systems Biology, College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Clusters of moso bamboo (Phyllostachysheterocyclavar.pubescens) leaves that showed obvious progressive senescence characteristics in bamboo culms and have been planted in field for 3 years were collected. Photochemical efficiency of photosystem Ⅱ (Fv/Fm) and chlorophyll contents were measured in these leaves so as to establish a relationship between leaf senescence degree and photosynthesis efficiency. Meanwhile, by using bioinformatics analysis (BLASTn), 113 genes in bamboo genome which showed homology to the leaf senescence-associated genes of rice (Oryzasativa) were obtained, and their expression trend in leaves during development and senescence process were detected, which aimed to discover some leaf senescence associated marker genes. The results showed that photochemical efficiency of photosystem Ⅱ and the contents of chlorophyll in bamboo leaves decreased significantly during senescence. And in the detection of gene expression, 86 out of the 113 genes were expressed in bamboo leaves. Among them, expression levels of 32 genes remained the same, but expression levels of 41 genes significantly decreased during leaf senescence process, while those of 13 genes increased. The expression pattern of those differentially expressed genes in moso bamboo are very similar to their homologous genes in rice plant during flag leaf senescence process, indicating that these genes may play the same regulatory function in both rice and bamboo which are associated with leaf senescence.
moso bamboo; leaf senescence; chlorophyll; photosynthesis efficiency; senescence-associated genes; homology analysis; gene expression
2017-07-28
2017-09-21
“十二五”农村领域国家科技计划课题(2015BAD04B01-2).
任育军(1980-),男,博士,助理研究员.研究方向:植物发育生物学.Email:ryj@fafu.edu.cn.通讯作者缪颖(1965-),女,教授,博士生导师.研究方向:植物分子细胞生物学.Email:ymiao@fafu.edu.cn.
S718
A
1671-5470(2017)06-0630-11
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.006
(责任编辑:吴显达)
