芳香化酶(P450arom)mRNA在黄鳝脑组织中的表达
2017-12-14张厚梅王琳
张厚梅,王琳
(安徽生物工程学校,安徽 合肥 230031)
芳香化酶(P450arom)mRNA在黄鳝脑组织中的表达
张厚梅,王琳
(安徽生物工程学校,安徽 合肥 230031)
为了揭示芳香化酶与黄鳝性逆转之间的内在联系和作用机制,本研究以不同性别黄鳝的脑组织为试验材料,采用实时定量PCR方法揭示P450arom mRNA在不同性别黄鳝的脑组织上的表达规律。实时定量PCR结果表明P450arom mRNA在雌性、雌雄间性、雄性黄鳝的脑组织中均有表达,其表达水平不断下降。总之,黄鳝脑组织中的芳香化酶可能参与黄鳝的性逆转过程,且与其性别转化密切相关,推测黄鳝脑组织中的芳香化酶的表达水平高低对黄鳝的性逆转可能起着决定性的作用。
黄鳝;芳香化酶;性逆转
芳香化酶(P450arom)属于细胞色素P450家族中的一员,是类固醇激素代谢中的关键酶,广泛存在于大多数脊椎动物的脑和性腺中,它催化体内的雄激素转化为雌激素[1-2]。除猪科动物外,绝大多数哺乳动物以及鸟类中,P450arom只有一种,由Cyp19单基因编码[3]。鱼类芳香化酶有性腺型(P450arom A)和脑型(P450arom B)两种不同的形式。其中,P450arom A由Cyp19a基因编码,主要在卵巢中表达;P450arom B则由Cyp19b基因编码。主要在中枢神经系统表达[4-6]。研究表明,P450arom A参与雌激素生物合成和卵巢分化[7-9]。P450arom B在鱼类脑中的活性是其在哺乳动物脑中的100~1 000倍[10],一般认为它也参与性腺分化的调节。本实验为了进一步研究芳香化酶对黄鳝性逆转的作用机制,将采用分子手段分析芳香化酶基因在不同性别黄鳝脑组织的表达规律,探讨芳香化酶对黄鳝性逆转的调控机制。俞菊华[11]对黄鳝脑组织和性腺中P-450芳香化酶基因进行克隆并进行序列分析,结果发现它们的序列完全一致。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 2016年4—12月份,从安徽省肥西县境内共采购活体野生黄鳝128尾,实验室暂养,实验时,黄鳝体质量为50~180 g。
1.1.2 主要试剂 SYBR Premix Ex TaqTM(DRR041A)购自大连宝生物工程有限公司,TransScript First-Strand cDNA Synthesis Super Mix、RNA 提取试剂 (TransZol)、High pure dNTPs、DL2000 DNA Marker购自北京全式金生物技术有限公司。
1.2 实验方法
1.2.1 根据长度的不同,随后分批进行解剖 收集黄鳝脑组织,于-80℃冷冻保存,用于实时定量PCR分析。
1.2.2 总RNA的提取和反转录 使用反转录试剂盒,按照TRIzol试剂盒抽提总mRNA操作说明进行反转录反应,总体积20μL,反应体系如下:2μL总 RNA、1 μL Anchored Oligo(dT)18、10 μL 2×TS Raction Mix、6 μL Rnase-free Water、1 μLTransS-cript RT Enzyme Mix,42℃孵育 50 min,70℃加热15 min,反转录产物于 -20℃保存待用。β-actin、P450arom的引物序列参照Liu Jifang[12]文中的序列,并由上海生工生物有限公司合成,见表1。
1.2.3 实时荧光定量PCR 按以下比例浓度稀释cDNA:1、1×10、1×102、1×103、1×104copies/L,进行实时荧光定量PCR操作,制作标准曲线和溶解曲线,建立最佳的反应条件。

表1 大鼠基因的PCR引物序列
上游引物 (10 μmol/L)1 μL;下游引物(10 μmol/L)1 μL;SYBR Premix Ex TaqTM 12.5 μL;cDNA 2μL;无核酶水8.5μL。反应条件为:94℃预变性30 s;52℃ 30 s,70℃ 60 s,30个循环。 将目的基因的CT值(Threshold cycle)与标准曲线的CT值相比较,作为目的基因mRNA的相对含量,每个样本重复3次,以平均值表示最后结果。
1.2.4 统计分析 所有数据以“均数±标准差”表示,采用t检验,分析各组之间的差异显著性。
2 结果
2.1 标准曲线与溶解曲线
对10倍系列稀释的模板进行实时荧光定量PCR反应,得出扩增曲线(图1),溶解曲线(图2)和标准曲线(图3)。结果表明,溶解曲线成单一峰,说明目的基因和内参基因的引物特异性很好,标准曲线成良好的线性关系,且目的基因和内参基因扩增效率基本一致,可采用2-△△CT值法计算P450arom mRNA的相对表达量。
图 1 P450arom(A)、β -actin(B)基因的扩增曲线
图 2 P450arom(A)、β-actin(B)基因的溶解曲线
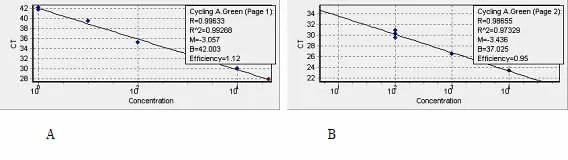
图 3 P450arom(A)、β-actin(B)基因的标准曲线
2.2 芳香化酶(P450arom)mRNA在黄鳝脑组织中的表达
在雌性、雌雄间性、雄性黄鳝脑组织中,其芳香化酶mRNA的表达水平逐渐下降(图4)。
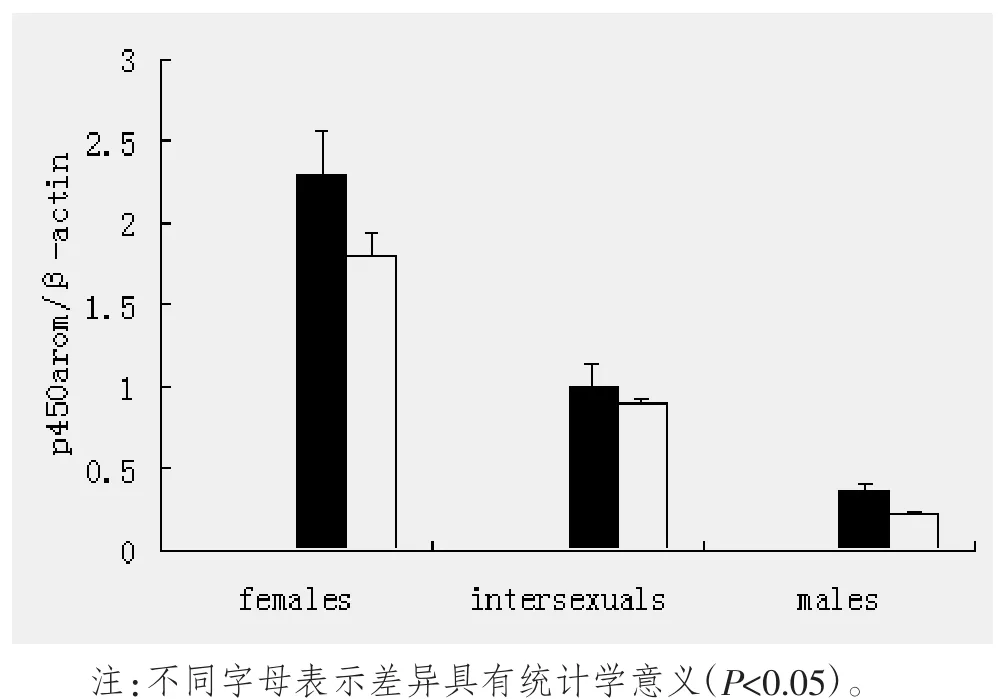
图4 P450arom mRNA在黄鳝脑组织中的表达
3 讨论与分析
芳香化酶是细胞色素P450家族中的一员,催化某些雄激素转化为雌激素,是雌激素生物合成中的关键酶和限速酶,广泛存在于大多数脊椎动物的脑和垂体中[13]。研究表明,芳香化酶参与非哺乳动物性腺分化的调控[14]。Wong TT[15]发现cyp19a1a的在性腺中的表达丰度与金头鲷的性转化密切相关。在鲈鱼性转化过程中,雌性鲈鱼的脑组织中的芳香化酶cyp19a1bmRNA的表达水平显著高于雄鱼[16]。Zhang[17]发现性腺中的P450aromA在雌性时其表达水平最高,雌雄间性时下降,到雄性时达到最低水平,P450aromB在间性时最高。由此可见,芳香化酶参与鱼类的性腺分化。黄鳝是一种具有天然单向性逆转特性的动物,雌性成熟发育的第一个周期内黄鳝个体全部表现为雌性,性成熟产卵后,卵巢内卵细胞败育,卵巢结构逐渐退化,与此同时雄性细胞开始发育,通过雌雄间性发育过渡到雄性发育。有研究表明芳香化酶参与黄鳝的性逆转调控,Liu等[12]发现P450arom mRNA在雌性、雌雄间性、雄性黄鳝的性腺中的水平不断下降,这充分说明芳香化酶与黄鳝性发育之间有着潜在的联系。Makoto P.Matsuoka[18]发现在大西洋大比目鱼的脑组织中P450arommRNA(cyp19a)的表达水平略高于性腺,脑组织中芳香化酶mRNA(cyp19b)的表达水平明显高于性腺,这意味着鱼类性别决定不仅与性腺中芳香化酶的表达水平有关,而且其在脑组织中的表达水平也可能与性别分化有关。目前,关于黄鳝的性逆转与芳香化酶mRNA的表达水平的内在联系仍较少报道。为了进一步探索黄鳝脑组织中芳香化酶的表达与黄鳝的性逆转的内在联系,本实验采用RT-PCR研究芳香化酶基因在不同性别黄鳝脑组织和性腺的表达规律,结果显示,在雌性、雌雄间性、雄性黄鳝脑组织中,其芳香化酶mRNA的表达水平逐渐下降,且其变化模式和在性腺中一致,这就意味着,黄鳝脑组织中的芳香化酶在其性逆转中也发挥着重要作用。同时,这和Ju-Hua Yu[19]的研究结果有类似之处,Ju-Hua Yu发现在雌性黄鳝中,脑组织和性腺中有较高水平的表达,而在雄性黄鳝中仅在垂体和肝脏中有较低水平的表达,在脑组织中几乎没有表达。和Ju-Hua Yu的结果不同的是,本实验发现在雄性黄鳝脑组织中芳香化酶mRNA仍有一定水平的表达,这可能与实验的取材有关。Kwon JY等[20]发现在不同性别的尼罗罗非鱼的脑组织中,芳香化酶mRNA的表达水平差异很小。Tzchori I[21]发现在不同性别的欧洲鳗的脑组织中,芳香化酶mRNA的表达水平几乎没有差异。这意味着鱼类脑组织中芳香化酶的表达水平有种属差异性。从图上我们可以看出芳香化酶mRNA在黄鳝脑组织中的表达水平显著高于性腺,这与Ju-Hua Yu的研究结果一致。同时,意味着黄鳝脑组织中的芳香化酶mRNA表达水平高低对黄鳝的性逆转可能起决定性作用。
[1]Chardard D,Desvages G,Pieau C,et al.Aromatase activity in larval gonads of Pleurodeles waltl(Urodele Amphibia)during normal sex differentiation and during sex reversal by thermal treatment effect[J].General and Comparative endocrinology,1995,99(1):100-107.
[2]Dong W,Wang L,Thornton C,et al.Benzo(a)pyrene decrease brain and ovarian aromatase mrna expression in Fundulus heterolitus[J].Aquatic Toxicology,2008,88(4):289-300.
[3]Corbin C,Hughes A,Heffelfinger J,et al.Evolution of suiform aromatases:ancestral duplication with conversation of tissue-specific expression in the collared peccary(Pecari tayassu)[J].Molecular Evolution,2007,65(4):403-412.
[4]Simpson E,Clyne C,Boon WC,et al.Aromatase-a brief overview[J].Annual Review Physiology,2002,64(1):93-127.[5]Kishida M,Callard G.Distinct cytochrome P450 aromatase isoforms in zebrafish(Danio rerio)brain and ovary are differentilly programmed and estrogen regulated during early development[J].Endocrinology,2001,142(2):740-750.
[6]Valle L,Ramina A,Vianello S,et al.Cloning of two mRNA variants of brain aromatase cytochrome P450 in rainbow trout(Oncorhynchus mykiss Walbaum)[J].The Journal of Steroid Biochemistry and Molecular Biology,2002,82(1):19-32.
[7]Devlin R,Nagahama Y.Sex determination and sex differentiation in fish:an overview of genetic,physiological,and environmental influences[J].Aquaculture,2002,208(3):191-364.
[8]Trant J,Gavasso S,Ackers J,et al.Developmental expression of cytochrome P450 aromatase genes(CYP19a and CYP19b)in zebrafish fry (Danio rerio)[J].The Journal of experimental zoology,2001,290(5):475-483.
[9]Patil J,Gunasekern R.Tissue and sexually dimorphic expression of ovarian and brain aromatase mRNA in the Japanese medaka (Oryzias latipes):Implications for their preferential roles in ovarian and neural differentiation and development[J].General and Comparative endocrinology,2008,158 (4):131-137.
[10]ALephart E D.A review of brain aromatase cytochrome P450[J].Brain Research Reviews,1996,22(1):1-26.
[11]俞菊华,吴婷婷,李建林,等.黄鳝P-450芳香化酶基因的克隆及序列分析[J].水生生物学报,2005,29(5):550-555.
[12]Liu Jifang, Yan Guiguen,Liu Shaojun.Aromatase(P450arom)and 11β-hydroxylase(P450 11β)Genes are differentially expressed during the sex change process of the protogynous rice field eel,monopterus albus[J].Fish Physiology and Biochemistry,2009,35(3):511-518.
[13]Simpson E R,Mahendroo M S,Means G D,et al.Aromatase cytochrome P450,the enzyme responsible for estrogen biosynthesis[J].Endocrine Reviews,1994,15(3):342-355.
[14]Pifferrer F,Zanuy S,Carrillo M,et al.Brief treatmentwith an aromatase inhibitor during sex differentiation causes chromosomally female salmon to develop as normal functionalmales[J].Journal of Experiment Zoology,1994,270(3):255-262.
[15]Wong T T,Ijiri S,Zohar Y.Molecular biology of ovarian aromatase in sex reversal:complementary DNA and 5'-flanking region isolation and differential expression of ovarian aromatase in the gilthead seabream(Sparus aurata)[J].Biology of Reproduction,2006,74(5):857-864.
[16]Blázquez M,Piferrer F.Cloning,sequence analysis,tissue distribution,and sex-specific expression of the neural form of P450 aromatase in juvenile sea bass(Dicentrarchus labrax)[J].Molecular and Cellular Endocrinology,2004(219):83-94.
[17]Zhang Y,Zhang W,Zhang L,et al.Two distinct cytochrome P450 aromatases in the orange-spotted grouper(Epinephelus coioides):cDNA cloning and differential mRNA expression[J].Journal of Steroid Biochemistry and Molecular Biology,2004,92(1-2):39-50.
[18]Makoto P M,Solveig van Nes S,Andersen,et al.Realtime PCR analysis of ovary-and brain-type aromatase gene expression during Atlantic halibut(Hippoglossus hippoglossus)development [J]. Comparative Biochemistry Physiology,2006,144(5):128-135.
[19]Ju Huayu,Yong Kaitagn,Jian Linli.Cloning,Structure,and Expression Pattern of the P-450 Aromatase Gene in Rice Field Eel(Monopterus albus)[J].Biochemical genetics,2008,46(5):267-280.
[20]Kwon JY,McAndrew B J,Penman D J.Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female Nile tilapia(Oreochromis niloticus)[J].Molecular Reproduction and Development,2001,59(4):359-370.
[21]Tzchori I,Degani G,Hurvitz A,et al.Cloning and devel-opmental expression of the cytochrome P450 aromatase gene(CYP19)in the European eel(Anguilla anguilla)[J].Gen Comp Endocrinol,2004,138(3):271-280.
辽宁大连向日本出口40 t鲜活河豚鱼
2017年9月5—6日,日本最大两家河豚鱼进口公司的活鱼船相继来到金普新区大李家大连天正实业有限公司河豚鱼养殖基地,将采购的40 t鲜活河豚鱼运回日本国内,由此拉开了大连2017年河豚鱼出口的序幕。
日本是世界上最大的河豚鱼消费国,而其本国的河豚鱼资源远远不足以满足消费需求,大部分需从邻国进口,其中最大的供应商便是中国著名的河豚鱼养殖企业大连天正实业有限公司,日本国内消费的养殖河豚鱼60%以上来自于这家企业。
日本活鱼船每年9月至10月都来装鱼。记者登上日本进口公司的活鱼船看到,工作人员船上船下忙着将鲜活河豚鱼从网箱装运到船上,经过几个小时的紧张忙碌,将20 t河豚鱼全部装运到船上。问起这批河豚鱼的质量,日方一位负责人立即竖起大拇指说,质量和规格都达到要求,还会来运河豚鱼。据介绍,这批河豚鱼一到港,等在日本下关唐户鱼市场的商户就会抢购一空。
大连天正实业有限公司副总经理袁旭介绍,今年该公司出口鲜活河豚鱼大约在500 t,大部分出口到日本、韩国等地区。国外市场销售稳定,国内市场销售量也逐年上升。2016年9月,农业部、国家食品药品监督管理总局联合发文,正式有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀的加工经营。2016年底,农业部及中国渔业协会按照要求进行了养殖河豚鱼源基地和加工企业的备案审核,大连天正实业等16家河豚鱼养殖企业和5家加工企业获得了相关资质。目前大连天正实业有限公司已向北京、上海、广州等地销售100多吨河豚鱼产品,预计今后销售量还会有大幅提升。
(www.bbwfish.com)
Aromatase(P450arom)mRNA expression in eel brain tissue
Zhang Houmei,Wang Lin
(Anhui biological engineering school,Hefei 230031,China)
This study intended to further study the mechanism and intrinsic link between sex reversal and aromatase in the eel,aiming to provide basic materials for artificial sex control of rice field eel,real-time quantitative PCR were used to study expression of aromatase in the brain.Real time quantitative PCR results showed that P450arom mRNA expressed in the brain of females,intersexuals,male rice field eel,its expression level was declining.Our data provided initial evidence that aromatase participated in sex reversal,the activity of aromatase in the brain was closely related to sex change.The level of aromatase mRNA expression in eel brain might play a decisive role.
eel;aromatase;sex reversal
Q176
A
1004-2091(2017)10-0007-05
10.3969/j.issn.1004-2091.2017.10.002
张厚梅(1973-),女,讲师,研究方向:特种水产养殖.E-mail:zhm07071228@126.com
王琳(1972-),男,博士.E-mail:wangl1120@163.com
2017-03-14)
