暗纹东方鲀芳香化酶基因的结构及表达分析
2020-01-17高莹莹刘新富
高莹莹,刘新富,胡 鹏,黄 滨,刘 滨
( 1.中国水产科学研究院 黄海水产研究所,山东 青岛 266071; 2.上海海洋大学 水产与生命学院,上海 201306; 3.青岛海洋科学与技术试点国家实验室,山东 青岛 266071; 4.内江师范学院,四川 内江 641100 )
暗纹东方鲀(Takifuguobscurus)又名河鲀,是我国长江中下游地区重要淡水养殖种类,其营养价值丰富、肉质鲜美,被称为“鱼中极品”[1],但过去因受国内市场禁止销售的限制,多年以来养殖产量一直在1×104~2×104t内波动[2]。2016年9月农业部办公厅和国家食品药品监督管理总局办公厅联合发布《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营的通知》[3],解除了自1990年开始实施的暗纹东方鲀不准市场流通的禁令,国内市场的开放为暗纹东方鲀产业的二次创业和可持续发展提供了新的契机。
暗纹东方鲀雌雄个体体长生长规律相似,但在2.5龄前雄鱼体质量生长速度大于雌鱼[4],且雄鱼精巢被认为是难得的珍贵食材,有“西施乳”的美誉。一对精巢的价值甚至超过雄鱼本身,养殖全雄苗种的利润是养殖普通苗种的1.5倍以上。因此,生产和养殖全雄暗纹东方鲀,可以大幅度提高我国暗纹东方鲀的养殖经济效益。但遗憾的是,目前有关暗纹东方鲀的性别调控机制及其性控技术的研究还较少。
雌激素在促进鱼类卵巢的分化、成熟和保持雌性性别特征的过程中起着十分重要的调控作用[5],而P450芳香化酶(P450arom)是细胞色素P450超家族中的一员,是类固醇代谢中的一种酶复合体,是催化脊椎动物雄激素芳构化合成雌激素的一种关键酶,因此P450芳香化酶成为各大研究学者探索鱼类性别分化过程中分子调控机制的重要研究对象[6]。在大多数哺乳动物中,芳香化酶是芳香化酶19基因的产物,由单一基因编码,但在硬骨鱼类中存在两种异构体芳香化酶基因,即性腺型芳香化酶基因(cyp19a)和脑型芳香化酶基因(cyp19b)[7-8]。诸多研究表明,性腺型芳香化酶在早期雌性性别分化和卵巢发育过程中发挥重要的调控作用,芳香化酶抑制剂和RNA干扰处理后引起中华鳖(Pelodiscussinensis)雌性向雄性方向逆转,而性腺型芳香化酶过表达处理后则导致中华鳖雄性性腺呈现典型的雌性特征[9];芳香化酶抑制剂来曲唑抑制暗纹东方鲀仔鱼性腺型芳香化酶的基因表达,导致稚鱼的原始卵巢退化,且向功能性精巢发育[10];芳香化酶抑制剂来曲唑通过抑制内源性雌二醇的合成,诱导已分化的赤点石斑鱼(Epinephelusmerra)雌鱼向雄性转化[11]。到目前为止,已经克隆得到一些鱼类的性腺型芳香化酶基因序列,如翘嘴鳜(Sinipercachuatsi)[12]、食蚊鱼(Gambusiaaffinis)[13]、绿鳍马面鲀(Navodonseptentrionalis)[8]、大黄鱼(Pseudosciaenacrocea)[14]、条斑星鲽(Veraspermoseri)[15]、半滑舌鳎(Cynoglossussemilaevis)[16]和黄颡鱼(Pelteobagrusflvidraco)[17]等。证实了性腺型芳香化酶在雌性性腺分化和功能维持上发挥着十分重要的作用。在此基础上,笔者以暗纹东方鲀为研究对象,应用分子生物学方法,扩增并克隆性腺型芳香化酶基因的cDNA全长序列,从分子水平分析暗纹东方鲀性腺型芳香化酶基因的序列结构及相关生物信息学特征,并应用相对定量RT-PCR技术对性腺型芳香化酶基因mRNA在不同组织和不同发育期中的表达情况进行分析,旨在为研究暗纹东方鲀性腺型芳香化酶的遗传特性及相关生理的功能研究奠定基础,为河鲀鱼类性别分化过程中分子调控机制的进一步研究提供重要参考,同时为培育暗纹东方鲀全雄苗种,实现单性良种选育提供科学依据。
1 材料与方法
1.1 试验材料
暗纹东方鲀样本购自江苏省南通市中洋集团股份有限公司,车间循环水系统内养殖,日投喂2~3次,水温为22~26 ℃。分别采集孵化后60、90、120日龄和150日龄幼鱼,雌鱼和雄鱼各取12尾,每个时期各取3尾,体长分别为(7.2±0.8)、(8.5±0.6)、(10.3±0.9) cm和(14.4±1.1) cm,分别剖取卵巢和精巢组织,置于RNA Store保存液中,-20 ℃冷冻保存,用于暗纹东方鲀幼鱼不同发育期性腺组织性腺型芳香化酶基因相对表达量的检测。
选取1龄雌鱼和雄鱼成鱼各3尾,分别剖取下丘脑、脑、垂体、性腺、心脏、肝脏、胆、胃、肠、肌肉、眼等组织,置于RNA Store保存液中,-20 ℃冷冻保存,用于暗纹东方鲀不同组织中性腺型芳香化酶基因相对表达量的检测。
1.2 暗纹东方鲀性腺型芳香化酶cDNA全长克隆
采用MiniBEST Universal RNA Extraction Kit(TaKaRa,大连)提取暗纹东方鲀卵巢组织总RNA,通过1%的琼脂糖凝胶电泳检测总RNA完整性,NanoDrop2000(Thermo Scientific,美国)超微量分光光度计测定总RNA含量。以暗纹东方鲀卵巢总RNA为模板,按照SMARTer®RACE5′/3′Kit User Manual(Clontech,美国)说明书合成cDNA第一链。
根据已知河鲀鱼类的保守序列,利用DNAMAN软件设计扩增引物F1/R1和F2/R1(表1),以合成的cDNA第一链为模板进行性腺型芳香化酶基因保守片断的扩增,25 μL反应体系:Premix Ex TaqTM12 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA模板2 μL,灭菌水10 μL。PCR反应程序:95 ℃预变性5 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 40 s,35个循环;72 ℃延伸10 min;4 ℃保存。PCR产物经1%的琼脂糖凝胶电泳检测后,送至上海生工生物工程有限公司测序。
根据获得的保守片段序列设计特异性引物3′-RACE-F3、3′-RACE-F4、3′-RACE-F5和5′-RACE-R2、5′-RACE-R3(表1),用于RACE扩增性腺型芳香化酶基因cDNA全长序列。使用SMART RACE试剂盒(TaKaRa)进行5′-RACE和3′-RACE的半巢式PCR扩增。第一轮PCR反应体系:PCR-Grade H2O 17.5 μL,10×Advantage 2 PCR Buffer 2.5 μL,dNTP Mix 0.5 μL,50×Advantage 2 Polymerase Mix 0.5 μL,3′/5′ RACE cDNA 1.0 μL,UPM(10×)2.5 μL,3′/5′ RACE引物0.5 μL。反应程序:94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,25个循环。第二轮PCR反应体系:PCR-Grade H2O 18 μL,10×Advantage 2 PCR Buffer 2.5 μL,dNTP Mix 0.5 μL,50×Advantage 2 Polymerase Mix 0.5 μL,第一轮3′/5′ RACE PCR产物(稀释50倍)2.5 μL,UPS 0.5 μL,3′/5′ RACE引物0.5 μL。反应程序:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,35个循环。PCR产物经琼脂糖凝胶电泳检测后,根据胶回收试剂盒(天根,北京)说明书对目的条带切胶后进行纯化回收。切胶回收的PCR产物与pEASY-T3载体(全式金生物,北京)连接,采用热激法将5 μL连接产物转化至20 μL Trans1-T1感受态细胞(全式金生物,北京),在含氨苄的LB固体培养基中,37 ℃过夜培养,挑取单一克隆菌落继续培养2 h。菌液PCR鉴定后,将含有目的条带的菌液送至上海生工生物工程有限公司测序。
采用DNAstar软件将5′-RACE、保守片段和3′-RACE的测序结果进行拼接,获得暗纹东方鲀性腺型芳香化酶基因的cDNA全长序列。
1.3 暗纹东方鲀性腺型芳香化酶基因的表达分析
取适量暗纹东方鲀雌鱼和雄鱼成鱼下丘脑、脑、垂体、性腺、心脏、肝脏、胆、胃、肠、肌肉、眼等组织,幼鱼60、90、120日龄和150日龄的卵巢和精巢组织,采用MiniBEST Universal RNA Extraction Kit提取总RNA,1%的琼脂糖凝胶电泳检测总RNA完整性,NanoDrop2000测定总RNA含量。以暗纹东方鲀雌鱼和雄鱼提取的不同组织和不同发育期性腺组织的总RNA为模板,按照PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,大连)说明书合成cDNA第一链。

表1 暗纹东方鲀性腺型芳香化酶基因克隆及荧光定量引物Tab.1 Cloning and fluorescence quantitative primers of gonadal aromatase gene in puffer T. obscurus
根据已获得的性腺型芳香化酶基因序列,采用DNAMAN设计特异性引物cyp19a-F/R(表1),以暗纹东方鲀雌鱼和雄鱼成鱼不同组织以及幼鱼不同发育期性腺组织的cDNA第一链为模板,以β-actin为内参基因,采用RT-PCR方法在Line Gene 9600型实时荧光定量PCR仪(博日,杭州)上检测性腺型芳香化酶在暗纹东方鲀成鱼不同组织和幼鱼不同发育期中的相对表达量。20 μL反应体系:2×SYBR®Premix Ex Taq Ⅱ 10 μL,上下游引物(10 μmol/L)各0.8 μL,cDNA模板2 μL,灭菌水6.4 μL。反应程序:94 ℃ 30 s;94 ℃ 5 s,55 ℃ 34 s,40个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。每个试验样品设置3个重复,试验步骤参考SYBR®Premix Ex TaqTM试剂盒(TaKaRa,大连)操作说明。
实时荧光定量PCR获得一系列Ct值,数据分析采用2-ΔΔCt法,用SPSS 16.0软件进行数据的统计分析,分析方法为单因素方差分析,即当P<0.05时为差异显著,结果表示为平均值±标准误。
1.4 暗纹东方鲀性腺型芳香化酶的生物信息学分析
获得的全长序列在美国国立生物技术信息中心数据库中进行BLAST比对,推断其开放阅读框序列并进行同源性分析后完成注册(登录号:MH218815);使用DNAMAN软件进行编码蛋白质的氨基酸多重序列比对分析;利用Mega 5.1软件构建基于邻位相接法和最大似然法的系统进化树,并采用1000次自举检验分析评估进化树分支节点的置信度。
借助ExPASy ProtParam工具推断蛋白质的基本理化性质;使用ExPASy ProtScale程序分析蛋白质的疏水性;采用PSORT Ⅱ Prediction工具定位蛋白质的亚细胞;利用TMHMM Server 2.0程序分析跨膜区;采用SignalIP 4.1、TargetP 1.1 Server和TatP 1.0 Server分别预测信号肽剪切位点;使用NetPhos 3.1 Server程序预测磷酸化位点;使用 NetNGlyc 1.0程序预测糖基化位点;利用SMART和PROSITE工具分别分析氨基酸序列的保守结构域及其功能域位点;借助SOPMA和SWISS-MODEL工具分别预测蛋白质的二级结构和三级结构。
2 结 果
2.1 暗纹东方鲀性腺型芳香化酶cDNA全长克隆和序列分析
通过半巢式PCR得到477 bp长度的部分编码区片段(图1a),采用RACE技术得到5′-RACE序列长度为225 bp(图1b),3′-RACE序列长度为1392 bp(图1c)。拼接得到1786 bp的暗纹东方鲀性腺型芳香化酶cDNA全长序列,包括5′非编码区35 bp和3′非编码区206 bp,开放阅读框1545 bp,编码514个氨基酸,氨基酸序列中包含I-螺旋区(301~332位)、Ozol′s肽区(357~379位)、芳香化酶特异性保守区(388~411位)和亚铁血红素结合区(438~451位)(图2)。
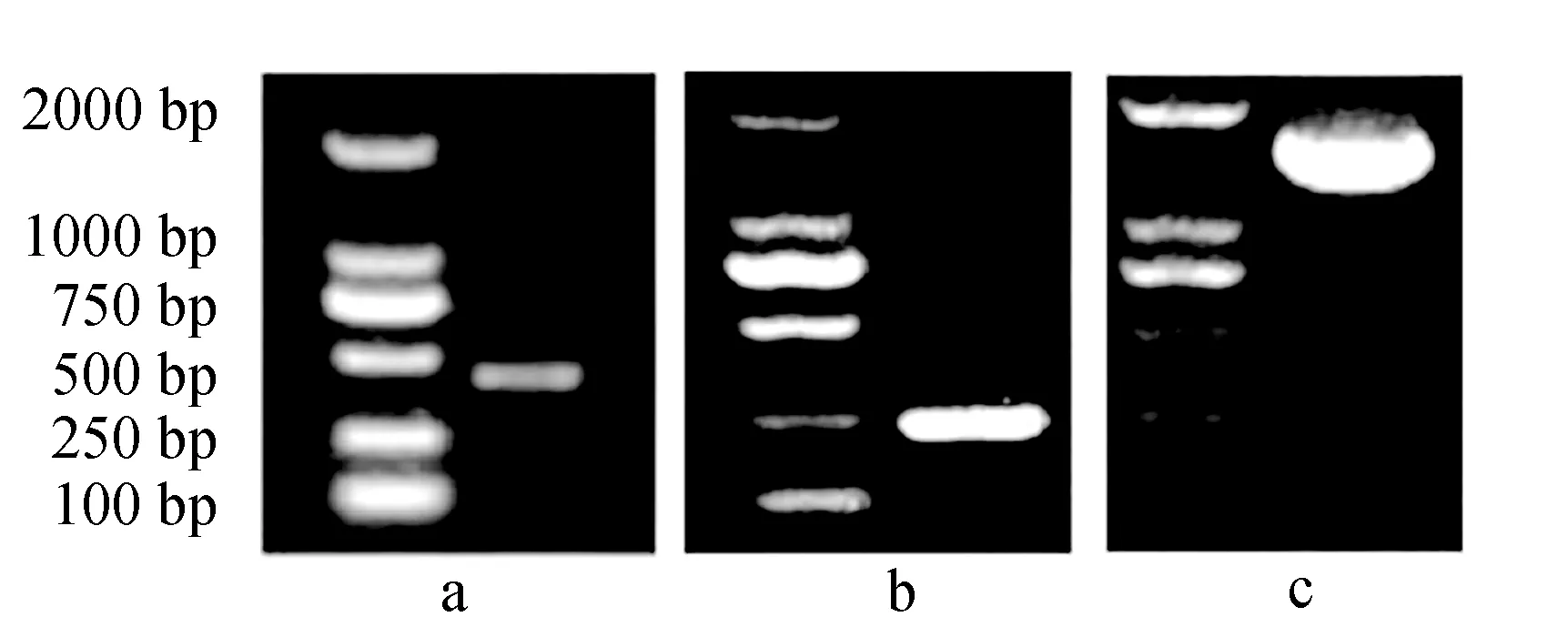
图1 暗纹东方鲀性腺型芳香化酶基因部分编码区(a)、 5′-RACE(b)和3′-RACE(c)电泳图Fig.1 Gel electrophoresis of partial coding region of gonadal aromatase gene (a), 5′-RACE (b) and 3′-RACE (c) in puffer T. obscurus
2.2 暗纹东方鲀性腺型芳香化酶基因的同源性和系统发育分析
同源性分析结果显示,暗纹东方鲀性腺型芳香化酶与红鳍东方鲀(NM_001280028.1)、星点东方鲀(T.niphobles,KX499501.1)、花鲈(Lateolabraxmaculatus,KP335158.1)、白姑鱼(Pennahiaargentata,LC317123.1)、斜带石斑鱼(E.coioides,AY510711.1)、细须石首鱼(Micropogoniasundulatus,DQ184486.1)、尖吻鲈(Latescalcarifer,AY684256.1)、条斑星鲽(FJ169904.2)、许氏平鲉(Sebastesschlegelii,FJ594995.2)、鳜鱼(S.chuatsi,KX911988.1)、平鲷(Rhabdosargussarba,DQ345786.1)、鲻鱼(Mugilcephalus,AY859425.1)、黄鳝(Monopterusalbus,EU252487.1)、双带双锯鱼(Amphiprionsebae,KP260920.1)和青鳉(Oryziasmelastigma,JX454653.1)等15种性腺型芳香化酶基因核苷酸序列的相似性分别为99%、99%、85%、85%、84%、84%、84%、84%、83%、83%、83%、82%、82%、82%和81%,说明克隆得到的基因属于P450家族。
氨基酸多重序列比对分析结果显示,哺乳动物或鱼类的性腺型芳香化酶氨基酸序列均十分保守(图3)。基于邻位相接法和最大似然法构建的系统进化树完全一致,仅在节点支持率方面略有不同。结果表明,系统进化树可分为两个大支:哺乳类、鸟类和两栖类聚为一大支,所有鱼类聚为另一大支。其中暗纹东方鲀位于鱼类这个分支中,且与同属的红鳍东方鲀和星点东方鲀聚为一个小分支,亲缘关系最近,其次是鲈形目的斜带石斑鱼、细须石首鱼和黑鲷(Acanthopagrusschlegelii)等鱼类,而与非洲爪蟾(Xenopuslaevis)、鸡(Gallusgallus)、人(Homosapiens)和鼠(Musmusculus)等较高等脊椎动物的亲缘关系最远(图4)。
2.3 暗纹东方鲀性腺型芳香化酶结构与功能分析
2.3.1 基本理化性质分析
性腺芳香化酶的基本理化性质:相对分子量58.23 ku,等电点6.29,分子式C2605H4119N711O754S24,总原子数8213。成熟蛋白质中含有带负电荷的酸性氨基酸(天冬氨酸+谷氨酸)和带正电荷的碱性氨基酸(精氨酸+赖氨酸)分别为56和51个。摩尔消光系数为61 140。不稳定系数为38.97,属于稳定蛋白。总平均疏水指数为-0.092,属于亲水性蛋白,且在第1~100、300~350位氨基酸处含有2个典型的疏水性区域(图5)。

图2 暗纹东方鲀性腺型芳香化酶基因cDNA 及其编码的氨基酸序列Fig.2 The cDNA sequence and deduced amino acid sequence of gonadal aromatase gene in puffer T. obscurus ATG.起始密码子;TGA(*).终止密码子;□. 跨膜螺旋区(TMⅠ~TMⅡ);●.潜在的N糖基化位点;灰色阴影区自上到下分别为Ⅰ-螺旋区、Ozol′s肽区、芳香化酶特异性保守区和亚铁血红素结合区. ATG. initiation codon; TGA (*). termination codon; the position of the one predicted transmembrane domain (TMⅠ~TMⅡ) is showed as black box; potential N-glycosilation sites is indicated by closed black circle; grey shadows from top to bottom are the I-helix region, Ozol′s peptide region, specific conservative region of aromatase and heme-ferrous binding region, respectively.
2.3.2 性腺型芳香化酶的拓扑结构分析
亚细胞定位分析结果显示,性腺型芳香化酶定位于内质网、空泡、高尔基体、质膜、线粒体和细胞质的概率为33.3%、22.2%、11.1%、11.1%、11.1%和11.1%,由此可推测,性腺型芳香化酶最有可能定位于内质网和空泡,属于分泌蛋白。跨膜区分析结果显示,该蛋白在36~53氨基酸处含有1个跨膜结构域,方向为由胞外到胞内;65~81氨基酸处含有1个跨膜结构域,方向为由胞内到胞外(图6)。
2.3.3 信号肽、磷酸化和糖基化位点的预测
通过SignalP 4.1软件分析暗纹东方鲀性腺型芳香化酶的信号肽结构,结果表明,在第17和30位氨基酸残基处存在信号肽剪切位点的概率分别为0.206和0.250(图7a)。采用TargetP 1.1 Server软件分析发现其存在信号肽的概率为0.956,但剪切位点没有预测到;采用TatP 1.0 Server软件分析发现其在第30位氨基酸残基处存在信号肽剪切位点的概率为0.565(图7b),这说明该蛋白可能存在长度为29个氨基酸的双精氨酸信号肽结构,从而推测该蛋白可能存在一种类似于细菌和植物中双精氨酸转运的转运方式。NetPhos 3.1分析性腺型芳香化酶磷酸化位点的结果表明,19个丝氨酸、17个苏氨酸和2个酪氨酸可能会成为蛋白激酶磷酸化的位点(图7c)。NetNGlyc 1.0分析性腺型芳香化酶糖基化位点的结果表明,其可能存在4个潜在的N-糖基化位点(图7d)。
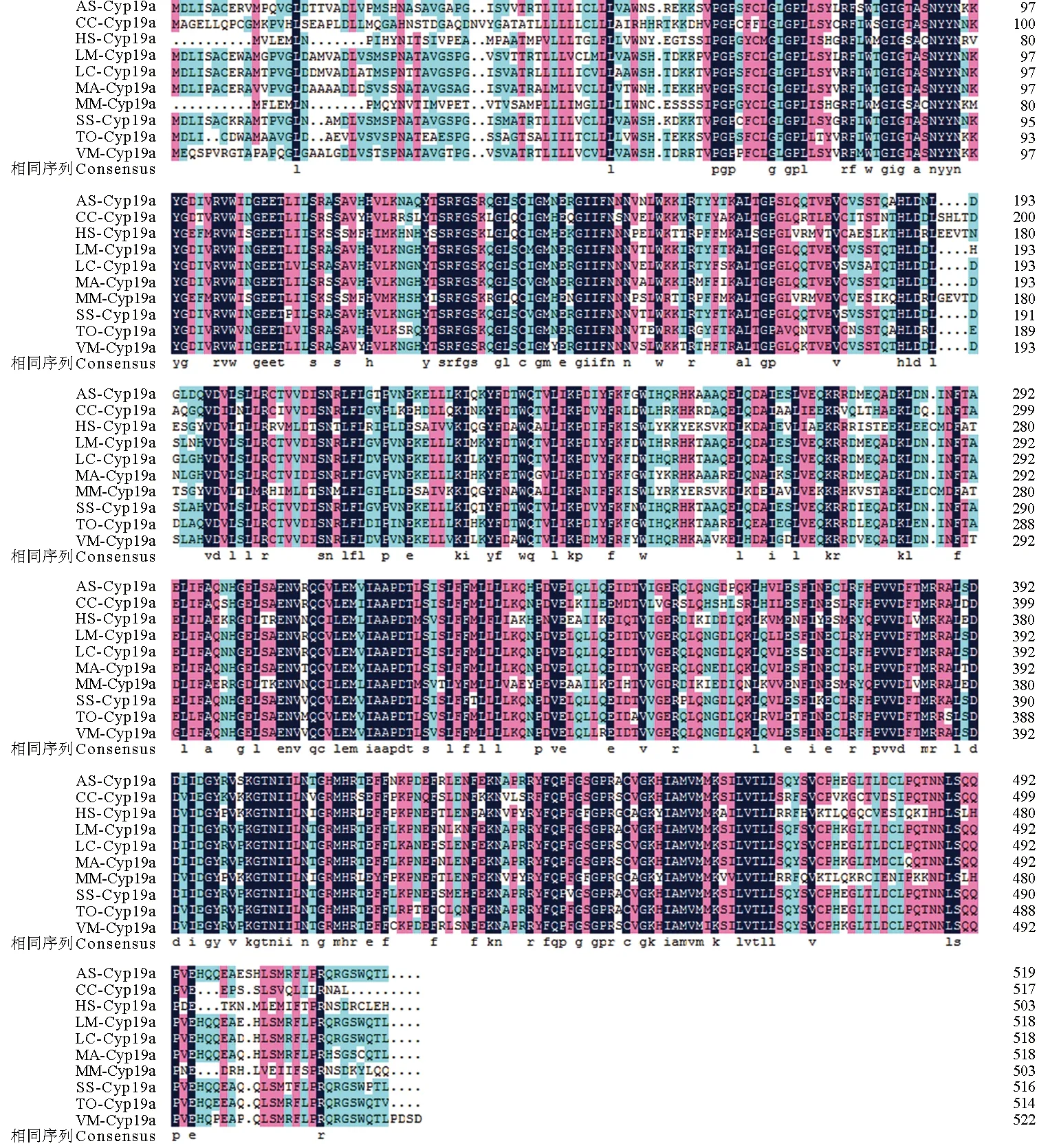
图3 暗纹东方鲀性腺型芳香化酶与其他物种氨基酸序列比对图Fig.3 Comparison of Multiple alignment of the deduced amino acid sequence of gonadal aromatase in T. obscures with the corresponding sequences from other species 序列中相同氨基酸残基用黑色背景表示,同源性超过75%用粉红色背景表示,同源性超过50%用浅蓝色背景表示.序列号:黑鲷(AS),AY273211;鲤鱼(CC),EU375455;人(HS),NP_112503;花鲈(LM),KP335158;尖吻鲈(LC),AY684256;黄鳝(MA),EU252487;鼠(MM),NP_031836;许氏平鲉(SS),FJ594995;暗纹东方鲀(TO),MH218815;条斑星鲽(VM),FJ169904. Position with>50% similarity are shaded in light blue, position with >75% similarity are shaded in pink, while completely conserved positions are shaded in black.Accession number: Acanthopagrus schlegelii (AS) AY273211 ,Cyprinus carpio (CC) EU375455, Homo sapiens (HS) NP_112503, Lateolabrax maculatus (LM) KP335158, Lates calcarifer (LC) AY684256, Monopterus albus (MA) EU252487, Mus musculus (MM) NP_031836, Sebastes schlegelii (SS) FJ594995, Takifugu obscures (TO) MH218815, and Verasper moseri (VM) FJ169904.
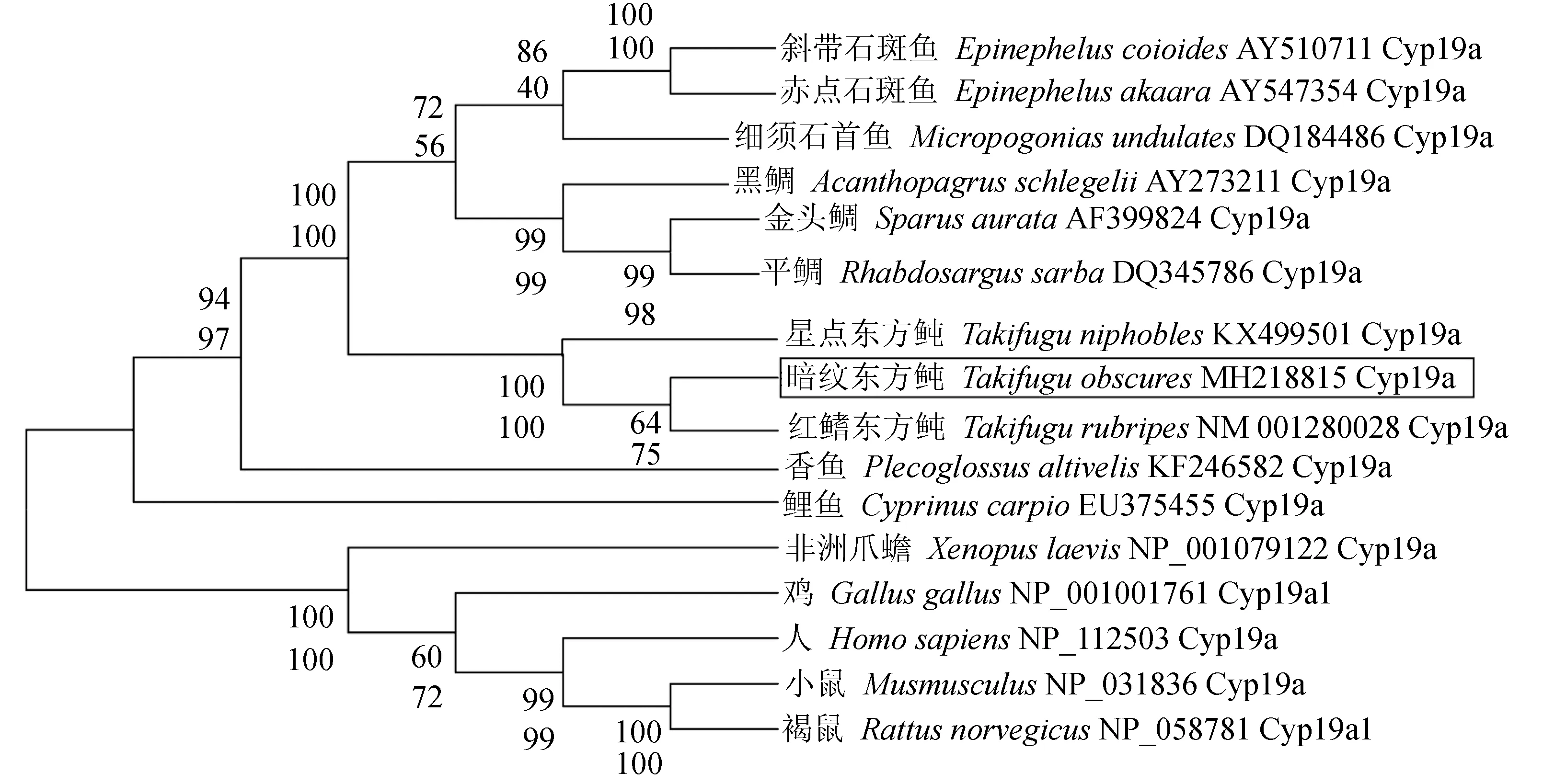
图4 不同物种基于性腺型芳香化酶序列利用邻位相接法和最大似然法构建的系统进化树Fig.4 Phylogenetic trees of different species based on sequences of gonadal aromatase using neighbor contiguity method and maximum likelihood method 每个分支节点位于上面的支持率为邻位相接法构建进化树的支持率,位于下面且斜体的支持率为最大似然法构建进化树的支持率. The support rate of each branch node on the top is the support rate of the evolutionary tree constructed by adjacent connection method, and the support rate at the bottom and in italics is the support rate of the evolutionary tree constructed by maximum likelihood method.
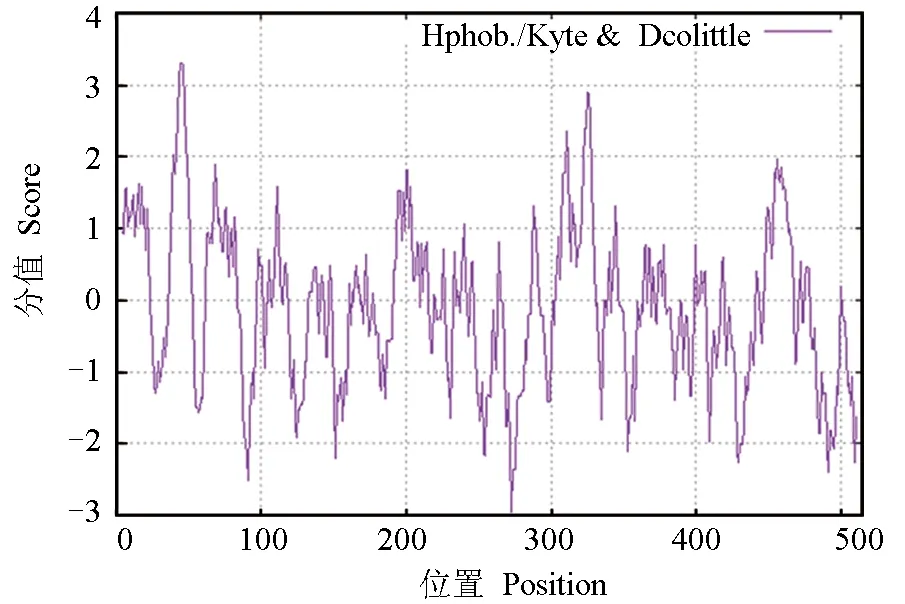
图5 暗纹东方鲀性腺型芳香化酶的疏水性分析图Fig.5 Hydrophobicity analysis of gonadal aromatase in puffer T. obscures
2.3.4 性腺型芳香化酶保守结构域分析和功能域预测
采用SMART分析性腺型芳香化酶的保守结构域,结果表明,该蛋白在41~50、60~494、250~284和319~330氨基酸残基处分别有低复杂度区、Pfam、卷曲螺旋区和2个低复杂度区等保守结构域(图8a)。使用PROSITE在线预测性腺型芳香化酶的功能域,结果表明,第438~447位氨基酸残基处可能是细胞色素P450半胱氨酸血红素—铁配体结合识别位点(图8b)。
2.3.5 性腺型芳香化酶的二级结构和三级结构
采用SOPMA和SWISS-MODEL同源建模在线分析性腺型芳香化酶的二级结构和三级结构,结果表明,性腺型芳香化酶二级结构中-螺旋占46.89%,β-折叠占13.04%,β-转角占4.86%,无规卷曲占35.21%(图9),这种二级结构组成可使得性腺型芳香化酶构象多样化。性腺型芳香化酶三级结构建模范围为58~506位氨基酸,覆盖率为87%。GMQE值为0.74,说明建模质量较好。暗纹东方鲀性腺型芳香化酶的三级结构模型(图10a)与GeneBank数据库中公布的人性腺型芳香化酶的三级结构模型(图10b)相比,暗纹东方鲀性腺型芳香化酶三级结构的构型与人相似,这说明该结构域在不同的物种中具有高度的保守性。
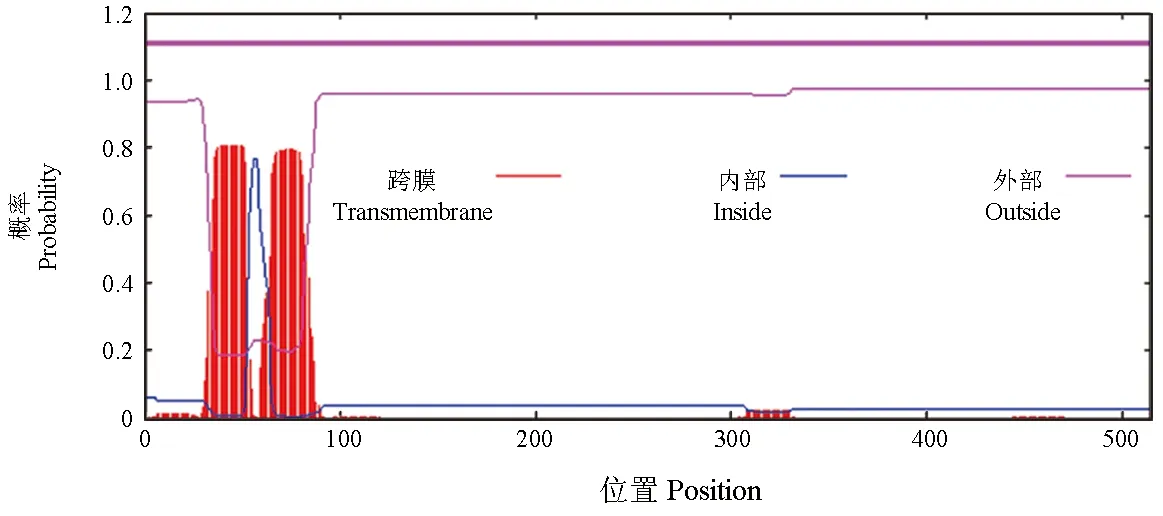
图6 暗纹东方鲀性腺型芳香化酶的跨膜区域Fig.6 Transmembrane region of gonadal aromatase in puffer T. obscures
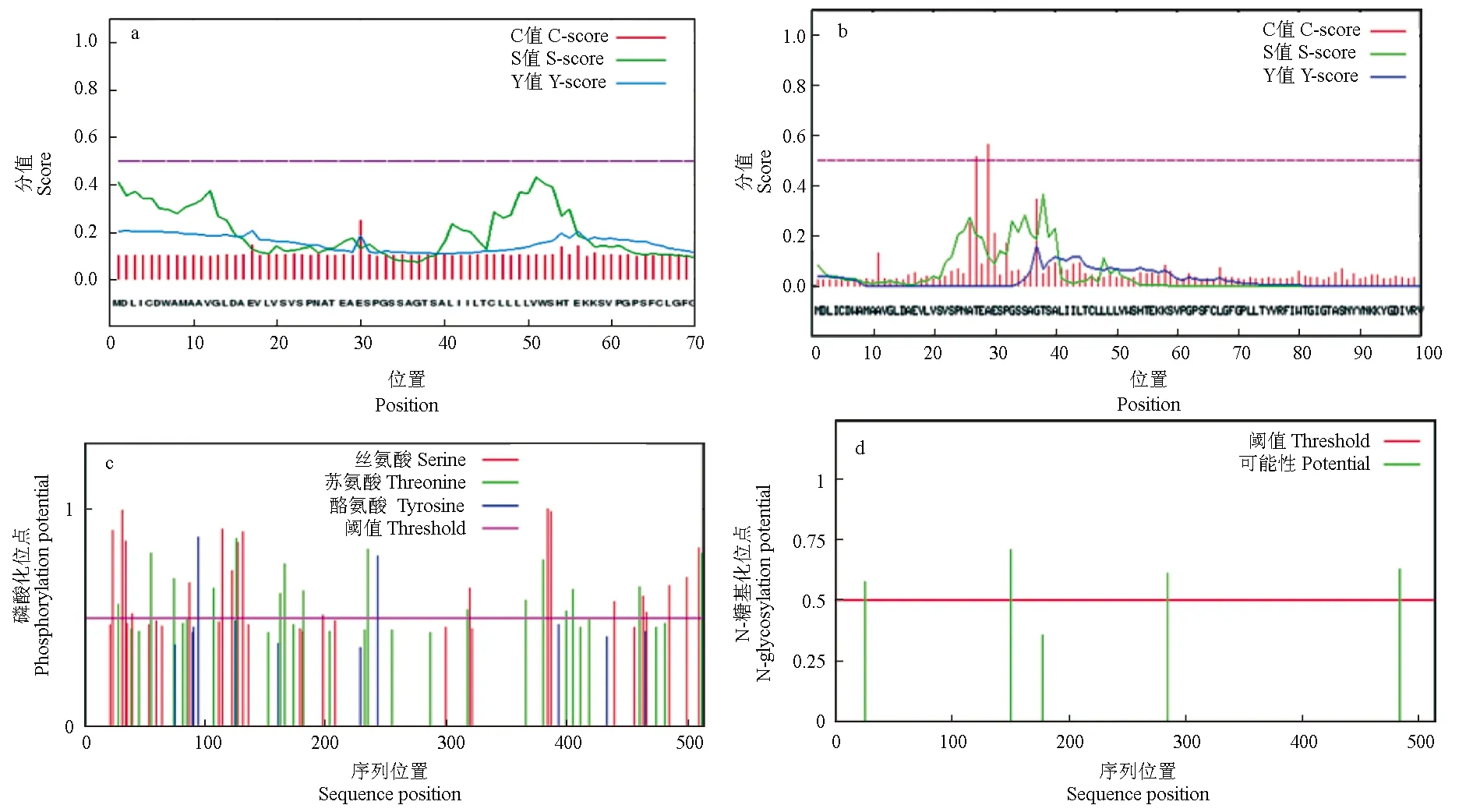
图7 暗纹东方鲀性腺型芳香化酶信号肽剪切位点(a、b)、磷酸化位点(c)和糖基化位点(d)Fig.7 Signal peptide splice site(a, b), phosphorylation site (c) and glycosyl site (d) of gonadal aromatase in puffer T. obscurus
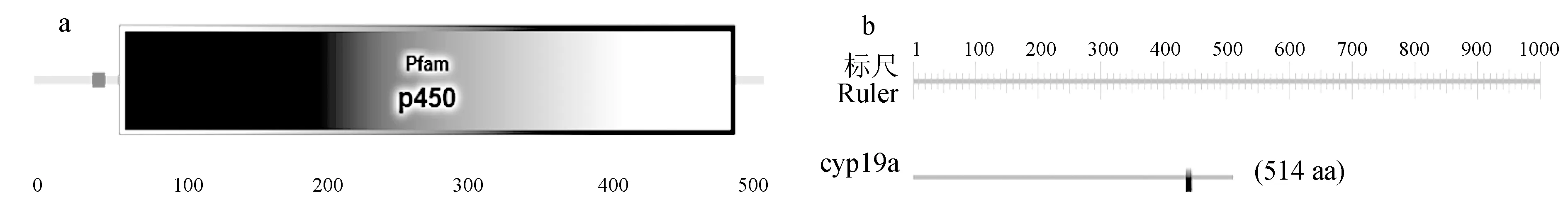
图8 暗纹东方鲀性腺型芳香化酶的保守结构域(a)和功能域(b)Fig.8 Conserved domain (a) and functional domain (b) of gonadal aromatase in puffer T. obscures

图9 暗纹东方鲀性腺型芳香化酶的二级结构Fig.9 Secondary structure of gonadal aromatase in puffer T. obscures h.α-螺旋;e.β-折叠延伸链;t.β-转角;c.无规则卷曲. h.alpha helix; e.beta extended strand; t.beta turn; c.random coil.
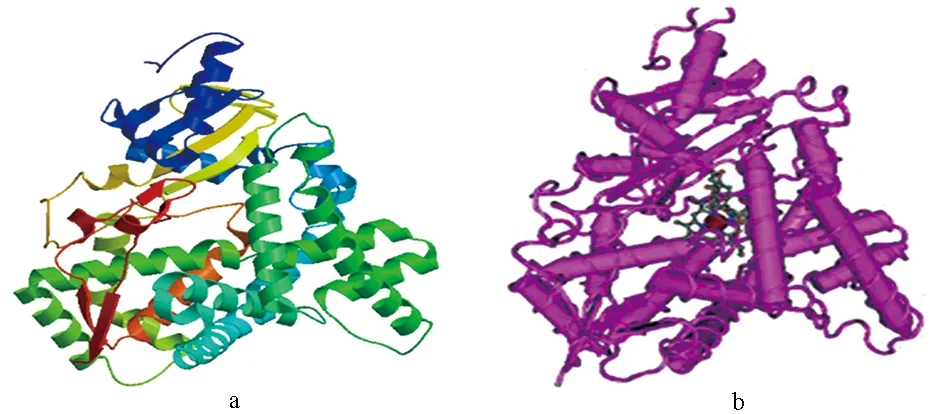
图10 暗纹东方鲀性腺型芳香化酶(a)和 人类性腺型芳香化酶(b)的三级结构Fig.10 Tertiary structure of gonadal aromatase in puffer T. obscurus (a) and H. sapiens (b)
2.4 暗纹东方鲀各组织中性腺型芳香化酶基因的表达水平
实时荧光定量PCR相对定量检测性腺型芳香化酶基因在暗纹东方鲀雌鱼各组织中的表达情况见图11,结果显示,雌鱼的性腺型芳香化酶基因在肌肉中表达量最高,其次是在卵巢中,并与其他组织相比存在有显著性差异(P<0.05),而下丘脑、脑、垂体、肝脏、胆、肠、眼、心、胃中均有少量表达,但差异不显著(P>0.05);雄鱼的性腺型芳香化酶基因在肌肉中表达量最高,在其他组织中有少量表达甚至不表达,肌肉中的表达量与其他组织相比存在显著性差异(P<0.05);暗纹东方鲀精巢中性腺型芳香化酶基因的表达量明显低于卵巢(图11)。不同发育期性腺中性腺型芳香化酶基因的表达水平分析结果表明,性腺型芳香化酶基因在60~150日龄期间卵巢中的表达量呈现出逐渐升高再降低的趋势,其中60~120日龄内幼鱼卵巢中性腺型芳香化酶基因的表达水平呈现逐渐升高的趋势并在约120日龄到达峰值,随后逐渐降低,至150日龄时其表达水平基本与90日龄时相同;而性腺型芳香化酶基因在精巢中基本不表达(图12)。
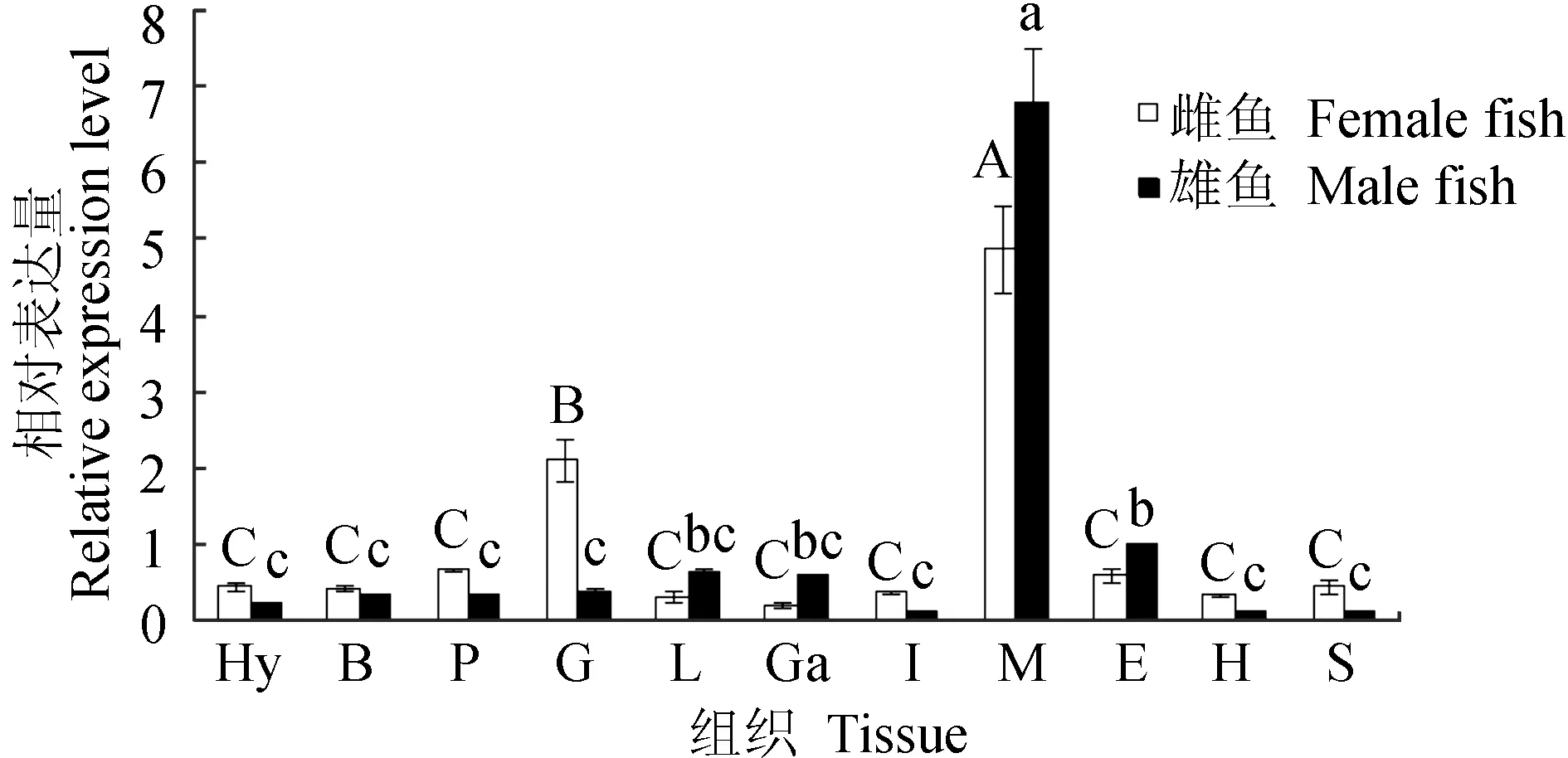
图11 暗纹东方鲀性腺型芳香化酶基因的组织表达Fig.11 Expression of gonadal aromatase gene in various tissues of puffer T. obscurus Hy.下丘脑; B.脑; P.垂体; G.性腺; L.肝; Ga.胆; I.肠; M.肌肉; E.眼; H.心; S.胃. 不同大写字母表示雌鱼不同组织间差异显著(P<0.05),不同小写字母表示雄鱼不同组织间差异显著(P<0.05). Hy.hypothalamus; B.brain; P.pituitary; G.gonad; L.liver; Ga.gallbladder; I.intestine; M.muscle; E.eye; H.heart; S.stomach. The significant differences in female tissues are shown in capital letters (P<0.05), and the significant differences in male tissues are shown in different lower-case letters (P<0.05).
3 讨 论
3.1 暗纹东方鲀性腺型芳香化酶信号肽的结构预测及功能分析
依赖N端的信号肽有两种典型的转运途径,分别为分泌途径和双精氨酸移位途径,分泌途径广泛存在于真核生物、革兰氏阳性菌和革兰氏阴性菌中,而双精氨酸移位途径主要存在于细菌和植物中。通过SignalP 4.1软件对信号肽的预测发现,暗纹东方鲀性腺型芳香化酶不存在分泌途径的信号肽结构;但采用TargetP 1.1 Server软件分析蛋白质序列信号肽时发现,其存在信号肽的概率为0.956;采用TatP 1.0 Server软件分析发现,其存在双精氨酸转运途径信号肽的概率为0.565,但信号肽序列不存在典型的双精氨酸标志;故推测性腺型芳香化酶可能是一种非分泌蛋白,也有可能是一种分泌蛋白,分泌途径比较特殊,类似于双精氨酸移位途径。亚细胞定位的预测结果表明,性腺型芳香化酶最有可能定位于内质网和空泡,在这方面已有文献报道,芳香化酶在亚细胞水平上定位于滑面内质网膜和线粒体内膜上[7]。疏水性和跨膜区的分析结果显示,其存在两个典型的疏水性区域和跨膜结构,这说明性腺型芳香化酶是一种跨膜蛋白,且邹立军等[12]在研究中也提及P450芳香化酶是一种膜结合蛋白。暗纹东方鲀性腺型芳香化酶磷酸化和糖基化位点预测结果显示,其存在38个磷酸化位点和4个N-糖基化位点,这说明性腺型芳香化酶基因在翻译结束后可能存在磷酸化和糖基化的加工修饰。亚细胞定位、疏水性、跨膜区、磷酸化和糖基化的预测结果从侧面为证实性腺型芳香化酶可能是一种分泌蛋白提供了有力的证据,但其分泌途径尚未可知,可能类似于双精氨酸移位途径,也可能与其他蛋白结合,由其他蛋白携带跨膜。关于性腺型芳香化酶基因克隆的文献很多,但有关其信号肽预测的研究却寥寥无几,且其预测范围仅限于分泌途径的信号肽,如食蚊鱼[13],因此暗纹东方鲀性腺型芳香化酶是存在于细胞质中构成自身结构,还是与其他蛋白结合后由其他蛋白携带跨膜,有待进一步的研究。

图12 暗纹东方鲀性腺型芳香化酶基因在不同发育期 性腺组织的相对表达Fig.12 The relative expression level of gonadal aromatase gene in gonad tissues of puffer T. obscurus at different developmental stages 不同小写字母表示差异显著(P<0.05). The significant differences are shown in different letters(P<0.05).
3.2 暗纹东方鲀性腺型芳香化酶基因的表达模式
通常情况下,目的基因的组织表达模式能够在一定程度上反映该基因的生物学功能。荧光定量PCR结果显示,暗纹东方鲀性腺型芳香化酶基因在卵巢中表达量较高,且明显高于精巢,这与半滑舌鳎[18]和斑马鱼(Daniorerio)[19]的表达模式基本一致,除此之外,在肌肉中表达量最高,下丘脑、垂体和肝脏等其他组织中有也少量表达,这种性腺型芳香化酶基因在性腺以外的组织中也表达的情况在其他鱼类中也有过报道,如翘嘴鳜[12]、大黄鱼[14]和条斑星鲽[15]等,这种表达差异可能与鱼的种类和发育时期有关。从鱼的种类方面来说,性腺型芳香化酶基因在三倍体湘云鲫(Carassiusauratus)[20]、斑马鱼[21]、鲤鱼[22]和绿鳍马面鲀[8]等硬骨鱼类中具有组织特异性表达,即卵巢特异性表达,在卵巢中表达量最高,在其他组织中有少量表达或不表达。从鱼的发育时期方面来说,有研究表明,斑马鱼性腺型芳香化酶基因在卵黄发生过程中主要表达于滤泡中[23];印度囊鳃鲇(Heteropneustesfossilis)[24]性腺型芳香化酶基因的表达水平在卵巢重复发育和卵泡卵黄累积早期逐渐升高,而在卵黄累积完成后迅速降低;绿鳍马面鲀[8]性腺型芳香化酶基因表达量在卵巢重复发育时逐渐升高,同时卵黄逐渐积累,直到卵黄累积结束时达到最高值,排卵结束时达到最低值。进一步对暗纹东方鲀不同发育期性腺中性腺型芳香化酶基因的表达水平进行分析,结果表明,性腺型芳香化酶基因在幼鱼不同发育期卵巢中的表达量呈现逐渐升高再降低的表达趋势,在精巢中则不表达,以上结果说明性腺型芳香化酶基因可能参与性腺分化后卵巢的发育、雌性特征的维持以及其他组织的发育等过程。
综上所述,本试验首次克隆了暗纹东方鲀性腺型芳香化酶基因的cDNA全长序列,利用生物信息学方法分析其序列结构、蛋白质性质等相关信息,并应用相对定量PCR技术探明了性腺型芳香化酶基因在暗纹东方鲀雌鱼和雄鱼不同组织和不同发育阶段的表达模式,这为深入探索性腺型芳香化酶基因在暗纹东方鲀性腺发育和性别分化过程中的生物学功能奠定了重要基础,也为今后实现河鲀鱼类良种人工繁育中的性别控制提供了重要参考。
