白斑综合征病毒胶体金免疫层析试剂板的研制
2017-12-14刘长军王振国陈青舟夏武强缪翁晟途平夏婷
刘长军 ,王振国 ,陈青舟 ,夏武强 ,缪翁晟途 ,平夏婷
(1.象山县海洋与渔业质量技术检测中心,浙江 宁波 315700;2.杭州南开日新生物技术有限公司,浙江 杭州 311215)
白斑综合征病毒胶体金免疫层析试剂板的研制
刘长军1,王振国2,陈青舟2,夏武强1,缪翁晟途2,平夏婷2
(1.象山县海洋与渔业质量技术检测中心,浙江 宁波 315700;2.杭州南开日新生物技术有限公司,浙江 杭州 311215)
将胶体金免疫层析技术应用于对虾白斑综合征的诊断,研制了一种检测对虾中白斑综合征病毒的胶体金免疫层析试剂板。将胶体金标记的抗白斑综合征病毒单克隆抗体包被在金标垫上,将抗白斑综合征病毒多克隆抗体和羊抗鼠IgG分别包被在硝酸纤维素膜的检测线和质控线上。通过双抗体夹心法检测样品中白斑综合征病毒含量。结果表明,该试剂板对白斑综合征病毒的最低检出限为1.0 mg/kg,特异性好,稳定性高,整个检测所需时间为8~10 min,适合现场快速检测。
白斑综合征病毒;双抗体夹心法;免疫层析;胶体金
白斑综合征(White Spot Syndrome,简称 WSS)是由白斑综合征病毒(White Spot Syndrome Virum,简称WSSV)引起的一种对虾严重传染性疾病,典型症状为病虾头胸甲内侧出现不同大小的白色斑点。该病发病快、病死率高、传播速度快、宿主范围广,对对虾养殖造成了严重的经济损失[1]。WSS还被列入了世界动物卫生组织(OIE)水生动物疫病名录[2]。在2008年我国农业部第1125号公告《一、二、三类动物疫病病种名录》中,WSS被划为一类动物疫病[3]。
目前尚未发现有效的治疗WSS的方法,因此发展快速、灵敏、稳定的WSSV检测技术成为科研人员研究的重点。通过有效的检测技术,对虾养殖户可尽早采取预防措施,切断传播途径,最大限度地减少生产上的损失。近年来,WSSV检测的方法发展迅速,主要有:肉眼观察法,电镜观察法,生化检测、免疫学方法,细胞培养法,分子生物学法等。Numan等[4]采用巢式PCR进行WSSV的引物设计,实验结果与实时荧光定量PCR相比灵敏度得到较大的提高,检出限为1拷贝的WSSV。郑晓聪等[5]选用抗WSSV单克隆抗体包被ELISA板,用兔多抗作为捕获抗体,建立了具有良好特异性和敏感性的双抗体夹心法用于WSSV的检测。张玲[6]研发的白斑综合征病毒胶体金免疫层析半定量快速检测试纸条将不同类型的WSSV单克隆抗体混合后包被于试纸条检测线,用来检测样本中的WSSV,实验结果表明该试纸条在WSSV浓度为783 ng/mL~6.26μg/mL范围内可实现半定量检测。研究采用WSSV制备单克隆抗体与多克隆抗体,成功建立了检测WSSV的双抗体夹心法胶体金免疫层析试剂板。相比于现有的检测方法,即简化了操作流程,又缩短了检测时间,适用于快速现场检测。对实现病原的快速筛查,病情的防治有很大的促进作用。
1 材料与方法
1.1 材料
对虾白斑综合征病毒(WSSV),传染性肌肉坏死病毒(Infection Myonecrosis Virus,IMNV)、桃拉综合征病毒(Taura Syndrome Virus,TSV)、鲤春血症病毒(Spring Viraemia of Cup Virus,SVCV)、病毒性出血性败血症病毒(Viral Haemorrhagic Septicaemia Virus,VHSV)均由本实验室分离、鉴定、保存。家兔、BALB/c小鼠、ICR小鼠购自浙江大学动物实验中心。小鼠骨髓瘤细胞SP2/0由本实验室保存。健康对虾,10~20 g/尾,购于农贸市场。
1.1.1 试剂
氯金酸 (HAuCl4·4H2O)、聚乙二醇 20000(PEG20000)、聚乙二醇 40000(PEG40000)和羊抗鼠IgG、弗氏完全佐剂、弗氏不完全佐剂购于Sigma公司;DMEM培养基、HAT和HT选择性培养基购于HyClone公司;硝酸纤维素膜(NC)、胶体金结合垫、样品垫、吸水垫购于Millipore公司。白斑综合征病毒ELISA试剂盒购于北京绿源伯德生物技术有限公司。
1.1.2 仪器
BioJet XYZ3000型点膜仪购于美国BioDot公司、Avanti J-26 XP高速冷冻离心机购于美国Beckman公司、恒温鼓风干燥箱购于上海精宏实业设备有限公司、切割机购于杭州市恒通设备有限公司、78HW-1恒温磁力搅拌器购于杭州仪表电机有限公司。
1.2 方法
1.2.1 抗WSSV单克隆抗体制备
1.2.1.1 动物免疫 取适量WSSV与弗氏完全佐剂等量混合乳化,皮下注射BALB/c小鼠(抗原蛋白量为100μg/只)。初次免疫两周后,WSSV与弗氏不完全佐剂混合乳化免疫BALB/c小鼠,免疫方法同上。之后免疫不再加佐剂,分别在第6周及融合前3 d腹腔再加强免疫一次。
1.2.1.2 细胞融合 先将免疫小鼠的脾细胞与SP2/0混合于融合管内,1 000 r/min下离心10 min,除去上清液,底层细胞轻振松散后再置于37℃水浴中预热。再向细胞边缓慢滴加已预热的PEG4000溶液1 mL边进行搅拌,然后缓慢加入不完全DMEM培养基,终止融合。静置10 min后1 000 r/min下离心10 min,除去上清液,然后加入HAT培养基,使细胞悬浮并混匀。加入预先制备的ICR小鼠的腹腔巨噬细胞,充分混匀后分装至96孔细胞培养板。于6%CO2培养箱内培养至第4~5天每孔各补加1滴HAT培养基,至第9~10天用HT培养基取代HAT培养基,上清液变黄后开始检测筛选。
1.2.1.3 阳性克隆的筛选及建株 用ELISA试剂盒检测细胞上清液中的抗WSSV抗体。按常规方法进行,将实验结果为阳性的细胞扩大培养并及时冻存,同时按有限稀释法进行亚克隆2~3次,直至每孔的阳性率为100%时才可定株[8]。
1.2.1.4 腹水的制备及纯化 抗WSSV单克隆抗体细胞株复苏并将其转入培养瓶中,培养至2×107注入小鼠腹腔内(提前一周每只BALB/c健康小鼠腹腔内注射0.5 mL无菌液体石蜡),10~12 d小鼠出现腹部明显膨大,处死小鼠收集腹水。用60 mM pH 4.2的醋酸盐缓冲液4倍稀释,加腹水体积1/10的辛酸,搅拌30 min。12 000 r/min离心20 min取上清液。用1N NaOH调节上清液pH值至7.2,加硫酸铵至33%饱和度,12 000 r/min离心20 min,沉淀溶解于0.01 M pH值为7.2的PBS缓冲液中。最后透析除盐得到抗WSSV单克隆抗体,置-80℃备用[9]。
1.2.2 WSSV多克隆抗体的制备 采用常量免疫法。调整WSSV的蛋白浓度,免疫量为1 mg/只,采用相应程序共免疫6次。初次免疫后每隔2周加强免疫一次。最后一次免疫后2周,耳静脉采血,分离血清,用ELISA试剂盒检测抗体效价。效价达1∶5 000以上时,通过颈动脉放血,收集全血,分离血清。用辛酸-饱和硫酸铵法提取IgG,得到抗WSSV多克隆抗体,置-80℃备用[5]。
1.2.3 金标抗体的制备
1.2.3.1 胶体金的制备 将实验需要的所有玻璃器皿清洗干净。先用自来水清洗干净,然后在重铬酸钾洗液中浸泡过夜,最后依次使用自来水、蒸馏水、超纯水冲洗5次。在56℃烘箱中烘干备用。取0.01%氯金酸溶液100 mL加热2 min至沸腾,边搅拌边加入1%柠檬酸三钠水溶液1 mL,继续煮沸10 min至酒红色后冷却,加蒸馏水恢复到原体积,冷却后用0.22μm滤膜过滤杂质,4℃保存备用[10]。
1.2.3.2 胶体金标记单克隆抗体 取已制备好的胶体金溶液100 mL,用0.1 mol/L的K2CO3溶液调节pH值至8.0。边搅拌边添加抗WSSV单克隆抗体直至胶体金溶液恢复酒红色,并在10 min内不褪色。共加入抗WSSV单克隆抗体1.5 mg。磁力搅拌器上搅拌20 min,再逐滴加入2 mL 25 g/L PEG20000,搅拌15 min。20 000 r/min离心15 min,除去上清液,用10 mL pH值7.4的PBS缓冲液(含0.4 g/L PEG20000)清洗2次。将沉淀物用5 mL含质量浓度为20 g/L BSA的PBS缓冲液(pH值7.4)溶解,过0.22μm无菌过滤器,4℃保存备用[12]。
1.2.4 试剂板的组装
将样品垫(玻璃纤维)用含2%BSA、2.5%蔗糖、1%吐温-20、0.3%PVP-k30 以及 0.02%NaN3的0.002 mol/L的硼酸溶液缓冲液(pH值7.4)封闭,于37℃温箱中干燥[11]。用点膜仪将制备好的金标抗体喷涂到玻璃纤维上,喷膜量为1μL/cm。立即放入冷冻真空干燥机中抽干。抗WSSV多克隆抗体和羊抗鼠IgG用 0.01 mol/L PBS(pH 值 7.2)稀释至 2 mg/mL,用点膜仪分别喷涂在NC膜上作为检测线(T线)和质控线(C线),喷膜量为1μL/cm。样品垫、金标结合垫、硝酸纤维素膜和吸水垫按顺序黏贴于PVC背衬上。用切割机将贴好的板切割成4 mm宽的细条,装入塑料模板中制成检测试剂板,然后放入带干燥剂的铝箔袋中密封。试剂板组成如图1所示。
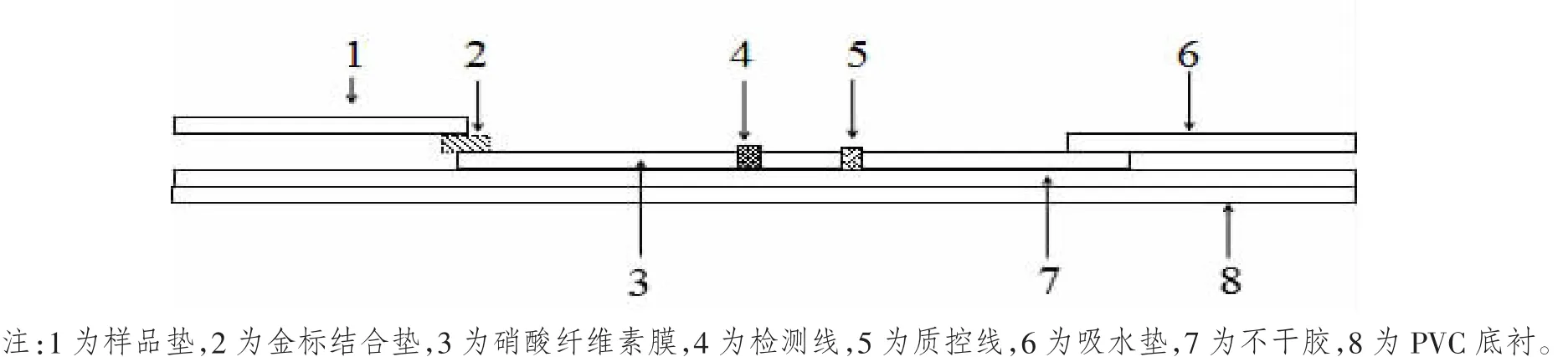
图1 胶体金免疫层析试纸条组成
1.2.5 样品检测操作
取出检测试剂板,用滴管吸取待检样品溶液,滴加2滴于加样孔中,加样后开始计时:结果应在3~5 min读取,其他时间判读无效;读取结果。若试剂板上T线与C线均显色,结果为阳性;若试剂板仅C线出现紫红色而T线未显色,结果为阴性;若试剂板上C线与T线均为显色,结果无效,需要重新检测。检测结果如图2所示。
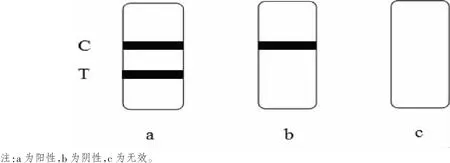
图2 检测结果示意图
1.2.6 检出限检测
称取健康对虾(PCR检测无WSSV感染)的虾鳃 2 g,加入 WSSV 溶液至终浓度为 0.25、0.5、0.75、1.0、2.0、4.0 mg/kg,再加入 0.01 M PBS 按 1 ∶10(W/V)的比例混合,加少量石英砂用研钵研磨、匀浆1 min,再沉淀5~10 min,取上清液作为加标检测样品,用1.2.4制备的试剂板分别对其进行检测,阴性对照为0.01 mol/L PBS溶液。每组设6个平行样。
1.2.7 特异性检测
按照上述方法将 IMNV、TSV、SVCV、VHSV 四种病毒加入健康对虾的虾鳃中配置成加标检测样品,阳性对照为WSSV加标检测样品,浓度均与1.2.6测定的检出限相同。阴性对照为0.01 mol/L PBS溶液。用1.2.4制备的试剂板分别对其进行检测,每组设6个平行样。
1.2.8 试剂板检测与ELISA的符合率
取健康对虾虾鳃样本20份,其中10份加入WSSV制成阳性样本,另外10份加入0.01 mol/L PBS溶液制成阴性样本。分别使用ELISA试剂盒及试剂板检测WSSV的含量比较两者的符合率。
1.2.9 稳定性检测
取3个不同批次的试纸条在20~25℃条件下连续放置 12 个月,期间于生产当天、1、2、3、6、9、12个月分别从3个批次产品中抽取检测试剂卡检测阳性和阴性样品各50份,测定检出限、假阳性率和假阴性率。
2 结果与分析
2.1 检出限
将阴性对照以及WSSV终浓度为0.25、0.50、0.75、1.0、2.0、4.0 mg/kg 的加标检测样品,用试剂板进行测定。每个试样做6个重复,3~5 min后观察结果,检测线颜色呈梯度递增,实验结果如图3所示。在阴性对照及WSSV终浓度为0.25、0.50 mg/mL范围内,C线显色而T线不显色;0.75 mg/mL浓度下C线显色,T线条带模糊;1.0~4.0 mg/kg范围内T线与C线显紫红色,条带清晰。实验结果表明,该试剂板的WSSV检测限为1.0 mg/kg。
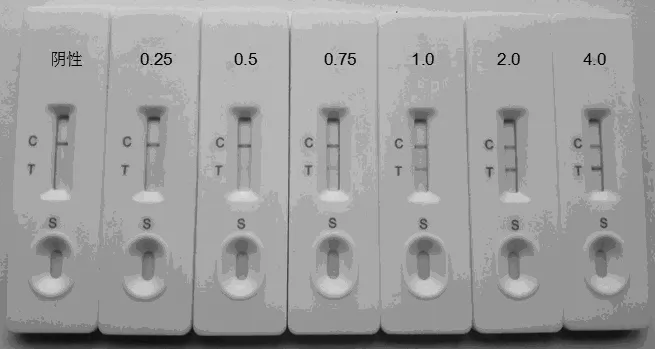
图3 胶体金试剂板的检出限实验结果
2.2 特异性
将 IMNV、TSV、SVCV、VHSV 四种病毒加入健康对虾的虾鳃中配置成1.0 mg/kg加标检测样品,用试剂板进行测定,判断其检测的特异性情况。其中阳性对照为终浓度为1.0 mg/kg的WSSV加标检测样品,阴性对照为0.01 mol/L PBS溶液。实验结果如表1所示。试剂板对IMNV、TSV、SVCV、VHSV四种病毒反应呈阴性,实验结果表明试剂板对WSSV具有较高的特异性。
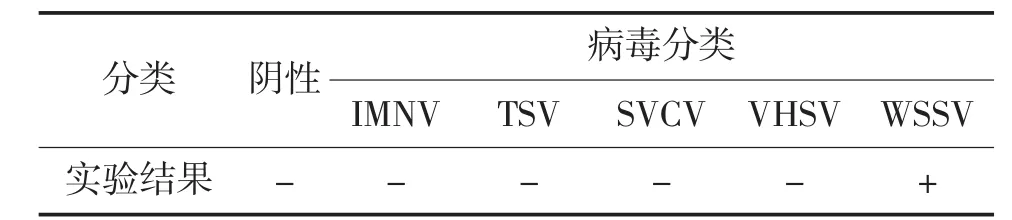
表1 胶体金试剂板特异性实验结果
2.3 符合率
用试剂板对含不同质量浓度的WSSV虾鳃处理样品进行检测并与ELISA的检测结果相比较。共检测20份样品,其中阴性样品10份,阳性样品10份,部分样品检测结果如表2所示:在WSSV浓度高于1.0 mg/kg时,试剂板的实验结果为阳性;在WSSV浓度低于1.0 mg/kg时,试剂板实验结果为阴性,均与ELISA实验结果相符。所以该试剂板的定量检测限为1.0 mg/kg。
2.4 试纸条稳定性
用同一批次不同检测试剂检测同一样品,用不同批次检测试剂检测同一样品,其质控线、检测线的显色时间及颜色深浅和最终结果判断基本相同。将3个不同批次的试剂板在20~25℃条件下连续放置 12 个月,期间于生产当天、1、2、3、6、9、12 个月分别从3个批次产品中抽取检测试剂卡检测阳性和阴性样品各50份,测定检出限、假阳性率和假阴性率。实验结果如表3所示。在12个月之内,试剂板的检出限未发生变化,假阳性率和假阴性率在4%以下,为可接受范围。因此试剂板能在室温条件下(20~25℃)保存12个月。
3 结论与展望
试剂板用于对虾虾鳃中WSSV的检测,灵敏度为1.0 mg/kg。具有特异性高、稳定性好、检测时间短、操作简便等特点。可用于对虾中WSSV的现场快速检测,为WSSV的预防和诊断提供依据。
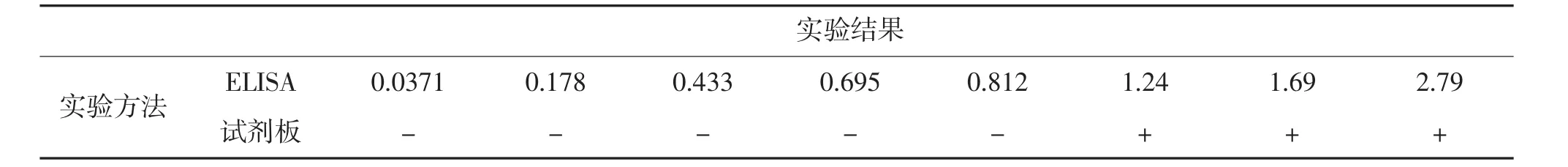
表2 胶体金免疫层析试剂板与ELISA检测结果比较
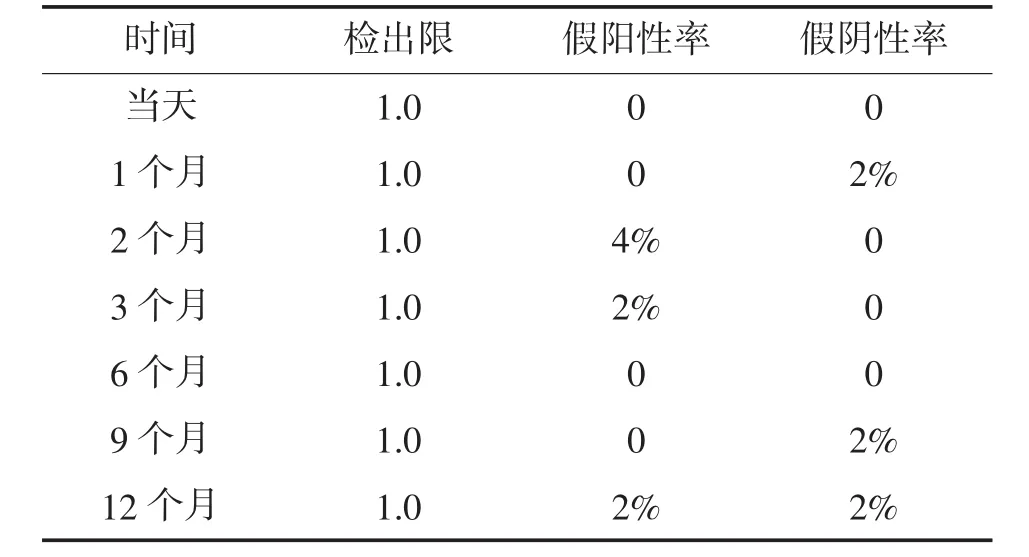
表3 胶体金免疫层析试剂板的稳定性试验结果
试剂板的制备基于双抗体夹心原理。金标结合垫上包被的抗WSSV单克隆抗体与T线上包被的抗WSSV多克隆抗体将样本中的WSSV分别进行固定和截留,最终以T线与C线均显色作为WSSV存在的判别标准。抗WSSV单克隆抗体与抗WSSV多克隆抗体的分离纯化直接影响到最终产品的灵敏度,过柱是提高抗体纯度的方法之一。谷万港[13]在硫酸铵沉淀法的基础上增加亲和层析能亲和柱进行抗VP28单克隆抗体(抗WSSV单克隆抗体的一种类型)的纯化,但该方法会存在抗体消耗量大的问题,因此大批量制备时要考虑到其中的损益。在胶体金标记单克隆抗体的过程中,胶体金的颗粒大小和标记过程的pH值等均会对金标抗体的质量造成影响。本实验中采用的胶体金制备方法使胶体金颗粒直径在40μm,对于其抗体吸附能力和稳定性均能适应检测的需要。为使胶体金pH值等于单克隆抗体等电点pH值,使胶体金与单克隆抗体结合最紧密,形成的金标抗体最稳定,本实验用0.1 mol/L的K2CO3溶液精确地找到胶体金标记单克隆抗体的最佳pH值。但本实验的适用对象固定在经济作物对虾,这就意味着对于其他宿主如蟹类、桡足生物等无法做到WSSV的准确检测。因此在检出限的设置方面可以再进行其他样本的实验,从而推广其应用范围。
目前,胶体金免疫层析技术在毒素检测、抗生素检测、重金属检测、微生物检测、病毒检测等领域都有应用。定性检测向定量检测的转化,检测仪器的跟进加快了胶体金快速检测试剂的发展。操作方便、灵敏、快速等现场检测方面的优点和低成本的特定优势使其具有商业化的发展前景。
[1]Jesús Genaro Sánchez-Martínez,Gabriel Aguirre-Guzmán,Humberto Mejía-Ruíz.White Spot Syndrome Virus in cultured shrimp:A review [J].Aquaculture Research,2007,38(13):1339-1354.
[2]世界动物卫生组织(OIE),国家质量监督检验检疫总局译.水生动物疾病诊断手册[M].北京:中国农业出版社,2000.[3]农业部.农业部1125号公告:一、二、三类水生动物疫病病种名录[S].北京:农业部,2008.
[4]Numan L M,Lightner D V.Optimized PCR assay for detection of white spot syndrome virus(WSSV)[J].Journal of Virological Methods,2011(171):318-321.
[5]郑晓聪,刘荭,张朋,等.对虾白斑综合征病毒双抗体夹心ELISA 方法的建立[J].中国动物检疫,2012,29(4):41-43.
[6]张玲.白斑综合征病毒胶体金免疫层析半定量快速检测试纸条的研制与应用[D].青岛:中国海洋大学,2015.
[7]Xiaojie Wang,Wenbin Zhan.Development of an immunochromatographic test to detect white spot syndrome virus of shrimp[J].Aquaculture,2006(225):196-200.
[8]郝贵杰,沈锦玉,徐洋,等.WSSV单克隆抗体的制备及其在红螯螯虾病毒病检测中的初步应用[J].集美大学学报(自然科学版),2009(2):120-125.
[9]王晓洁.对虾白斑症病毒快速检测试剂盒的研制及其应用[D].青岛:中国海洋大学,2005.
[10]Nguyen D T,Kim Dong-Joo,Kim Kyo-Seon.Controlled synthesis and biomolecular probe application of gold nanoparticles[J].Micron,2011,42(3):207-227.
[11]彭伏虎,王政,毕丁仁.H9亚型禽流感病毒胶体金免疫层析快速检测试纸条的研制及初步应用研究 [A].首届中国兽药大会——兽医生物制品学、兽医微生物学学术论坛论文集[C].北京:中国兽医药品监察所,2008.
[12]王钱,李康,陈树芬,等.胶体金免疫层析法对组织样品中磺胺甲恶唑残留的快速检测 [J].分析测试学报,2009,28(4):458-461.
[13]谷万港.对虾白斑综合征病毒单克隆抗体的制备和应用[D].北京:中国科学院研究生院,2006.
广东湛江出口中国2017年首批输澳生虾
广东湛江检验检疫局2017年9月11日向媒体通报,中国2017年首批出口澳大利亚生虾经湛江检验检疫局检验合格后,目前正由湛江港装船运往澳大利亚。
据了解,该批生虾产品共6个货柜,由广东国美水产食品有限公司生产,重量97.64 t,货值190.25万美元。
湛江是中国水产品养殖、加工和出口大市,水产业形成了完整的产业链,并代表中国先后通过了美国、欧盟、韩国、日本、俄罗斯等国家和地区的水产品质量监控体系的考察评估,当地养殖的生虾、活鱼也实现了中国内地首次直供香港。
据介绍,2017年1月初,澳大利亚因国内发生白斑病综合征病毒(WSSV)暂停各国生虾进口,给包括湛江在内的中国水产品出口企业带来严重损失,产业发展面临困境。
为扭转不利局面,湛江检验检疫局主动应对,加强辖区养殖场疫病监测,提升产品质量,增强湛江水产品国际竞争力,并协助做好与澳方的沟通交涉,推动禁令解除。
(www.bbwfish.com)
Development of coloidal gold immunochromatographic plate for white spot syndrome virum
Liu Changjun1,Wang Zhenguo2,Chen Qingzhou2,Xia Wuqiang1,Miaoweng Shengtu2,Ping Xiating2
(1.Xiangshan Ocean and Fishery Quality and Technical Testing Center,Ningbo 315700,China;2.Hangzhou Nankai Biotech Co.,Ltd.,Hangzhou 311215,China)
A coloidal gold immunochromatographic plate for white spot syndrome virum in shrimp was developed.The colloidal gold conjugate pad combined anti-white spot syndrome virus monoclonal antibody.The anti-white spot syndrome virus polyclonal antibody and goat anti-mouse IgG were coated on test line and control line,respectively.White spot syndrome virum could be detected by this plate through double antibody sandwich method.The results of this paper showed that detection limit of the plate was 1.0 mg/kg,the specificity and the stability of the plate were high,and the results could be known just in 8~10 min.This plate was suitable for rapid detection in outdoors.
white spot syndrome virum;double antibody sandwich method;immunochromatographic;coloidal gold
S917
A
1004-2091(2017)10-0001-06
10.3969/j.issn.1004-2091.2017.10.001
杭州市科技发展计划(20150432B34)
刘长军(1978-),男,高级工程师,研究方向为生物检测技术.E-mai:xs65763110@126.com
2017-01-09)
