LKB1和P57KIP2的表达与神经胶质瘤临床病理学特征及预后的关系▲
2017-11-29谢昌纪周志宇陈杰飞韦成聪
谢昌纪 苏 赓 周志宇 陈杰飞 韦成聪
(广西医科大学附属民族医院1 神经外科,2 病理科,南宁市 530001)
·论 著·
LKB1和P57KIP2的表达与神经胶质瘤临床病理学特征及预后的关系▲
谢昌纪1苏 赓2周志宇1陈杰飞1韦成聪1
(广西医科大学附属民族医院1 神经外科,2 病理科,南宁市 530001)
目的探讨LKB1和P57KIP2在神经胶质瘤中的表达,研究其与临床病理特征及生物学行为的关系。方法应用免疫组化SP法检测53例神经胶质瘤和20例正常脑组织中LKB1和P57KIP2基因蛋白的表达,结合病例随访资料分析其临床意义。结果LKB1及P57KIP2蛋白在神经胶质瘤中的表达率与正常脑组织中的表达率相比较,差异具有统计学意义(Plt;0.05);LKB1、P57KIP2蛋白的阳性率与神经胶质瘤的WHO分级和瘤周脑水肿具有相关性 (Plt;0.05),与性别和年龄不相关(Pgt;0.05);LKB1和P57KIP2蛋白在神经胶质瘤中的表达率复发组与无复发组有明显差异(Plt;0.05);LKB1蛋白与P57KIP2蛋白的表达呈正相关(r=-0.396,Plt;0.01)。结论LKB1、P57KIP2的表达与人神经胶质瘤的发生及进展相关;LKB1、P57KIP2表达的降低为神经胶质瘤发生的早期事件并且LKB1、P57KIP2低表达患者预后较差。联合检测LKB1、P57KIP2蛋白的表达对神经胶质瘤的早期诊断、判断预后有参考价值。
神经胶质瘤;LKB1;P57KIP2; 免疫组织化学
脑神经胶质瘤是成人神经肿瘤中最常见的致命性恶性肿瘤之一,在脑恶性肿瘤中占70%[1]。由于脑神经胶质瘤发展的病理生理机制尚不明确,其替代治疗的效果十分有限。因此,了解神经胶质瘤发展过程中的分子机制对于准确诊断、早期干预和有效治疗有促进作用,而治疗后肿瘤的复发仍然是重大问题。周期素依赖激酶蛋白质LKB1、P57KIP2的过度表达是许多肿瘤发生发展的重要因素,许多肿瘤均显示出 LKB1、P57KIP2的过度表达。但是,脑胶质瘤中是否存在LKB1、P57KIP2的过度表达仍然存在一些争议。本研究旨在观察人脑胶质瘤组织中LKB1、P57KIP2的表达水平,并分析LKB1、P57KIP2与胶质瘤恶性程度及预后的关系。
1 资料与方法
1.1 临床资料 选取我院2002年12月至2010年12月共73块存档用蜡块资料,其中神经胶质瘤(肿瘤组)53例,正常脑组织(正常组)20例;按照2000年WHO中枢神经系统肿瘤分类标准,肿瘤组中低度恶性Ⅰ~Ⅱ级31例,高度恶性Ⅲ~Ⅳ级共22例;年龄12~66岁,中位年龄39岁,其中男性29例,女性24例;随访观察发现,3年内复发33例,无复发20例。正常组为因良性病变需行正常脑组织切除者,其中男10例,女10例,中位年龄35岁。以上病理切片均由两名病理高级职称人员进行专业诊断,并结合患者临床症状,确保结果准确率。患者间临床基本资料差异行统计检验,提示差异对本组研究无干扰性意义。
1.2 免疫组化 LKB1(批号:MAB-0529)和p57Kip2(批号:MAB-317)单克隆即用型抗体和S-PKits均购自福州迈新生物技术公司产品,标本经10%甲醛溶液固定,每例标本分别进行两种处理:①常规切片HE染色(苏木精-伊红染色法;hematoxy lin-eosin staining,HE)复查诊断;②用于免疫组织化学(免疫组化)染色的标本按如下方法处理:10%甲醛溶液固定,石蜡包埋;切片厚3~4 μm,贴在预先涂有多聚赖氨酸的干净载玻片上,放入55~60℃恒温箱24 h以上,至染色时取出,以防止脱片,按常规SP法染色。设立对照:以已知LKB1和P57KiP2阳性组织切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 结果判定 LKB1和P57KIP2在细胞核内出现棕黄色着色为阳性细胞。每张切片随机选取5个高倍视野,计数1 000个细胞中阳性细胞的百分比为标准,阳性细胞0~10%为阴性(-),阳性细胞数gt;10%为阳性(+)。
1.4 统计学分析 应用 SPSS 17.0软件进行统计学分析。计数资料用百分率(%)表示,采用χ2检验或Fisher确切概率法,采用Spearman等级相关分析法分析两种蛋白表达与预后的相关性。以Plt;0.05为差异有统计学意义。
2 结 果
2.1 LKB1和P57KIP2的阳性表达率比较 神经胶质瘤中LKB1阳性表达率为54.79%(29/53),见图1;正常脑组织中LKB1阳性表达率为85.00%(17/20),两组比较差异有统计学意义(Plt;0.05)。胶质瘤中P57KIP2阳性表达率为50.94%(27/53),见图2;正常脑组织中P57KIP2阳性表达率为80.00%(16/20),两组比较差异有统计学意义(Plt;0.05)。见表1。

表1 LKB1和P57KIP2在神经胶质瘤和正常脑组织中阳性的表达率比较

图1 LKB1在胶质瘤中的表达(SP法×200倍)
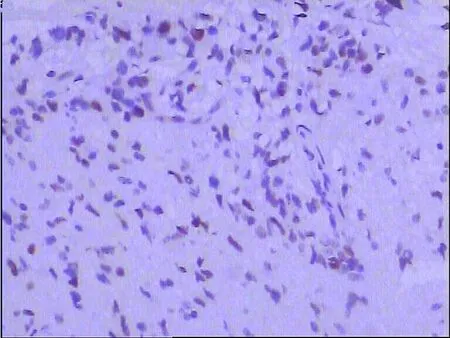
图2 P57KIP2在胶质瘤中的表达(SP法×200倍)
2.2 LKB1和P57KIP2在神经胶质瘤患者中的临床病理特征 53例神经胶质瘤中LKB1和P57KIP2的阳性表达率均与神经胶质瘤的病理分化程度及瘤周脑组织有无水肿相关,LKB1和P57KIP2蛋白阳性表达的患者术后无明显水肿;LKB1和P57KIP2在病理Ⅳ~Ⅴ级组表达率明显低于Ⅰ~Ⅱ级组(Plt;0.05);LKB1和P57KIP2的阳性表达均与患者性别和年龄无相关性(Pgt;0.05),见表2。

表2 神经胶质瘤患者临床病理特征与LKB1和P57KIP2蛋白蛋白表达的关系
2.3 神经胶质瘤中LKB1和P57KIP2表达的相关性 应用Spearman等级相关分析分析LKB1和P57KIP2蛋白表达的相关性,结果显示相关系数r=0.396,P=0.003,提示P57KIP2和LKB1表达呈正相关。
2.4 神经胶质瘤LKB1蛋白和P57KIP2表达与肿瘤复发关系 随访观察发现,53例神经胶质瘤患者3年内复发33例,无复发20例。其中复发组LKB1蛋白阳性表达率为42.42%,明显低于无复发组的75.00%(Plt;0.05);复发组P57KIP2蛋白阳性表达率为39.39%,明显低于无复发组的70.00%(Plt;0.05)。见表3。

表3 神经胶质瘤有无复发中LKB1蛋白和P57KIP2蛋白阳性表达率比较
3 讨 论
LKB1基因,也被称为丝氨酸-苏氨酸激酶11(STK11) ,人类LKB1基因已被定位于染色体19p13.3。该基因跨越23kb,由9个编码外显子和非编码外显子组成。LKB1编码在端粒到着丝粒方向转录的2.4kb的mRNA 。LKB1蛋白在人体中含有433个氨基酸(aa),在小鼠中含有436个氨基酸。其催化结构域从aa49延伸至aa309,序列与任何已知的蛋白激酶无关。LKB1在所有胎儿和成年组织中广泛表达,尽管有不 同的水平。LKB1形成具有两个附件亚基的Ste20相关衔接蛋白(STRAD)和小鼠蛋白-25(MO25)异源三聚复合物,并作为组成型活性的丝氨酸/苏氨酸激酶,其为AMPK家族成员[2-4]。在许多肿瘤细胞系中LKB1表达通过诱导G1细胞周期停滞而抑制其生长,与肿瘤恶变相关。研究发现肝癌[5]、肺癌[6]等肿瘤中LKB1过度表达提示较差的预后。LKB1在人脑神经胶质瘤中的表达与肿瘤预后方面,目前国内罕见有报道。本文数据表明,LKB1的下调与人神经胶质瘤的恶性程度密切相关,在较高等级下显示较低的表达。这与Godlewski等[7-8]的研究结果类似。我们通过回顾性研究发现,LKB1基因参与细胞周期调控,值得注意的是,LKB1可作为手术后胶质瘤患者的潜在预后生物标志物。
细胞周期蛋白依赖性激酶抑制剂(CKIs)是通过负调节细胞周期蛋白依赖性激酶(CDK)来控制细胞周期进程的酶家族。CKI放松管制就会导致不受控制的增殖和肿瘤发生。 Cip/Kip家族的最新成员p57Kip2(其功能尚未完全阐明)被认为是重要的推定肿瘤抑制基因[9],因为其能够抑制癌症的几个标志物。P57KIP2在抑制癌症中的重要性在Beckwith-Wiedemann综合征(癌症预处理综合征)中的突变/失活突出, P57KIP2在癌细胞中的表达由启动子DNA甲基化在CpG岛和(或)组蛋白修饰,例如甲基化和脱乙酰化介导的。值得注意的是,肿瘤中p57KIP2表达的缺乏与存活率差相关,并且已被鉴定为许多上述癌症类型的预后标志物[10-11]。P57KIP2在G1-S期和G2-M期阶段具有调节细胞周期蛋白和CDKs的功能,控制DNA复制和参与肿瘤细胞增殖[12],在各种肿瘤中P57KIP2基因突变的缺失表明转录或转录后机制可能参与其下调的蛋白质表达[13]。在本研究中,我们发现胶质瘤组织中P57kIP2阳性表达率明显低于邻近组织;分化越差的肿瘤组织,其P57KIP2表达越低,并与P57的表达降低之间没有相关性瘤周脑组织水肿。结果表明,P57KIP2的表达减少与胶质瘤的发生和恶性程度有关。胶质瘤中P57KIP2表达下降,恶性程度和伴随症状均升高,另外P57KIP2阳性表达率高的神经胶质瘤患者与阳性率低者相比,术后肿瘤复发率较低, 说明P57KIP2在胶质瘤的发展、浸润和转移过程中发挥了重要作用。此结果与Tsugu等[15]的研究结果类似。
另外,本研究发现,在神经胶质瘤中LKB1与P57KIP2在神经胶质瘤中的表达呈正相关系 (r=0.396,Plt;0.01)。LKB1与P57KIP2在神经胶质瘤的共同作用机制,目前未见报道,推测可能是在受各种致瘤因素共同作用下,LKB1和P57KIP2的共同缺失导致其失去了肿瘤抑制基因的功能,基因的损伤得不到及时的修复,从而促进了神经胶质瘤细胞的进展,共同促进肿瘤生长与侵袭。总之,这些细胞周期蛋白通过各种肿瘤类型的不同机制调节细胞生长。
总之,本研究表明LKB1和P57KIP2的表达在胶质瘤中呈负相关。P57KIP2和LKB1均与神经胶质瘤患者预后相关,高LKB1和高P57KIP2指数可预测更差的预后。此外,我们已经发现LKB1可以直接调节胶质瘤细胞体内P57KIP2的降解。这些发现表明,LKB1在调节P57KIP2中起重要作用,也表明这些标记物的组合在胶质瘤的诊断和治疗中具有预后价值。LKB1、P57KIP2的表达与人神经胶质瘤的发生及进展相关;LKB1、P57KIP2表达的降低为神经胶质瘤发生的早期事件,并且LKB1、P57KIP2呈低表达患者的预后较差,检测LKB1、P57KIP2的表达对人神经胶质瘤的早期诊断、判断预后及筛选高危患者有重要意义。它们能否作为肿瘤相关抗原来引发机体特异性免疫反应,从而成为肿瘤生物学靶向治疗的靶点呢? 这还需要大规模的临床观察来进一步证实。
[1] Kim YH, Lachuer J, Mittelbronn M, et al. Alterations in the RB1 pathway in low-grade diffuse gliomas lacking common genetic alterations[J].Brain Pathol,2011,21(6):645-651.
[2] Walsh NC, Waters LR, Fowler JA,et al.LKB1 inhibition of NF-κB in B cells prevents T follicular helper cell differentiation and germinal center formation[J].EMBO Rep,2015,16(6):753-768.
[3] Granja S, Marchiq I, Le Floch R,et al.Disruption of BASIGIN decreases lactic acid export and sensitizes non-small cell lung cancer to biguanides independently of the LKB1 status[J].Oncotarget,2015,6(9):6708-6721.
[4] Fu A, Robitaille K, Faubert B,et al.LKB1 couples glucose metabolism to insulin secretion in mice[J].Diabetologia,2015,58(7):1513-1522.
[5] Barbier-Torres L, Delgado TC, García-Rodríguez JL,et al.Stabilization of LKB1 and Akt by neddylation regulates energy metabolism in liver cancer[J].Oncotarget,2015,6(4):2509-2523.
[6] Zhou W, Zhang J, Marcus AI,et al.LKB1 Tumor Suppressor: Therapeutic Opportunities Knock when LKB1 Is Inactivated[J].Genes Dis,2014,1(1):64-74.
[7] Godlewski J, Nowicki MO, Bronisz A,et al.MicroRNA-451 regulates LKB1/AMPK signaling and allows adaptation to metabolic stress in glioma cells[J].Mol Cell,2010,37(5):620-632.
[8] Chao AC, Hsu YL, Liu CK,et al.α-Mangostin, a dietary xanthone, induces autophagic cell death by activating the AMP-activated protein kinase pathway in glioblastoma cells[J].J Agric Food Chem,2011,59(5):2086-2096.
[9] Tury A, Mairet-Coello G, DiCicco-Bloom E. The cyclin-dependent kinase inhibitor p57Kip2 regulates cell cycle exit, differentiation, and migration of embryonic cerebral cortical precursors [J].Cereb Cortex,2011,21(8):1840-1856.
[10] Furutachi S, Matsumoto A, Nakayama KI,et al. p57 controls adult neural stem cell quiescence and modulates the pace of lifelong neurogenesis[J].EMBO J,2013,32(7):970-981.
[11] Sarkar S, Dubaybo H, Ali S,et al. Down-regulation of miR-221 inhibits proliferation of pancreatic cancer cells through up-regulation of PTEN, p27(kip1), p57(kip2), and PUMA [J].Am J Cancer Res,2013,3(5):465-477.
[12] Joseph B, Hermanson O. Molecular control of brain size: regulators of neural stem cell life, death and beyond [J].Exp Cell Res,2010,316(8):1415-1421.
[13] Li Y, Wang D, Zhang H,et al. P21-activated kinase 4 regulates the cyclin-dependent kinase inhibitor p57(kip2) in human breast cancer[J].Anat Rec (Hoboken),2013,296(10):1561-1567.
[14] Ito Y,Takeda T, Sasald Y, et al. Expression of P57kip2 protein in extrahepatic bile duct carcinoma and intrehepatic cholangiocellular carcinoma[J].Liver,2002,22(2):145-149.
[15] Tsugu A,Sakai K,Dirks PB,et al. Expression of p57(KIP2) potently blocks the growth of human astrocytomas and induces cell senescence[J].Am J Pathol,2000,157(3):919-932.
RelationshipofLKB1andP57KIP2expressionswithclinicopathologicalfeaturesandprognosisofneurospoagioma
XIEChangji1,SUGeng2,ZHOUZhiyu1,CHENJiefei1,WEIChengcong1
(1.DepartmentofNeurologicalSurgery, 2.Departmentofpathology,MinzuHospitalAffiliatedtoGuangxiMedicalUniversity,Nanning,Guangxi530001,China)
ObjectiveTo explore the expressions of LKB1 and P57KIP2 in neurospoagioma,and to investigate the relationship of their expressions with clinicopathological features and biological behavior.MethodsThe expressions of LKB1 and P57KIP2 proteins were detected in 53 cases of neurospoagioma tissues and 30 cases of normal brain tissues using S-P immunohistochemical method, and its clinical significance was analyzed on the basis of follow-up data.ResultsThere were significant differences in the expression rates of LKB1 and P57KIP2 proteins between neurospoagioma and normal brain tissues(Plt;0.05).The positive rates of LKB1 and P57KIP2 proteins correlated to WHO grade of neurospoagioma and peritumorous encephaledema(Plt;0.05), but did not correlate to age and gender(Pgt;0.05). There were significant differences in the LKB1 and P57KIP2 expression rates of neurospoagioma tissues between recurrence group and non-recurrence group(Plt;0.05). LKB1 protein expression positively correlated to P57KIP2 protein expression(r=-0.396,Plt;0.01).ConclusionThe expressions of LKB1 and P57KIP2 protein were related to the occurrence and development of human neurospoagioma. Decreased LKB1 and P57KIP2 expressions may be an early event for the incidence of neurospoagioma, and the patients with decreased LKB1 and P57KIP2 expressions have poor prognosis. Determination of LKB1 and P57KIP2 protein is valuable in the early diagnosis and prognosis assessment of neurospoagioma.
Neurospoagioma; LKB1; P57KIP2; Immunohistochemistry
广西区卫生计委科研课题(编号:Z2015111)
R 739.4
A
1673-6575(2016)05-04
10.11864/j.issn.1673.2017.05.02
2017-06-14
2017-08-07)
