慢性心衰大鼠心肌细胞内雷尼丁受体及其调节蛋白Calstabin2表达异常的研究
2017-11-27刘明明牛治鑫周永忠胡淑婷
刘明明,牛治鑫,周永忠,胡淑婷
·论 著·
慢性心衰大鼠心肌细胞内雷尼丁受体及其调节蛋白Calstabin2表达异常的研究
刘明明,牛治鑫,周永忠,胡淑婷
目的研究慢性心衰大鼠心肌细胞肌浆网雷尼丁受体及其调节蛋白FK506结合蛋白(Calstabin2)的异常表达。方法雄性SD大鼠25只,按照3∶2的比例随机分为心衰组(15只)和假手术组(10只),运用激光扫描共聚焦显微镜、Western-blot等方法研究2组大鼠心肌细胞肌浆网内钙容量及钙释放通道雷尼丁受体(RyR2)和其调节蛋白Calstabin2表达的变化。结果慢性心衰大鼠心功能LVEDP(8.91±2.16)mmHg、dp/dtmax(2 250.19±172.44)mmHg/s,显著低于假手术组大鼠心功能LVEDP(4.17±1.15)mmHg、dp/dtmax(4 822.54±221.62)mmHg/s(Plt;0.05);慢性心衰大鼠心肌细胞肌浆网内钙容量ΔF/F0=25.3±2.8,显著低于假手术组大鼠肌浆网内钙容量ΔF/F0=47.8±3.5(Plt;0.05);慢性心衰大鼠心肌细胞内Calstabin2的表达较对照组下调。结论Calstabin2的表达下调所致RyR2稳定性下降是导致心衰的原因之一。
心力衰竭;肌浆网;雷尼丁受体;FK506结合蛋白
近年来,心血管疾病逐渐威胁到人类的健康,在致死性疾病中居于首位。心力衰竭是所有心脏疾病发展的终末阶段,病理生理学特点为心输出量降低,重要脏器组织灌注不足,体循环或肺循环充血[1]。各种导致心衰的原因中,心室肌细胞内钙离子通道状态以及调控钙离子通道的蛋白异常是其发病的主要原因之一[2]。本实验以大鼠慢性心衰模型作为研究对象,通过激光扫描共聚焦显微镜和免疫印迹等技术对慢性心衰的发病机制进行讨论和研究。
1 材料与方法
1.1 材料:选用标准雄性Sprague-Dawley(SD)大鼠25只,体质量200~250 g,按照3∶2的比例随机分为心衰组即心梗手术组(n=15)和假手术组(n=10)。试剂:Fluo-5N/AM荧光染料购于Biotium公司,用二甲基亚砜溶解备用;RyR antibody和Calstabin2 antibody均购于Abcam公司;Ⅱ型胶原酶、小牛血清蛋白、HEPES等购于Sigma公司。
1.2 建构大鼠慢性心衰模型:2组大鼠都用20%氨基甲酸乙酯进行腹腔注射麻醉(3.5 mL/kg),将已麻醉的大鼠固定在鼠台上,手术暴露气管,然后行经喉气管插管,连接动物呼吸机,手术逐层开胸,暴露心脏,穿线并结扎冠状动脉左前降支(LAD)(假手术组仅做LAD穿线,并不结扎)。术后观察20 min左右大鼠心电图稳定以后手术关闭胸腔,待其苏醒恢复自主呼吸后回笼饲养[3-4]。手术前后,均应记录大鼠的心电图,当Ⅱ导联ST段出现弓背上抬时,说明冠状动脉左前降支结扎成功(图1-图2,目录后)。2组大鼠均饲养28 d,自由饮食。
模型建立28 d(4周)后,分别观察并记录2组大鼠的各项心功能指标,包括心率(HR)、左心室压力的最大上升速率(dp/dtmax)和左心室压力的最大下降速率(dp/dtmin)、左心室舒张末期压力(LVEDP)。
1.3 分离大鼠心室肌细胞后运用胶原酶Ⅱ消化法分离2组大鼠的心室肌细胞[5]:首先用20%氨基甲酸乙酯进行腹腔注射麻醉(3.5 mL/kg),将大鼠全身肝素化,立即开胸剪下大鼠心脏放入无钙台式液(0 ℃)中清洗;然后主动脉逆行插管,结扎、固定后将心脏悬挂于Langendorff装置下,依次行无钙台式液逆行灌流(5~7 min)、台式液灌流 (8~10 min);随后将心室剪下(心衰组在梗死区部位取材),置于改良的Kraft-Bruhe(KB)液(37 ℃)中,将心室肌剪碎并吹打2 min,通过过滤获得单个心室肌细胞,再将其沉淀10~15 min后置于改良的KB液中,室温下静置1~1.5 h后用于检测Ca2+容量。
1.4 大鼠心肌细胞肌浆网内钙容量的检测:以荧光染料Fluo-5N/AM将2组心肌细胞孵育好后放置于细胞营养液中,用激光共聚焦扫描显微镜记录SR内的Ca2+容量,选用40倍油镜,孔径大小(NA)为1.25 mm,发射波波长500~560 nm,激发光为波长488 nm的氩光。激光共聚焦显微镜的成像方式为面扫描(xyz),采样速率20 s/帧。所有实验均在室温20~22 ℃的条件下进行。Fluo-5N/AM是一种肌浆网钙荧光探针,可以与Ca2+结合,能特异性地显示肌浆网内Ca2+的变化,直接测定SR内Ca2+容量。用matlab 6.5软件处理图像,通过标准荧光强度的净变化来表示钙瞬变的强弱,即ΔF/F0= (F-F0)/F0(F0代表本底的荧光强度;F:代表某一时间点的荧光强度)。
1.5 测定蛋白的表达:提取大鼠心肌细胞膜蛋白,即取2组大鼠左心室肌组织(心衰组取梗死区部位)100 mg,剪碎心肌组织,置于离心管中,同时加入细胞裂解液和蛋白酶抑制剂,在高速匀浆器中将其打碎,离心5 min(4 ℃,4 000 r/min);然后吸取上清液,置于超速离心管中离心1 h(4 ℃,12 000 r/min),加适量的细胞裂解液在沉淀物中,测定其膜蛋白浓度(Bradford法)并将其保存于-80 ℃冰柜中备用。分别取2组样本25 μg,在沸水(95 ℃)中煮沸5 min,待温度下降后行SDS-PAGE电泳,然后电转移(110 V,60 min)置硝酸纤维膜上。膜封闭后分别用RyR antibody和Calstabin2 antibody(一抗)孵育,然后漂洗,用二抗孵育、漂洗后显色,随后曝光3 min。最终将胶片扫描至计算机行蛋白条带灰度分析,分别计算RyR2和Calstabin2蛋白半定量表达水平(RyR2/Actin,Calstabin2/Actin)。
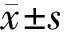
2 结果
2.1 2组大鼠心功能指标的比较:术后4周检测2组大鼠的心功能显示,心衰组大鼠LVEDP与假手术组相比明显升高(Plt;0.05),左心室压力最大上升速率(dp/dtmax)、最大下降速率(dp/dtmin)与假手术组相比显著下降(Plt;0.05),提示心衰组大鼠心室的收缩能力下降,符合慢性心衰标准,说明本次造模成功,见表1。
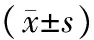
表1 2组大鼠心功能指标的检测
2.2 2组大鼠肌浆网内钙容量的检测:2组大鼠心肌细胞经Fluo-5N/AM孵育后,采用激光扫描共焦显微镜面扫描模式(xyz)记录单个心肌细胞SR内Ca2+容量。结果显示,心衰组大鼠单个心肌细胞Fluo-5N染色后荧光强度明显低于假手术组,且荧光强度变化的平均值(ΔF/F0)心衰组组(25.3±2.8,12个心肌细胞)较手术组(47.8±3.5,12个心肌细胞,Plt;0.05)显著降低,提示心衰组大鼠心肌细胞肌浆网内Ca2+容量低于假手术组。
2.3 RyR2和其调节蛋白Calstabin2的表达:采用免疫印迹技术测定2组大鼠心肌细胞SR钙离子释放通道雷尼丁受体(RyR2)及其调节蛋白FK506结合蛋白(Calstabin2)表达量的变化,结果显示RyR2的表达量心衰组与假手术组相比,差异无统计学意义(n=6,Pgt;0.05);Calstabin2的表达心衰组较假手术组明显下降(n=6,Plt;0.05),见图3(目录后)。
3 讨论
慢性心衰的发生是由于各种慢性心脏病变和长期心室前、后负荷过重,导致心室肌收缩力减弱,最终使得心搏出量减少,静脉淤血,不能满足机体代谢需要的一种心脏疾病。导致心衰的因素中,钙通道的状态以及钙离子调控异常是其发生的主要原因之一[6-9]。心肌细胞内Ca2+循环由Ca2+的释放和回摄两个部分组成,Ca2+通过心肌细胞T管上的L-型钙通道(DHPR)和肌浆网上的雷尼丁受体(RyR2)完成钙诱导钙释放(Ca2+induced Ca2+release,CICR)的全过程。我们之前的研究证明[10],慢性心衰大鼠心肌细胞L-型钙通道(DHPR)表达的降低将导致心肌细胞兴奋-收缩耦联过程异常,从而使得心肌的收缩功能受到影响。本实验在先前研究基础上进一步探讨慢性心衰大鼠心肌细胞SR钙离子释放通道RyR2及其调节蛋白Calstabin2的异常。
Fluo-5N/AM作为一种肌浆网Ca2+荧光探针,可直接用于测定SR内Ca2+容量。本实验结果显示,心衰组大鼠心肌细胞荧光强度比假手术组有明显下降,且心衰组ΔF/F0与假手术组相比也明显降低,说明心衰组大鼠心肌细胞SR内Ca2+容量低于假手术组,此结果可能导致心衰组大鼠在兴奋-收缩耦联过程中经RyR2 释放的Ca2+量减少,从而导致心肌收缩力降低。
RyR2是存在于心肌细胞肌浆网膜上的一种Ca2+释放通道,其功能主要是通过钙诱导钙释放的方式介导肌浆网内的Ca2+释放[11]。RyR2是同源四聚体细胞内钙离子释放通道大家族成员之一,其分子量大,贯穿于肌浆网膜并包含大量的N末端结构域。RyR2分子上包含很多调节蛋白,如钙调蛋白(Calmodulin,CaM)、FK506结合蛋白(Calstabin 2)、可溶抗药性相关钙结合蛋白(Sorcin)、集钙蛋白(calsequestrin)、蛋白激酶A(protein kinase A,PKA)等[12]。其中,FK506结合蛋白(Calstabin2)对RyR2通道功能的调节尤为重要。Calstabin2是一种顺反式肽基脯氨酰异构酶,在RyR2上的结合比例为4∶1。Calstabin2作为RyR2的调节蛋白,具有稳定RyR2通道关闭的功能。有研究表明[13],该基因敲除的小鼠存在着不同程度的Ca2+渗漏。本次研究表明,心衰组RyR2蛋白表达水平与假手术组相比无明显差异,但Calstabin2的表达水平心衰组与假手术组相比显著降低。由于Calstabin2的作用在于稳定雷尼丁通道的开放,心衰组Calstabin2表达量降低使得其对RyR2稳定性作用下降,导致RyR2在心脏舒张期也部分开放,造成异常的Ca2+泄漏,从而使得肌浆网内的Ca2+容量减少,最终导致心肌细胞SR兴奋-收缩耦联过程中的Ca2+释放减少,心肌收缩力降低,进而出现心力衰竭。鉴于RyR2的调节蛋白种类繁多,将在今后的实验中进一步探讨其他相关蛋白的分子机制。
总之,本实验结果表明,慢性心衰大鼠心肌细胞RyR2调节蛋白Calstabin2表达水平下调,使得RyR2在舒张期部分开放泄漏过多Ca2+,导致兴奋-收缩耦联过程中由RyR2释放的Ca2+减少,造成心肌收缩力降低,最终导致心衰。
[1] Pichette M,Liszkowski M,Ducharme A.Preoperative optimization of the heart failure patient undergoing cardiac surgery[J].Canadian Journal of Cardiology,2017,33(1):72-79.
[2] Koza Y.Treatment with enhanced external counterpulsation improves cognitive functions in chronic heart failure patients[J].Turk Kardiyoloji Dernegi Arsivi,2013,41(6):568.
[3] Ding Chunhua,Gepstein L,Nguyen DT,et al.High-Resolution optical mapping of ventricular tachycardia in rats with chronic myocardial infarction[J].Pacing and Clinical Electrophysiology,2010,33(6):687-695.
[4] Tanonaka K,Furuhama KI,Yoshida H,et al.Protective effect of heat shock protein 72 on contractile function in the perfused failing heart[J].American Journal of Physiology,2001,281:215-222.
[5] Ohmoto Sekine Y,Uemura H,Tamagawa M,et al.Inhibitory effects of aprindine on the delayed rectifier K+current and the muscarinic acetylcholine receptor-operated K+current in guinea-pig atrial cells[J].British Journal of Pharmacology,1999,126(3):751-761.
[6] Gorski PA,Ceholski DK,Hajjar RJ.Altered myocardial calcium cycling and energetics in heart Failure-A rational approach for disease treatment[J].Cell Metabolism,2015,21(2):183-194.
[7] Choi E,Cha MJ,Hwang KC.Roles of Calcium regulating MicroRNAs in cardiac Ischemia-Reperfusion injury[J].Cells,2014,3(3):899-913.
[8] Kalyanasundaram A,Lacombe VA,Belevych AE,et al.Up-regulation of sarcoplasmic reticulum Ca2+uptake leads to cardiac hypertrophy,contractile dysfunction and early mortality in mice deficient in CASQ2[J].Cardiovascular Research,2013,98(2):297-306.
[9] Rozentryt P,Niedziela JT,Hudzik B,et al.Abnormal serum Calcium levels are associated with clinical response to maximization of heart failure therapy[J].Polskie Archiwum Medycyny Wewnetrznej,2015,125(1/2):54-64.
[10] HU Shuting,SHEN Yafeng,LIU Guansheng,et al.Altered intracellular Ca2+regulation in chronic rat heart failure[J].The Journal of Physiological Sciences,2010,60(2):85-94.
[11] Rozentryt P,Niedziela JT,Hudzik B,et al.Abnormal serum calcium levels are associated with clinical response to maximization of heart failure therapy[J].Polskie Archiwum Medycyny Wewnetrznej,2015,125(1/2):54-64.
[12] Oda T,Yang Y,Uchinoumi H,et al.Oxidation of ryanodine receptor(RyR)and calmodulin enhance Ca2+release and pathologically alter,RyR structure and calmodulin affinity[J].Journal of Molecular and Cellular Cardiology,2015,85:240-248.
[13] Bito V,Biesmans L,Gellen B,et al.BFKBP12.6 overexpression does not protect against remodelling after myocardial infarction[J].Experimental Physiology,2013,98(1):134-148.
Abnormalintracellularryanodinereceptoranditsregulatoryproteincalstabin2inchronicratheartfailure
LIUMingming,NIUZhixin,ZHOUYongzhong,HUShuting.
PhysiologyDepartment,NingxiaMedicalUniversity,Yinchuan750004,China
Correspondingauthor:HUShuting,Email: hst7312@163.com
ObjectiveTo study abnormal intracellular ryanodine receptor and its regulatory protein Calstabin2 in chronic rat heart failure (HF).MethodsAdult male SD rats were randomized to divided into myocardial infarction (MI) group and sham operation group.We investigated the sarcoplasmic reticulum (SR) Ca2+content and assessed the expression of ryanodine receptor (RyR2) and Calstabin2 by using laser scanning confocal microscope and Western-blot.ResultsThere was a significant increase in the left ventricular end-diastolic pressure (LVEDP) in HF rats (8.91±2.16 mmHg,n=15) compared with sham rats (4.17±1.15 mmHg,n=10,Plt;0.05).There was a significant decrease in the maximal change of systolic pressure over time (dp/dtmax) in HF rats (2 250.19±172.44 mmHg/s,n=12) compared with control rats (4 822.54±221.62 mmHg/s,n=10,Plt;0.05). SR Ca2+content was dramatically reduced in HF myocytes(ΔF/F0=25.3±2.8,n=12) compared with sham myocytes (ΔF/F0=47.8±3.5,n=12,Plt;0.05).The expression of Calstabin2 was significantly reduced in HF rat compared with sham group.ConclusionStability decrease of RyR2 that due to down-regulation of Calstabin2 could contribute to HF.
Heartfailure;Sarcoplasmicreticulum;Ryanodinereceptor;Calstabin2
10.13621/j.1001-5949.2017.10.0865
R541.6
A
宁夏自然科学基金资助项目(NZ15082)
宁夏医科大学基础医学院生理学系,宁夏 银川 750004
刘明明(1986-)男,在读硕士研究生,主要从事心血管生理研究方向。
胡淑婷,Email:hst7312@163.com
http://kns.cnki.net/kcms/detail/64.1008.R.20171018.1102.020.html
2016-04-02责任编辑马兴忠
