饲料中16种霉菌毒素液相色谱-三重四级杆/线性离子阱串联质谱法的条件优化
2017-11-23符金华杨琳芬董泽民徐国茂姜文娟黄艳清李瑾瑾周仁丹
符金华, 杨琳芬*, 董泽民, 徐国茂, 姜文娟 , 邢 磊,黄艳清, 李瑾瑾, 周仁丹, 叶 金, 吴 宇, 廖 丰
(1.江西省兽药饲料监察所,江西南昌 330029;2.南昌大学分析测试中心,江西南昌 330047;3.国家粮食局科学研究院,北京西城,100037;4.双胞胎(集团)股份有限公司,江西南昌 330096)
饲料中16种霉菌毒素液相色谱-三重四级杆/线性离子阱串联质谱法的条件优化
符金华1, 杨琳芬1*, 董泽民1, 徐国茂1, 姜文娟1, 邢 磊1,黄艳清1, 李瑾瑾1, 周仁丹2, 叶 金3, 吴 宇3, 廖 丰4
(1.江西省兽药饲料监察所,江西南昌 330029;2.南昌大学分析测试中心,江西南昌 330047;3.国家粮食局科学研究院,北京西城,100037;4.双胞胎(集团)股份有限公司,江西南昌 330096)
本文优化并建立了饲料中16种霉菌毒素的多残留提取、净化及液相色谱-三重四级杆/线性离子阱串联质谱(Qtrap-LC-MS/MS)的检测方法。 样品经 20 mL 乙腈/水/乙酸(V∶V∶V,70∶29∶1)溶液提取、稀释和上机检测。 采用 0.1%甲酸的1 mmol/L NH4Ac的水相作为弱洗脱流动相梯度洗脱程序,离子源温度为500℃,采用分段MRM扫描模式,100 ms的驻留时间,16种霉菌毒素分离理想、基线平稳、选择离子信号强度高、干扰离子信号弱;同时,得到了与理论计算值非常接近的所有选择离子精确质量数。完成了16种毒素的Qtrap-LC-MS/MS方法条件优化,成功的实现饲料中16种霉菌毒素的快速定性、定量分析。
霉菌毒素;液相色谱-三重四级杆/线性离子阱串联质谱法;同位素内标;优化
霉菌毒素是产毒真菌在一定环境条件下产生的次级代谢产物,可导致人类和动物急慢性中毒,具有致癌、致畸、致突变作用(朱聪英等,2010)。研究表明,饲料及其原料易被各种霉菌毒素污染(Binder等,2007),从而降低饲料的口感与质量,甚至导致动物中毒,给畜牧业发展和畜产品安全造成极大的危害,更为严重的是部分毒素可进入食物链威胁人类健康。其中,对动物生产影响较大的主要有黄曲霉毒素、呕吐毒素、T-2毒素和玉米赤霉烯酮等(Marin 等,2013;郑翠梅等,2012)。
然而,饲料中毒素的含量很低,且基质干扰严重,这对霉菌毒素进行准确快速定性和定量的检测方法是巨大的挑战。目前,有关霉菌毒素的检测方法主要有薄层色谱法 (TLC)、酶联免疫法(ELISA)、高效液相色谱法(HPLC)及气相色谱串联质谱(GC-MS)等(朱聪英等,2010;魏丽莉等,2008;Chiar等,2007;鲍蕾等,2005)。 在一定程度上,这些方法能够满足目前部分毒素的检测,但也存在诸多问题,如TLC法的稳定性和重复性差,易受外界环境的干扰;ELISA法通常作为筛选方法,不能准确定量,且易出现假阳性;HPLC法容易受到基质干扰,且部分毒素的检测限达不到限量标准要求;GC-MS法的操作步骤繁琐,衍生化的效率低等。另外,在实际的饲料样品中霉菌毒素污染通常是多种霉菌毒素同时污染(Monbaliu等,2009),而这些方法只能对一种或结构类似的毒素进行检测。
因此,开发同时检测饲料中常见的多种霉菌毒素方法具有十分重要的现实意义。高效液相色谱-串联质谱(HPLC-MS/MS)是一种集高效分离和多组分同时定性、定量于一体的检测技术,具有较强抗基体干扰、高通量、高选择性、高灵敏度等优势,成为近年来痕量检测中发展非常快的新技术之一 (Markus 等,2012;Johannes 等,2012;Mira 等,2010;Micheal等,2009), 目前大多数HPLC-MS/MS法应用需要专用的前处理设备和成本较高的免疫亲和柱,提取净化步骤较为繁琐,而且同时检测霉菌毒素的种类仍然比较窄(Shephard 等,2012;郑翠梅等,2012;赵孔祥等,2011;应永飞等,2010)。本研究旨在建立一种饲料及原料样品经简单的提取、稀释和加内标后直接上机,不需要过多功能净化柱及脱脂等操作,实现一次前处理和一针进样,同时测定16种霉菌毒素的Qtrap-LC-MS/MS检测方法,并对检测条件进行优化。
1 材料与方法
1.1 仪器和试剂 质谱型号为Sciex4500 Qtrap(美国Sciex公司);液相为岛津LC-20AD XR(日本Shimadzu公司);赫西离心机(中国湖南赫西仪器装备有限公司);HY-3多功能振荡器(中国江苏光都机电设备有限公司);Milli-Q超纯水纯化系统(美国 Millipore 公司);METTLER TOLEDO ME104分析天平[中国梅特勒-托利多(上海)有限公司]。
雪腐镰刀菌烯醇(NIV)、脱氧雪腐镰刀菌烯醇(DON)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-Ac-DON)、15-乙酰基脱氧雪腐镰刀菌烯醇 (15-Ac-DON)、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(DON-3G)、T-2 毒素(T-2)、HT-2 毒素(HT-2)、玉米赤霉烯酮(ZEN)、赭曲霉毒素 A(OTA)、伏马毒素 B1(FB1)、伏马毒素 B2(FB2)、杂色曲霉毒素(ST)标准溶液(浓度为 0.2~20 μg/mL,Romer公司);黄曲霉毒素 B1(AFB1)、黄曲霉毒素 B2(AFB2)、黄曲霉毒素 G1(AFG1)、黄曲霉毒素 G2(AFG2)标准溶液(浓度为 0.03~1 μg/mL,Sigma-Aldrich 公司);13C 标记的黄曲霉毒素(B1、B2、G1、G2)、脱氧雪腐镰刀菌烯醇、雪腐镰刀菌烯醇、3-乙酰基脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A、伏马毒素(B1、B2)、T-2 毒素、HT-2 毒素、杂色曲霉毒素的14种稳定同位素标准溶液(浓度为0.01~2.5 μg/mL,Romer公司);甲醇、乙腈(HPLC 级,Fisher公司);乙酸铵、甲酸、乙酸(HPLC 级,美国Sigma 公司);0.2 μm PTFE 膜针头过滤器(PALL公司);实验用水为Milli-Q超纯水。
1.2 试验方法
1.2.1 液相色谱条件 Waters公司CORTECSTM UPLC C18柱 (100 mm × 2.1 mm,1.6 μm); 柱温40℃;进样量2 μL。流动相A为甲醇,B为含0.1%(体积分数)的甲酸和1 mmol/L乙酸铵的水溶液,流速:0.3 mL/min。梯度洗脱。
1.2.2 质谱条件 加热电喷雾离子源 (HESI)温度为500℃;毛细管电压为3.2 kV;离子传输管温度为320℃;鞘气为35 unit,辅助气为10 unit。fullscan/ddms2扫描模式:采集范围为200~800Da,正离子采集;一级质谱分辨率为70000 FWHM,二级质谱分辨率为17500 FWHM;碰撞池能量(NCE)为 35 eV。
1.2.3 标准溶液配制 分别移取一定体积的16种霉菌毒素标准溶液于10 mL容量瓶中,用水定容至刻度,得到16种霉菌毒素的混标储备液,于-20℃保存,浓度详见表1。
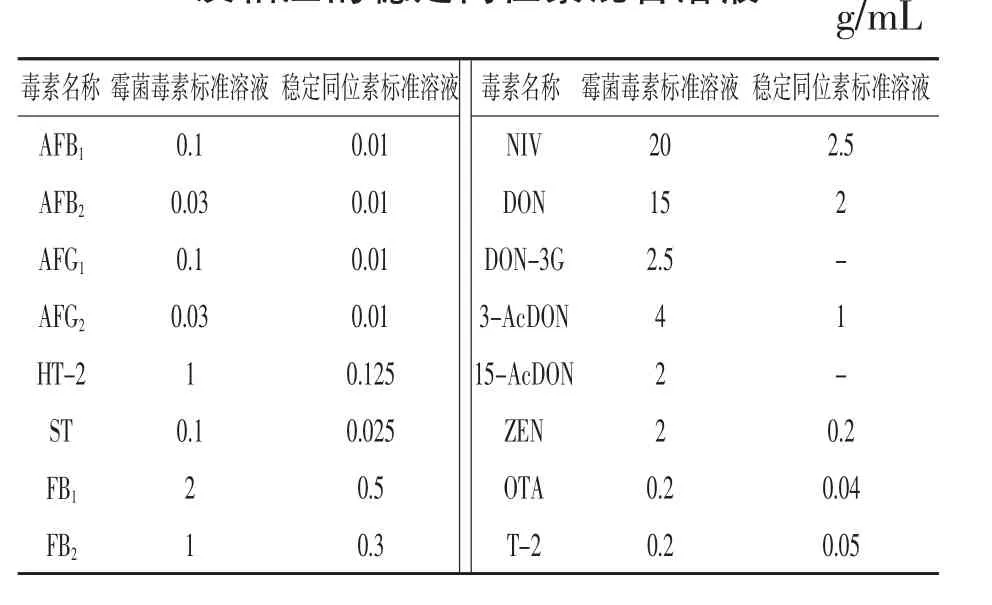
表1 霉菌毒素混合标准储备液的浓度及相应的稳定同位素混合溶液
稳定同位素内标混合工作液:根据表1相应的稳定同位素混合溶液的浓度,分别移取一定体积的14种霉菌毒素稳定同位素单标溶液于4 mL储液瓶中,用水稀释至2 mL配制稳定同位素混合标准溶液,充分混匀后于-20℃避光保存。准确移取混合标准中间液适量,用乙腈-水-乙酸溶液(35∶64.5∶0.5)逐级稀释,配制成不同浓度系列的混合标准工作液。向400 μL内插管中加入20 μL 14种稳定同位素混合工作液,再分别吸取180 μL系列标准工作液于内插管中,涡旋混匀后准备上机检测。
1.2.4 样品前处理方法 称取饲料样品(5±0.1)g于50 mL离心管中,准确加入20 mL乙腈/水/乙酸(V∶V∶V,70∶29∶1)提取溶剂,涡旋 2 min,振荡30 min,以4000 r/min离心10 min使固液分离。准确转移0.5 mL上清液于1.5 mL离心管中,加入0.5 mL水稀释,涡旋混匀1 min,然后以12000 r/min离心10 min,取上清液用0.22 μm的PTFE滤膜过滤,吸取20 μL预先涡旋混匀的稳定同位素混合溶液于400 μL内插管中,再加入180 μL的样品滤液,混合后待测。
2 结果与讨论
2.1 提取溶剂的选择 本研究选择的16种霉菌毒素目标物涵盖了我国食品安全限量标准规定,及欧盟已制定限量法规的霉菌毒素及其相关的衍生物。由于霉菌毒素的理化性质相差较大,需要选择合适的提取液和提取程序,否则容易造成毒素的损失。研究表明,霉菌毒素的提取溶剂常采用甲醇、乙腈等(薛毅等,2016;王瑞国等,2015;应永飞等,2010)。本研究中鉴于16种毒素的极性,探究了甲醇、乙腈、纯水、甲醇水和乙腈水的提取效率,结果见图1。由图1可见,可能与呕吐毒素的水溶性较好有关,纯水对12种毒素的提取效率比较低,均低于 55%,DON、DON-3G、3-AcDON、15-AcDON能够达到82%以上;纯乙腈和甲醇对12种组分的提取效率为71%~95%,而DON、DON-3G、3-AcDON、15-AcDON 的 提 取 效 率 均 低 于51%,甲醇水对16种毒素的提取效率均高于88%;而乙腈水对16种毒素的提取效率均高于90%,效果比甲醇水好。综上所述,最终选择乙腈水作为提取溶剂。
2.2 提取方式的选择 一般在霉菌毒素的检测中,前处理相对比较繁杂,占据了样品检测周期的大部分时间,从而使得检测效率不高。同时,在繁杂的前处理净化过程中,极易造成目标物的损失,导致检测结果的误差。研究表明。MycoSep 226多功能净化柱会吸附FBs、DON糖苷化衍生物和OTA等毒素,导致回收率降低(郑翠梅等,2012)。然而,近年来随着质谱仪器抗干扰能力及灵敏度的不断提升,直接提取稀释法越来越多的被应用。图2为直接提取稀释法与商品化的多毒素净化填料(MycoSpin 400)净化方法对16种目标毒素的回收率,MycoSpin 400前处理方法按照其产品说明书进行。结果显示,MycoSpin 400对DON-3G、FB1、FB2及OTA 4种霉菌毒素的回收率不高,主要原因是填料对这4种毒素有一定的吸附性而导致损失,影响定量结果的准确性。而直接提取稀释法则可以有效避免该过程中目标物的损失,16种毒素的回收率为91%~103%。同时,毒素的多功能净化柱选择性单一,且价格昂贵。因此,直接提取稀释法凭借处理过程简单、快捷和成本低廉而更适合于多种霉菌毒素的快检前处理。
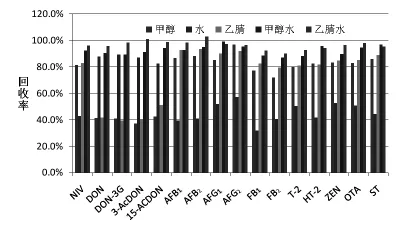
图1 不同的提取液对于目标毒素回收率(n=3)结果
2.3 检测条件的优化
2.3.1 流动相的优化 对比含不同比例盐和酸的弱洗脱流动相对16种霉菌毒素质谱响应的影响,结果见表2,以水为流动相时,大部分的离子响应不高,加盐后大多数毒素的响应明显提高,其中乙酸铵的增强效果比甲酸铵明显,同时低浓度(1 mmol/L)盐比高浓度(2 mmol/L 及 5 mmol/L)盐的响应信号更强。而FB1和FB2需要在0.1%甲酸存在时才有明显的质谱响应,因此,最终选择含有0.1%甲酸的1 mmol/L NH4Ac的水相作为弱洗脱流动相,洗脱程序见表3。
2.3.2 离子源温度的优化 图3为离子源温度
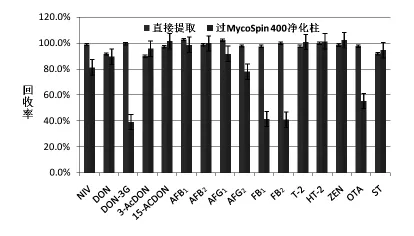
图2 直接提取稀释方法与商品化的多毒素净化方法(MycoSpin 400)对于目标毒素回收率(n=3)结果
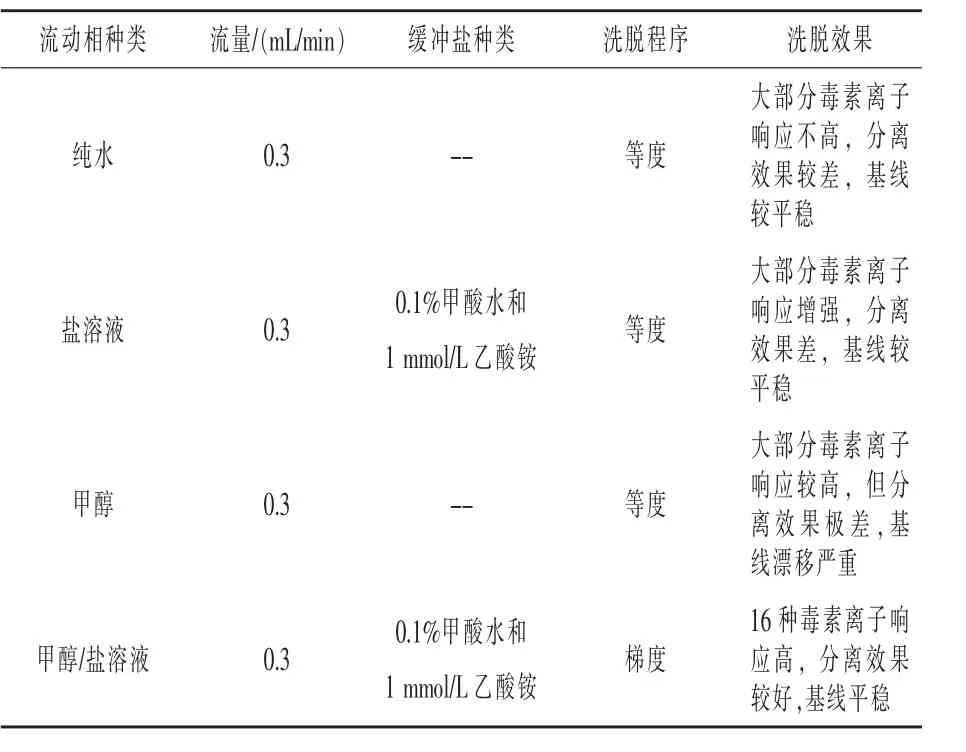
表2 不同流动相对16种霉菌毒素混合标准的洗脱效果影响
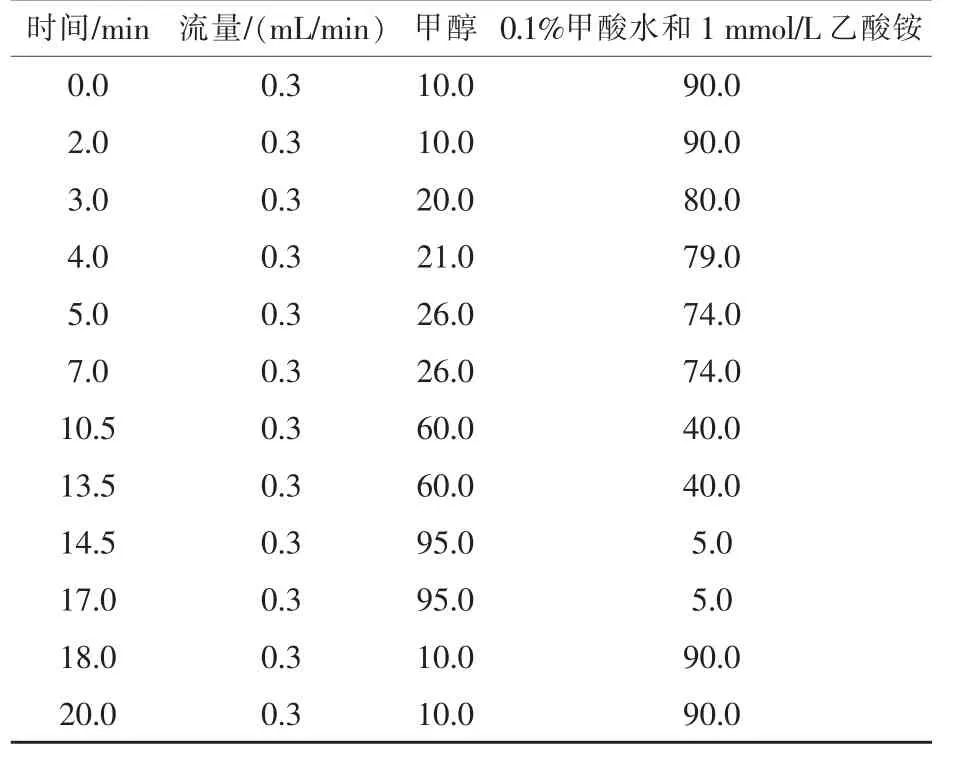
表3 流动相梯度洗脱条件
450~550°C全扫描采集到的16种霉菌毒素混标的TIC图。由图3可知,16组分的信号随着源温度升高其响应值会升高,直至500℃时响应值达到最大。继续升温至550℃时,信号强度没有太大的变化,甚至部分毒素(DON、DON-3G等)的信号强度下降了。此外,一些难裂解的或结构稳定的化合物在太高的离子源温度条件下会失去一些高质量的碎片离子。同时,高离子源温度还可能使柱流失增强而导致基线增高。因此,综合考虑16种毒素的高质量离子信号强度,低的干扰离子信号及理想的峰形等因素,最佳的离子源温度为500℃。

图3 离子源温度450~550°C全扫描采集到的16种霉菌毒素混标的TIC图
2.3.3 扫描模式的选择 质谱仪的一般扫描模式有全扫描(Full Scan)、选择离子扫描(SIM)、子离子扫描 (Product Scan)、 母离子扫描(Precursor Scan)、中性碎片丢失扫描(Neutral Loss)和多反应扫描(MRM)等模式。本文探究了以上几种扫描模式条件下的16种毒素的扫描结果,发现只有在MRM模式下,得到的总离子图中,16种毒素信号强度高、不会丢失部分信号及离子峰形匀称饱满。同时,比较了普通的MRM扫描模式和增强分段MRM扫描模式的效果,发现后者的噪音干扰更低,灵敏度较高。因此采用分段MRM扫描模式。
2.3.4 驻留时间的优化 在质谱的扫描过程中,驻留时间的长短会影响信号的点数,从而关系到所得到碎片离子的信息完整性,离子峰形对称及基线噪声干扰的大小。对于多组分同时测定时,如果驻留时间过长,会导致质谱采集点数不够,质谱信息量降低,造成部分碎片离子信号的丢失,重现性降低,且得到的色谱峰峰形较差。如果驻留时间太短,会导致杂质干扰信号比较大,灵敏度降低,从而不能对样品中痕量目标物的精确定量。因此,采取合适的驻留时间至关重要。本文探究了16种毒素分别在驻留时间为200、100 ms和50 ms的情况,由图4可知,16种毒素在100 ms时的离子信息完全,噪音干扰低,灵敏度较高。因此,最佳的驻留时间为100 ms。
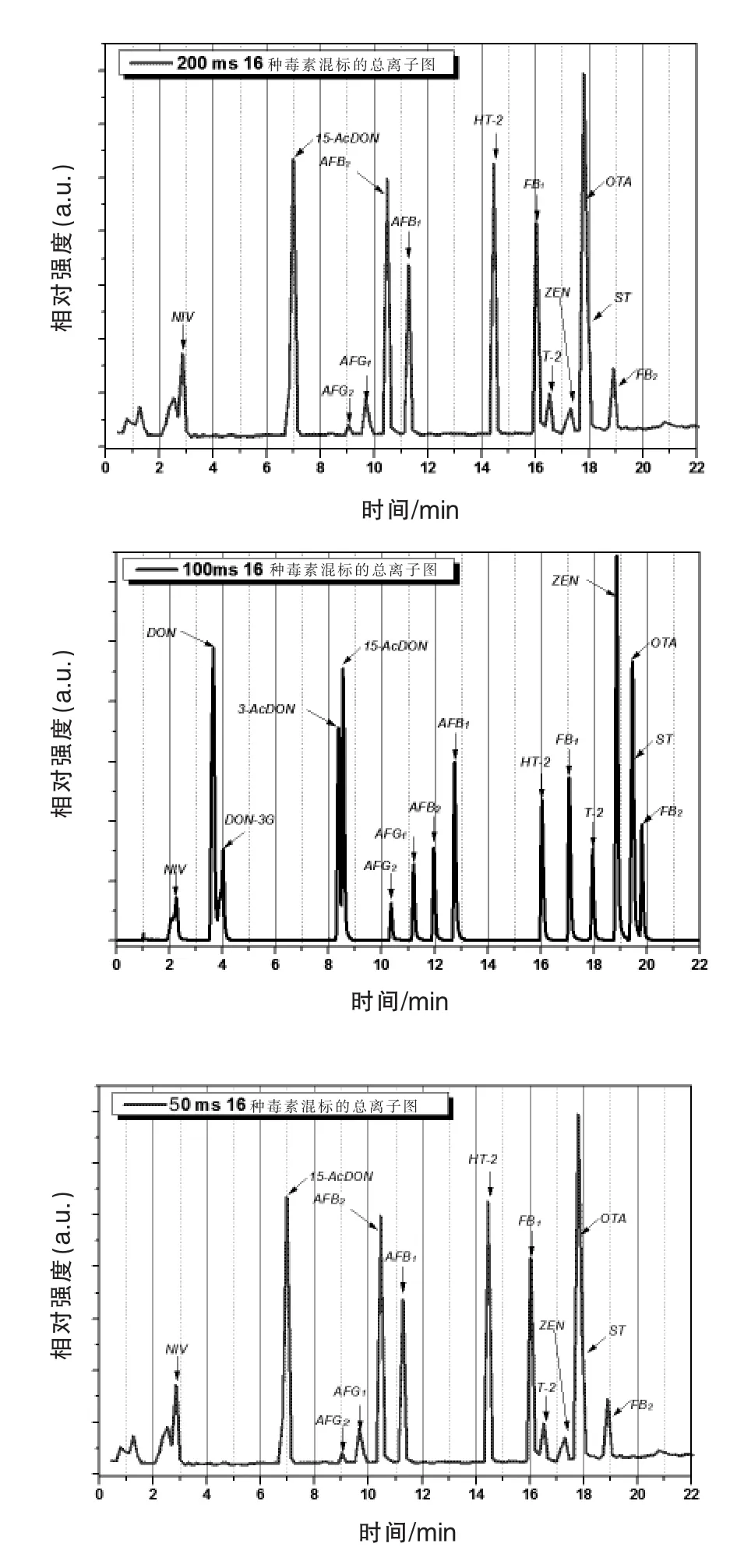
图4 驻留时间为200、100 ms和50 ms全扫描采集到的16种霉菌毒素混标的TIC图
2.4 标准进样 按照上述优化的各项条件,对16种霉菌毒素的系列混合标准溶液进行上机分析,以稳定同位素稀释法进行定量,相关结果见表4。结果表明,16种毒素标准品能够有效分离,得到精确保留时间。同时,得到了所有的选择离子精确质量,质量数与理论计算值非常接近。因此,16种毒素的HPLC/MS/MS方法条件优化完成,可以满足实际应用于样品的日常检测。
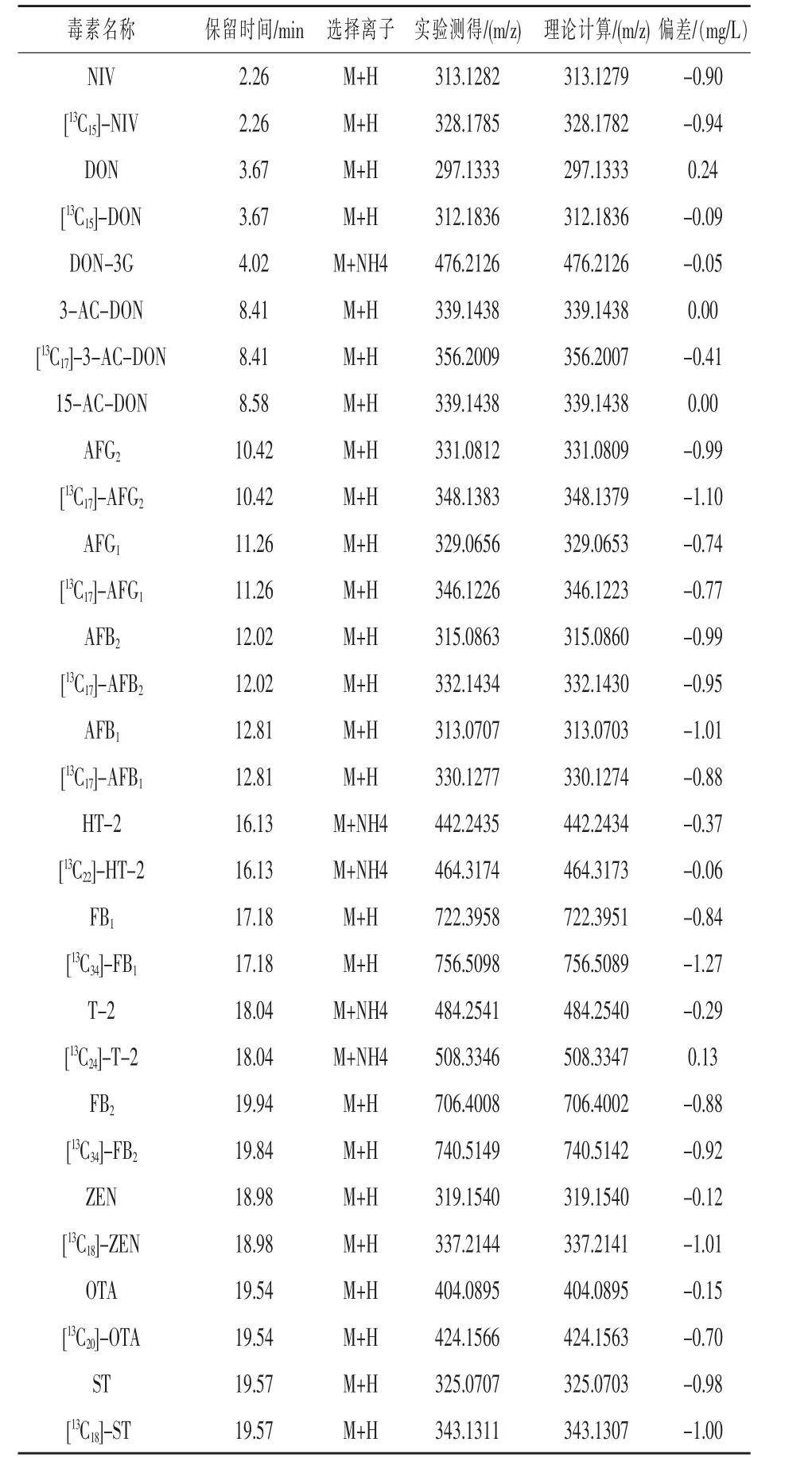
表4 相关毒素的保留时间和选择离子的精确分子质量
3 结论
本文优化了饲料中常见16种霉菌毒素的提取、净化及高效液相色谱-三重四级杆/离子阱质谱分析条件。得到了16种霉菌毒素的精确保留时间和选择离子的精确质量数,成功实现了16种霉菌毒素的同时快速定性和定量分析。该方法前处理简单、快速、准确度高,可满足饲料中常见霉菌毒素的残留检测分析要求。
[1]鲍蕾,刘心同,张艺兵,等.多功能柱净化高效液相色谱法检测花生中的黄曲霉毒素[J].检验检疫科学,2005,15(5):23 ~ 25.
[2]魏丽莉.黄曲霉毒素对食品的污染及防治措施[J].粮油加工,2008,9:86~89.
[3]王瑞国,苏晓鸥,程芳芳,等.维液相色谱-串联质谱法测定饲料原料中26 种霉菌毒素[J].分析化学研究报告,2015,43(2):264 ~ 270.
[4]薛毅,张玥,吴银良.液相色谱-串联质谱法同时测定饲料中17种霉菌毒素[J].饲料加工与检测[J],2016,52(19):90 ~ 94.
[5]应永飞,朱聪英,韦敏珏,等.液相色谱-串联质谱法测定饲料中14种霉菌毒素及其类似物[J].分析化学,2010,38(12):1759 ~ 1764.
[6]朱聪英,应永飞,韦敏钰,等.液相色谱-串联质谱法测定饲料中黄曲霉毒素的研究[J].质谱学报,2010,31(4):240 ~ 246.
[7]郑翠梅,张艳,王雪松,等.液相色谱-质谱联用同时检测粮食中多种真菌毒素的应用进展[J].粮食科技与经济,2012,37(1):45 ~ 49.
[8]中华人民共和国卫生部.GB 2761-2011[S].食品中真菌毒素限量.北京:中国标准出版社,2011-10-20.
[9]中华人民共和国国家质量监督检验检疫总局.GB 13078-2001[S].饲料卫生标准.北京:中国标准出版社,2001-10-01.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 13078.2-2006[S].饲料卫生标准—饲料中赭曲霉毒素 A和玉米赤霉烯酮的允许量.北京:中国标准出版社,2006-07-01.
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 13078.3-2007[S].配合饲料中脱氧雪腐镰刀菌烯醇的允许量.北京:中国标准出版社,2007-03-01.
[12]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 21693-2008[S].配合饲料中T-2毒素的允许量.北京:中国标准出版社,2008-07-01.
[13]赵孔祥,葛宝坤,陈旭艳,等.在线免疫亲和柱-液相色谱-串联质谱快速测定中药及中药中10中真菌毒素 [J].分析化学,2011,39(9):1341~1346.
[14]郑翠梅,张 艳,王松雪,等.液相色谱-串联质谱法测定小麦中 T-2、ZEN 及 DON3种镰刀菌毒素[J].分析测试学报,2012,31(4):383~ 389.
[15]Binder E M,Tan L M,Chin L J,et al.Worldwide occurrence of mycotoxins in commodities,feeds and feed ingredients[J].J Anim.Feed Sci.Technol.2007,137( 3):265 ~ 282.
[16]Chiar A C,Patrizia F.Determination of aflatoxins in olive oil by liquid chromatography-tandem mass spectrometry[J].J Analytica Chimica Acta,2007,596 (1):141 ~ 148.
[17]Johannes M W,Van D O,Ido P K.The role of liquid chromatographytandem mass spectrometry in the clinical laboratory [J].J Chromatogr B.2012,883(884):18 ~ 32.
[18]Monbaliu S,van Poucke C,Detavernier C,et al.Occurrence of mycotoxins in feed as analyzed by a multi-mycotoxin LC-MS/MS Method[J].J Agr Food Chem,2009,58(1):66 ~ 71.
[19]Marin S,Ramos A,Cano-Sancho G,et al.Mycotoxins:occurrence,toxicology,and exposure assessment[J].J Food Chem Toxicol,2013,60:218 ~ 237.
[20]Mira P,Marinella F,Miren A L,et al.Recent trends in the liquid chromatography mass spectrometry analysis of?organic contaminants in environmental samples[J].J Chromatogr A,2010,1217(25):4004 ~ 4017.
[21]Markus H.10 years of MS instrumental developments--impact on LCMS/MS in clinical chemistry[J].J Chromatogr B,2012,3:883(884):3 ~ 17.
[22]Micheal J,Riordan O,Martin G,et al.Comparison of analyticalmethods for aflatoxin determination in commercial chilli spicepreparations and subsequent development of an improved method[J].Food Control,2009,20(8):700~705.
[23]Shephard G S,Berthiller F,Burdaspal P A,et al.Developments in mycotoxin analysis:an update for 2011-2012[J].J World Mycotoxin,2012,5(1):3 ~ 30.■
The residue extraction,purification and liquid chromatography-triple level 4 bar/linear ion trap tandem mass spectrometry(Qtrap-LC-MS/MS) detection method of 16 kinds of mycotoxins in feed were optimized and established in this paper.Mycotoxins were extracted by 20 mL of acetonitrile/water/acetic acid (V∶V∶V,70∶29∶1) solution,diluted and detected.The gradient elution procedure was used with 0.1%formic acid and 1 mmol/L NH4Ac as weak elution mobile phase.The ion source temperature was 500 ℃ and dwell time was 100 ms,using segmented MRM scan mode.Mycotoxins were well separated with smooth baseline,high select ion signal intensity and the weak signal interference.All select ion mass numbers of mycotoxins were also obtained,which was very close to the theoretical calculation value.The optimization conditions for Qtrap-LC-MS/MS method of mycotoxins were found.It realized both qualitative and quantitative analysis of 16 kinds of mycotoxins in feed.
mycotoxin;qtrap-LC-MS/MS;isotope internal standard;optimization
S816.17
A
1004-3314(2017)21-0025-06
10.15906/j.cnki.cn11-2975/s.20172106
江西省重点研发计划项目(20161BBF60115)
*通讯作者
