基因组改组快速提高日本小球藻脂肪产量
2017-11-21,,,,,,,
, ,,,, ,,
(广西民族大学海洋与生物技术学院/广西多糖材料与改性重点实验室培育基地,广西南宁 530007)
基因组改组快速提高日本小球藻脂肪产量
刘红全,袁莎,卢恩秋,潘艺华,杨海燕,龙寒,禤金彩,何秀苗
(广西民族大学海洋与生物技术学院/广西多糖材料与改性重点实验室培育基地,广西南宁 530007)
以日本小球藻为出发藻株,经过紫外线和甲基磺酸乙酯分别诱变处理,获得4株总脂产量有所提高的突变株。以聚乙二醇作为融合剂,对获得的突变株进行两轮递归式原生质体融合,筛选到遗传稳定的改组藻株F2C2,其总脂含量为59.01%,较原始藻株提高了101.4%。对日本小球藻的原始藻株和改组藻株F2C2的油脂含量进行分析,结果表明改组前后日本小球藻的总脂组成成分没有变化,但各组分含量有较大差别。
基因组改组,总脂含量,日本小球藻
随着全球经济发展以及人口的快速增长,为降低化石能源资源的消耗,减少对环境的损害,寻求可再生的环境友好型能源已成为当务之急[1]。微藻由于其细胞结构简单、繁殖速率快、含油量高等特性,是生产生物乙醇的理想原料,成为第三代生物能源的典型代表。开发微藻生物乙醇具有广阔的发展前景[2]。目前,限制微藻油脂产业化的主要障碍是成本较高,养殖效率远低于理论预期。其根本原因是现有藻种无法满足生产的需要,现有的种子一般是直接从野生环境中筛选出来,最多进行了初步的驯化改良,其农艺性状远不能满足大规模养殖的需要,生产性栽培需要高密度,高光效,高含油量,高抗病,高抗虫,对环境温度、pH、盐浓度的变化也要有较强的适应性的品种,才能高产稳产,提高产出。因此,培育高产稳产优质的新品种是微藻产业化的关键。
基因组改组技术是一种新的体内分子育种方法,利用递进式遗传重组模拟了微生物自然进化过程,通过多亲本之间的全基因组的融合重组,将优良性状组合在一起,能在短时间内大幅度提高微生物细胞的表型,是近来极受关注的育种新技术。虽然基因组改组技术的育种效果显著,并且已有一些成功应用的实例[3-5],但利用基因组改组技术对微藻进行定向改造,目前尚未见报道。本文利用基因组改组技术对富含油脂的日本小球藻进行选育,进一步提高其油脂产率,为小球藻油脂工业化生产奠定基础。
1 材料与方法
1.1材料与仪器
日本小球藻(Chlorellahirataii) 购自上海光语公司,将微藻按照10%的接种量培养于含250 mL的F/2培养基的500 mL三角瓶中培养。人工气候箱的培养条件为光照强度3500 lux,暗光周期为12 h/12 h,培养温度为(24±1) ℃,每日摇动3~4次;甲基磺酸乙酯(EMS)、半纤维素酶(0.3~3.0 U/mg),果胶酶(400~800 U/g) 美国Sigma公司;纤维素酶(≥0.3 U/mg) Solarbio公司;其他试剂 国产分析纯;再生培养基:新鲜的F/2海水培养基中添加0.2 mol/L甘露醇,固体培养基另加0.8%~1.0%的琼脂。
ZHJH-C1112B超净工作台 上海智诚分析仪器公司;BG-01超声水浴锅 广州邦活超声波设备公司;HZ300L恒温水浴锅 武汉瑞华仪器设备公司;HPLC,Agilent 1100,Agilent;CX21FS1双目生物显微镜 日本奥利巴斯;MICR017冷冻离心机 美国赛默飞世尔公司;Bx51倒置荧光显微镜 奥林巴斯。
1.2实验方法
1.2.1 藻种的诱变 紫外诱变:取对数生长期的藻液6 mL(细胞密度约为7.8×106个/mL)置于9 cm培养皿底部铺一薄层,在距离紫外灯光源40 cm距离下,用20 W的紫外灯照射21 min。诱变结束后,避光培养12 h后正常培养3 d。将藻液用新鲜培养基稀释至10000个/mL藻细胞后涂布于培养基上,置于人工气候箱中培养。
EMS诱变:取10 mL对数生长期的藻液,4000 r/min下离心10 min,收集藻细胞,加入0.6%的EMS溶液,悬浮至10 mL。30 min后加入1 mL 5%硫代硫酸钠溶液终止诱变,离心去除诱变液,去离子水冲洗一次之后用新鲜培养液洗涤两次,置于暗环境中培养12 h后用新鲜的培养基稀释至10000个/mL藻细胞后涂布于培养基上,置于人工气候箱中培养。
1.2.2 筛选方法 初筛:用正己烷将尼罗红粉末配制成0.5 mg/mL的尼罗红染色液,再用20%DMSO将尼罗红母液稀释为0.5 μg/mL,过滤除菌。待平板上长出均匀的微藻藻落时,用1 μg/L的尼罗红喷染,暗培养24 h后在荧光显微镜下观察藻类染色情况,挑取荧光强度大的单藻落接种到含有2 mL F/2培养基的玻璃试管中,扩大培养。
复筛:将初步筛选结果中的产脂较好的微藻按照10%的接种量扩大培养于含250 mL的培养基的500 mL三角锥形瓶中培养,待到指数生长末期采用8000 r/min,10 min离心收集微藻,-20 ℃预冷冻8 h,冷冻干燥10 h,采用Blight和Dyer[2]方法提取总脂肪酸。
1.2.3 原生质体的制备 取对数生长期的日本小球藻8000 r/min离心10 min,用灭过菌的去离子水洗2~4次,以保证细胞表面无盐离子和其他杂质影响原生质体的制备。用无菌PBS悬浮细胞并将藻细胞调整至2×107cells/mL。加入终浓度为2%的半纤维素酶,2%纤维素酶与2%果胶酶,对日本小球藻作用时间为8 h,离心后备用。
1.2.4 原生质体再生与融合 原生质体再生与融合以及再生率的计算参考文献[6]。
1.2.5 基因组改组 以突变株作为基因组改组的第一轮藻株,制备原生质体并进行原生质体融合。融合后的藻液进行稀释后涂布于再生培养基平板上,待长出藻落后进行初筛和复筛,所得油脂含量提高的藻株作为下一轮基因组改组的亲本。
1.2.6 遗传稳定性检测 将筛选得到的改组藻株中连续转接6代,比较第一代与第六代的总脂含量,观察是否能够稳定遗传。
1.2.7 油脂产量以及生物量的测定 将初步筛选结果中的产脂较好的微藻按照10%的接种量扩大培养于含250 mL的培养基的500 mL三角锥形瓶中培养,测定其OD680 nm值。其比生长速率按照以下公式[7]进行计算:
μ=ln(Nt/No)/(Tt-To)
式中,Nt:为稳定期悬浮藻液OD值,No:为接种第2 d悬浮藻液OD值,Tt:为进入稳定期时间,To:为接种第2 d的时间,倍增时间:Dt=0.6931/μ。
对拟微绿球藻和日本小球藻筛选出来的高产GS藻株和原始藻株进行培养,在指数末期收集藻粉用冷冻装置干燥。将脂肪酸进行甲酯化处理,气相色谱条件为参考[8]稍作改进:载气为体积分数为高纯度氮气;柱初温72 ℃,保温1 min,以30 ℃/min升温速率升至150 ℃,保持5 min,以10 ℃/min升温速率升至250 ℃,保温5 min;进样口温度280 ℃,流速为30 mL/min,进样量1 μL。
2 结果与分析
2.1候选藻库的构建
尼罗红作为一种亲脂类荧光染料,与脂类物质结合后在荧光照射后能发出红色或者橙色荧光。通过测定尼罗红染色后的荧光强度能判断其细胞中的油脂含量。将藻液进行尼罗红染色,观察细胞中的荧光强度及油脂数量、大小,从而筛选出优势藻株。
如图1所示,根据分析结果,经过紫外诱变和EMS诱变共筛选出9株正向突变的诱变藻株,经过遗传稳定性分析,UC38、EC09、EC24和EC74这4株日本小球藻突变株第一代与第六代的总脂变化含量不显著(p>0.05),相较于出发藻株,分别提高了29.32%、26.16%、53.67%、34.01%。遗传稳定性良好。因此选择UC38、EC09、EC24和EC74这4株藻株作为日本小球藻基因组改组的出发藻株。

图1 日本小球藻高产诱变株遗传稳定性考察Fig.1 Genetic stability of the high-liquid mutants of Chlorella hirataii
2.2融合子筛选及遗传稳定性分析
以候选藻库中的4株藻株为出发藻株,进行第一轮改组。得到油脂含量进一步提高的藻株:F1C1、F1C2、F1C3、F1C4、F1C5。五株融合株的总脂含量分别为53.02%、49.34%、51.33%、45.72%、50.00%。经遗传稳定性检测,日本小球藻第一轮融合藻株F1C2、F1C4和F1C5的遗传稳定性良好,而F1C1和F1C5可能是异核子,在多次传代过后会分离成亲本类型,其优良性状也会消失(图2)。

图2 日本小球藻第一轮改组筛选结果Fig.2 Genetic stability of the first shuffled strains with high total liquids
以第一轮改组获得的3株菌株为出发藻株进行第二轮基因组改组,结果获得6株总脂产量有所提高藻株F2C1、F2C2、F2C3、F2C4、F2C5和F2C6。
将日本小球藻的第二轮改组之后的藻株进行连续传代培养,在指数生长期末期离心提取总脂肪含量,检测其遗传稳定性。
由图3可知,日本小球藻第二轮融合藻株F2C2的遗传稳定性良好,第一代与第六代的油脂含量无明显差异(p>0.05),其油脂最终含量达到59.01%,较原始菌株提高了101.4%;其他5株藻株性状表现不够稳定,第一代与第六代的油脂含量差异显著(p<0.05),多次传代后,其优良性状逐渐丧失。

图3 日本小球藻第二轮高产优质藻株遗传稳定性分析Fig.3 Genetic stability of the second shuffled strains with high total liquids
2.3改组藻株和原始藻株的生长特性以及生物量
由图4可以看出,日本小球藻的改组藻株与出发藻株的生长曲线基本相似。从这几株微藻的生长曲线可以看出,日本小球藻在接种后没有适应期。F2C2的生长速率和出发藻株相差不大。在1~6 d出发藻株的生长速率要大于改组藻株F2C2,在这之后F2C2的生长速率就快于出发藻株。
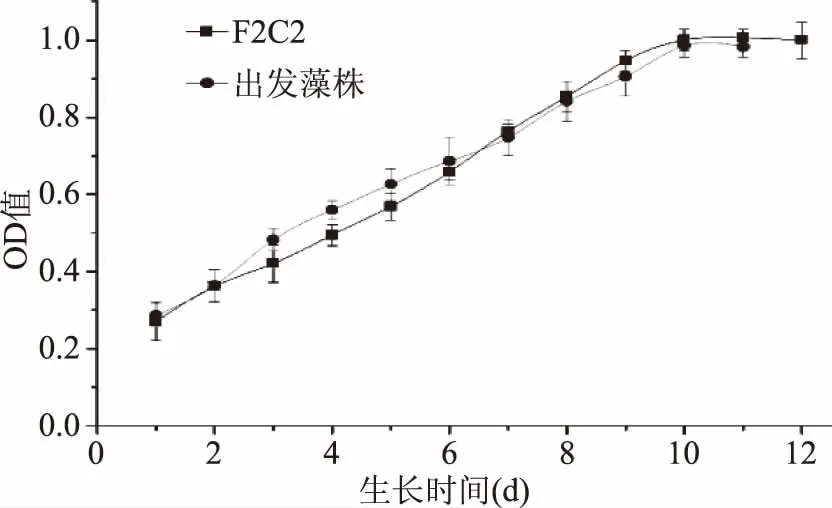
图4 日本小球藻改组和原始藻株的生长曲线测定Fig.4 The Chlorella hirataii’s growth curve of GS strains
由图5和图6结果可以看出,全面地评价微藻藻株的产油潜力,不仅需要看总脂含量或生物量干重来判断,同时需要引入单位体积总脂含量和单位体积总脂产率2个指标,通过综合比较、分析,筛选出优良的高产油微藻藻株。以藻液单位体积总脂含量和总脂产率为评价指标,根据SPSS的分析结果得知,与出发藻株相比,改组藻株的单位体积总脂含量和单位体积总脂产率都有了显著的提高(p<0.05)。

图5 日本小球藻出发藻株与F2C2单位体积总脂产率Fig.5 The total fat yield per unit volume of the orginal Chlorella hirataii and F2C2

图6 日本小球藻出发藻株和F2C2单位体积总脂含量Fig.6 Total fat content per unit volume of the orginal Chlorella hirataii and F2C2
2.4日本小球藻总脂含量的组分分析
由图7可知,改组前后的日本小球藻气相色谱图的峰形以及出峰时间没有变化,说明改组前后的日本小球藻的总脂组成成分没有变化。由于两个气相图谱的峰值大小有差异,说明改组藻株和初始藻株的总脂肪酸的组分含量有很大变化。

图7 日本小球藻初始藻株(a) 与改组藻株F2C2(b)的气相图谱Fig.7 Gas chromatogram of the original Chlorella hirataii and F2C2
3 讨论与结论
虽然经典的随机诱变、定向筛选的育种方法工作量大,周期长,随机性强,效率低,很难在短时间内获得高产量的正向突变株,但是依然是目前使用的主要育种手段。genome shuffling是在整个微生物基因组水平上进行重排的技术,经过递归式多次融合,使基因组在较大范围内发生交换和重组,将引起正向突变的不同基因重组到一个细胞中。目前国内外通过genome shuffling获得高产油脂的藻株的选育还鲜有报道。利用基因组技术成功选育脂肪酶[9]、谷氨酸[10]和抗生素[11]高产菌株的报道证明,基因组改组技术是一种行之有效的育种方法。
进行基因组改组首先需要构建一个候选菌库,该菌库中各正突变株的基因组之间差别越大,基因组改组后获得表型有较大改进的杂交菌种的可能性就越大[12]。本研究在紫外诱变和甲基磺酸乙酯诱变获得几种不同的正向突变株的基础上,采用基因组改组技术将各正向突变体亲本进行杂交融合,筛选整合各正向突变的重组子代。改进筛选方法,采用尼罗红荧光染色法对微藻进行初步产油鉴定,尼罗红染色法可以直观观察细胞内的油脂含量情况,相比气相色谱操作更方便,操作时间更短,仅需简单染色即可,因此选择尼罗红染色法进行初筛更高效。
日本小球藻的种内融合会造成细胞大小产生变化,但是由于遗传物质以及代谢产物等内容物基本一致,其细胞生理生化特性也不会发生很大变化。两个原生质体的融合产生的也不一定是融合子,也有可能是异核体。异核体并非真正的融合子,结构并不稳定。随着细胞分裂的发生,新的性状也会渐渐消失变成亲本特性[13]。所以为了得到性状稳定遗传的融合子,需要对筛选出来的藻株进行连续传代来培养考察其优良的遗传稳定性。本文中所得到的融合藻株的遗传稳定性均不高,可能在于微藻的细胞结构相较于原核生物更为复杂,细胞融合较为困难。
经过多轮融合筛选过后选育出了日本小球藻高产油脂藻株F2C2,其油脂最终含量达到59.01%,较原始藻株提高了101.4%。在实现规模化微藻生产之前,还需要进行大量的科研工作,如优化藻株的生长条件,对微藻进行基因水平的定向分子改造。
[1]Posten C,Schaub G. Microalgae and terrestrial biomass as source for fuels-a process view[J]. Journal of Biotechnology,2009,142(1):64-69.
[2]Harun R,Danquah M K,Forde G M. Microalgal biomass as a fermentation feedstock for bioethanol production[J]. Journal of Chemical Technology & Biotechnology,2010,85(2):199-203.
[3]Shi D J,Wang C L,Wang K M. Genome shuffling to improve thermotolerance,ethanol tolerance and ethanol productivity ofSaccharomycescerevisiae[J]. Journal of Industrial Microbiology & Biotechnology,2009,36(1):139-147.
[4]Lee B U,Choi M S,Kim D M,et al. Genome Shuffling ofStenotrophomonasmaltophilia,OK-5 for Improving the Degradation of Explosive RDX(Hexahydro-1,3,5-trinitro-1,3,5-triazine)[J]. Current Microbiology,2017,74(2):268-276.
[5]Dai M,Copley S D. Genome shuffling improves degradation of the anthropogenic pesticide pentachlorophenol bySphingobiumchlorophenolicumATCC 39723[J]. Applied and Environmental Microbiology,2004,70(4):2391-2397.
[6]P Greenspan,EP Mayer,SD Fowler. Nile red:a selective fluorescent stain for intracellular lipid droplets[J]. Journal of Cell Biology,1985,100(100):965-73.
[7]陈波. 两种微型绿藻营养生理及原生质体制备与杂交育种的研究[D]. 广州:暨南大学,2000.
[8]Liang Y,Beardall J,Heraud P. Effects of nitrogen source and UV radiation on the growth,chlorophyll fluorescence and fatty acid composition of Phaeodactylum tricornutum,and Chaetoceros muelleri,(Bacillariophyceae)[J]. Journal of Photochemistry & Photobiology B Biology,2006,82(3):161-72.
[9]Wang H K,Jie Z,Wang X J,et al. Genome shuffling improves production of the low-temperature alkalophilic lipase by Acinetobacter johnsonii[J]. Biotechnology Letters,2012,34(1):145-151.
[10]张媛媛,李家洲.基因组改组快速提高谷氨酸棒杆菌L-鸟氨酸产量[J].食品科学,2012,33(15):206-209.
[11]金庆超,沈娜,杨郁,等. spy1的DNA改组提高普那霉素的产量[J].中国抗生素杂志,2015,40(3):178-182.
[12]张克旭,陈宁.用原生质体融合技术选育谷氨酸高产菌[J].微生物学报,1991(2):108-114.
[13]王幼平,张莉莉,吴晓霞.原生质体融合[J].生物学通报,2009,44(8):7-9.
IncreasethelipidproductionofChlorellahirataiirapidlybygenomeshuffling
LIUHong-quan,YUANSha,LUEn-qiu,PANYi-hua,YANGHai-yan,LONGHan,XUANJin-cai,HEXiu-miao
(College of Ocean and Biotechnology,Guangxi University for Nationalities,Guangxi Key Laboratory Cultivation Base for Polysaccharide Materials and their Modification,Nanning 530007,China)
StrainChlorellahirataiiwas used as the starting strains for genome shuffling. They were mutated by UV-light and ethylmesylate separately,and four mutant strains with increased lipids yield were selected. Two rounds of genome shuffling were carried out with the four mutant strains using PEG to mediate protoplasts fusion. Finally,theChlorellahirataiiF2C2 was selected which produced lipids(59.01%)higher than the original strain by 101.4%. Compare with the original strain in the same batch,the total lipid composition of theChlorellahirataiiF2C2 didn’t change a lot,but there was a big gap between the content of each component.
genome shuffling;total lipid content;Chlorellahirataii
2017-04-11
刘红全(1975-),男,博士,副教授,主要从事植物分子生物学方面的研究,E-mail:lhongquan@163.com。
国家自然科学基金(30960215);广西自然科学基金(桂科青0728019);广西民族大学相思湖青年学者创新团队资助项目。
TS201.3
A
1002-0306(2017)21-0096-04
10.13386/j.issn1002-0306.2017.21.020
