趋化因子SDF-1调控结直肠癌细胞上皮-间质转化
2017-11-21盛文文陈术合孙景洲
张 磊,盛文文,陈术合,孙景洲
趋化因子SDF-1调控结直肠癌细胞上皮-间质转化
张 磊,盛文文,陈术合,孙景洲
目的通过检测Twist、SDF-1、E-cadherin在结直肠癌及癌旁组织中的表达,探讨三者与上皮-间质转化(epithelial-mesenchymal transition, EMT)的相关性,为肿瘤的分子靶向治疗提供可能的靶标。方法收集结直肠癌和对应癌旁正常新鲜标本组织40例和结直肠癌组织及对应癌旁组织蜡块90例,利用免疫组化SP法和qRT-PCR法检测结直肠癌组织中SDF-1及EMT相关因子E-cadherin、Twist的表达,统计学分析SDF-1表达与E-cadherin、Twist表达之间的相关性。结果qRT-PCR结果显示,与对应癌旁组织相比,结直肠癌组织中SDF-1、Twist mRNA的表达水平明显升高,而E-cadherin mRNA表达水平显著下降,差异有统计学意义(P<0.05);结直肠癌组织中SDF-1、Twist的阳性率分别为75.56%、62.22%,明显高于对应癌旁组织,而E-cadherin在肿瘤中的阳性率为28.89%,显著低于癌旁组织,差异有统计学意义(P<0.05)。SDF-1表达与E-cadherin表达呈负相关,而与Twist表达呈正相关。结论趋化因子SDF-1高表达可能参与结直肠癌细胞的EMT过程,Twist高表达和E-cadherin低表达提示EMT现象参与结直肠癌的形成及转移过程,并促进肿瘤的生成和转移。
结直肠肿瘤;趋化因子;上皮-间质转化;SDF-1
结直肠癌是消化系统常见的恶性肿瘤,已经严重危害我国人们的身体健康。探讨结直肠癌的转移机制对患者的早期诊治及提高生存率有重要意义[1-2]。基质细胞衍生因子-1(SDF-1)及其受体CXCR4信号通路在肿瘤的形成及转移过程中起重要作用,有望成为潜在的肿瘤治疗靶向位点[3-4]。上皮-间质转化(epithelial-mesenchymal transition, EMT)是肿瘤细胞发生浸润和转移过程中首先发生的形态学变化[5]。在EMT过程中,肿瘤细胞很可能受到趋化因子的趋化作用,目前国内外也有相关文献报道趋化因子SDF-1与EMT之间的关系。本实验采用免疫组化SP法和qRT-PCR法联合检测,初步确认结直肠癌组织中SDF-1表达与EMT相关因子E-cadherin及Twist之间的相关性,探讨SDF-1在EMT过程中的可能作用。
1 材料与方法
1.1一般资料收集皖西卫生职业学院附属医院以及安徽医科大学附属医院外科2014~2016年手术切除的结直肠癌和对应癌旁正常新鲜标本组织40例(癌旁正常组织距离切缘6 cm、癌组织均经病理证实)。将标本组织放置在液氮罐中留存,待提取组织中总的RNA。同时调取该两家医院病理科结直肠癌组织及对应癌旁组织蜡块90例(病理已证实)。患者年龄35~80岁,平均59.5岁。女性34例,男性56例。组织学分级:低分化60例,中+高分化30例。浸润深度分级:肌层及浆膜下层56例,黏膜和黏膜下层34例。肿瘤直径<5 cm者32例,直径≥5 cm者58例。淋巴结转移者66例。远处转移者45例。TNM分期:Ⅰ+Ⅱ期37例,Ⅲ+Ⅳ期53例。蜡块4 μm厚切片,烤干以备用。
1.2试剂和方法
1.2.1试剂 兔抗人SDF-1、E-cadherin及Twist多克隆抗体购自美国Invitrogen公司,SDF-1稀释度为1 ∶50,E-cadherin及Twist稀释度为1 ∶100;二抗试剂盒(sp9001)及DAB显色液购自福州迈新公司。提取总RNA的试剂RNAiso Plus及qRT-PCR Sybr Green I试剂盒为Takara公司产品,英潍捷基合成SDF-1、E-cadherin、Twist及GAPDH引物,7500荧光定量PCR仪购自美国ABI公司。
1.2.2方法 标本均经10%中性福尔马林固定,常规石蜡包埋后切片,行HE和免疫组化SP法染色。免疫组化操作步骤严格按试剂盒说明书进行,以PBS作为阴性对照或兔IgG替代一抗。
qRT-PCR操作:把之前保存在液氮罐内的标本取出,并按照试剂盒说明书的操作流程进行总RNA提取、逆转录、qRT-PCR。qRT-PCR引物序列:SDF-1上游5′-ATTCTCAA CACTCCAAACTGTGC-3′,下游5′-ACTTTAGCTTCGGGTCA ATGC-3′;E-cadherin上游5′-CGAGAGCTACACGTTCACGG-3′,下游5′-GGGTGTCGAGGGAAAAATAGG-3′;Twist上游5′-GCCTAGAGTTGCCGACTTATG-3′,下游5′-TGCGTTTCCTGT TAAGGTAGC-3′;GAPDH上游5′-CTCACCGGATGCACCAAT GTT-3′,下游5′-CGCGTTGCTCACAATGTTCAT-3′。qRT-PCR反应程序:58 ℃ 30 s;72 ℃ 30 s;94 ℃ 30 s;94 ℃ 2 min;一共进行40个循环,72 ℃ 5 min。每个标本组织设有3个复孔。定量结果为反应完成后计算机进行测算。
1.3结果判断
1.3.1免疫组化结果判断 E-cadherin、SDF-1及Twist均呈阳性,SDF-1及Twist阳性细胞以胞质显色清晰棕黄色,E-cadherin阳性细胞则以细胞膜和胞质显色清晰黄色。采用半定量积分法判断阳性结果[6]:根据细胞染色强度和阳性细胞占同类细胞总数的百分比(随机选取10个高倍镜视野,每个视野计数100个细胞)两方面进行综合判定。(1)按染色强度计分:0分为无染色;1分为浅黄色;2分为棕黄色;3分为棕褐色。(2)按阳性细胞数计分:0~25%为0分;25%~50%为1分;50%~75%为2分;>75%为3分。将两项得分结果相乘:≥2分为阳性,<2分为阴性。
1.3.2qRT-PCR结果判断 测量标本组织模板Ct值。Ct值的含义是每个反应管内的荧光信号到达设定的阈值时所经历的循环数。ΔCt等于Ct(目的基因)减去Ct(内参基因),得到的ΔCt数值小则说明原始cDNA目的基因表达就高。
1.4统计学处理采用SPSS 19.0软件进行计量资料的处理。采用χ2检验分析免疫组化结果,采用配对t检验分析qRT-PCR结果,指标间的相关性利用Spearman秩相关分析,P≤0.05为差异有统计学意义。
2 结果
2.1qRT-PCR检测结直肠癌和癌旁组织内E-cadherin、twistmRNA及SDF-1的表达qRT-PCR检测SDF-1、E-cadherin及Twist蛋白在结直肠癌组织及癌旁组织中的表达,发现正常癌旁组织与结直肠癌组织对比,结直肠癌组织中SDF-1、Twist mRNA的表达水平明显提高,而E-cadherin mRNA表达水平显著下降,差异有统计学意义(P<0.05,图1)。
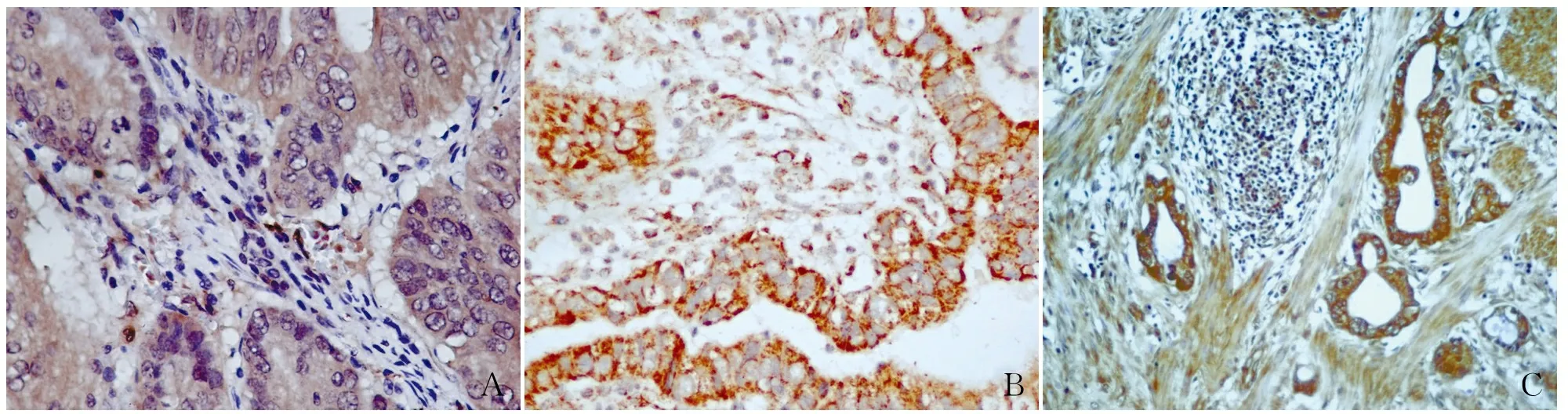
2.2SDF-1、E-cadherin及Twist在结直肠癌组织和癌旁组织中的表达免疫组化法检测SDF-1、E-cadherin及Twist蛋白在结直肠癌组织及癌旁组织中的表达,结果显示SDF-1、Twist表达定位于细胞质,E-cadherin部分表达定位于细胞质和细胞膜,阳性细胞呈现出棕黄色颗粒状(图2)。SDF-1在结直肠癌组织中的阳性率为75.56%,在相应癌旁组织中的阳性率为38.89%;Twist在结直肠癌组织中的阳性率为62.22%,癌旁组织为34.44%;E-cadherin在结直肠癌组织中的阳性率为28.89%,在相应癌旁组织中阳性率明显升高,高达81.11%(P<0.05,表1)。

表1 结直肠癌和癌旁组织中SDF-1、Twist、E-cadherin的表达
2.3SDF-1表达与Twist及E-cadherin表达之间的相关性本组实验结果表明,SDF-1表达与Twist表达呈正相关,与E-cadherin表达呈显著负相关(P<0.05,表2)。

图1 结直肠癌和癌旁组织中SDF-1(A)、Twist(B)、E-cadherin(C) mRNA的表达
ABC
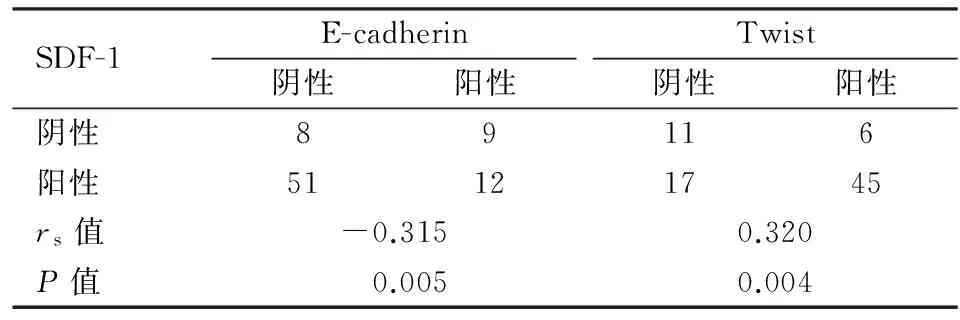
图2 结直肠癌组织中Twist(A)、E-cadherin(B)、SDF-1(C)的表达水平,SP法
3 讨论
趋化因子通过细胞膜上的特异性受体发挥其生物学功能。趋化因子受体属于G蛋白偶联的7次跨膜受体,目前已鉴定的趋化因子受体至少有20种。根据结合配体不同可分为4类,CXC族受体(CXCR)、CC族受体(CCR)、C族受体(XCR1)和CX3C族受体(CX3CR)[7]。趋化因子最初被认为是白细胞的诱导剂,但是目前公认趋化因子可表达于包括肿瘤细胞在内的几乎所有细胞中[8]。最新研究表明趋化因子及其受体在肿瘤的侵袭和转移过程中起重要作用,并且可能成为肿瘤治疗的新靶点[9-10]。
大量研究表明,趋化因子SDF-1在包括食管癌、肺癌、前列腺癌、结直肠癌等恶性肿瘤的演进过程中起到重要作用[11-12]。本组实验发现在结直肠癌组织中SDF-1 RNA及蛋白水平表达均高于相应癌旁组织,并且前期实验结果表明,DF-1表达与肿瘤细胞淋巴结转移、远处转移及TNM分期密切相关(P<0.05)[13]。这些结果提示:结直肠癌中SDF-1可能参与肿瘤细胞的转移过程,但是具体机制尚不清楚,这与之前的实验结果一致。
EMT过程是肿瘤转移的起始阶段,在这一过程中上皮细胞逐渐向间质细胞转变并具有侵袭作用,同时上皮标志物E-cadherin等表达逐渐减少,而间质标志物如N-cadherin及Twist等表达显著升高[14]。现已有多篇文献报道EMT参与肿瘤的形成及转移过程,包括乳腺癌、前列腺癌、胃癌等[15-17]。本组实验发现,在结直肠癌组织中也存在EMT现象,免疫组化及qRT-PCR实验结果显示,E-cadherin在结直肠癌组织中的表达明显低于癌旁组织,而Twist在结直肠癌组织中的表达明显高于癌旁组织,提示EMT现象参与了结直肠癌的形成及转移过程。
趋化作用在EMT过程中的作用未知,并且国内外文献很少报道。Pang等[18]报道CCR7介导的趋化作用可以诱导乳腺癌细胞发生EMT,进而促进乳腺癌细胞迁移。本实验分析了90例结直肠癌组织中趋化因子SDF-1与EMT因子E-cadherin及Twist表达的相关性,发现SDF-1表达与E-cadherin表达呈负相关,而与Twist表达呈正相关,表明了趋化因子SDF-1参与结直肠癌细胞的EMT作用。
[1] Torre L A, Bray F, Siegel R L,etal. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Agarwal E, Brattain M G, Chowdhury S. Cell survival and metastasis regulation by Akt signaling in colorectal cancer[J]. Cell Signal, 2013,25(8):1711-1719.
[3] Teicher B A, Fricker S P. CXCL12 (SDF-1)/CXCR4 pathway in cancer[J]. Clin Cancer Res, 2010,16(11):2927-2931.
[4] Gelmini S, Mangoni M, Serio M,etal. The critical role of SDF-1/CXCR4 axis in cancer and cancer stem cells metastasis[J]. J Endocrinol Invest, 2008,31(9):809-819.
[5] Jin D, Fang Y, Li Z,etal. Epithelial-mesenchymal transition associated microRNAs in colorectal cancer and drug-targeted therapies (Review)[J]. Oncol Rep, 2015,33(2):515-525.
[6] Kawasaki H, Altieri D C, Lu C D,etal. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer[J]. Cancer Res, 1998,58(22):5071-5074.
[7] Chow M T, Luster A D. Chemokines in cancer[J]. Cancer Immunol Res, 2014,2(12):1125-1131.
[8] Kruizinga R C, Bestebroer J, Berghuis P,etal. Role of chemokines and their receptors in cancer[J]. Curr Pharm Des, 2009,15(29):3396-3416.
[9] Zhou Y Q, Gao H Y, Guan X H,etal. Chemokines and their receptors: potential therapeutic targets for bone cancer pain[J]. Curr Pharm Des, 2015,21(34):5029-5033.
[10] Palacios-Arreola M I, Nava-Castro K E, Castro J I,etal. The role of chemokines in breast cancer pathology and its possible use as therapeutic targets[J]. J Immunol Res, 2014,2014:849720.
[12] Prasad G, McCullough M. Chemokines and cytokines as salivary biomarkers for the early diagnosis of oral cancer[J]. Int J Dent, 2013,2013:813756.
[13] 张 磊, 孙雪竹, 孙景洲. SDF-1/CXCR4及VEGF在结直肠腺癌中的表达及其意义[J]. 中国免疫学杂志, 2015,5:674-677, 682.
[14] Cao H, Xu E, Liu H,etal. Epithelial-mesenchymal transition in colorectal cancer metastasis: A system review[J]. Pathol Res Pract, 2015,211(8):557-569.
[15] Tseng J C, Chen H F, Wu K J. A twist tale of cancer metastasis and tumor angiogenesis[J]. Histol Histopathol, 2015,30(11):1283-1294.
[16] Bill R, Christofori G. The relevance of EMT in breast cancer metastasis: correlation or causality[J]?. FEBS Lett, 2015,589(14):1577-1587.
[17] 张炜明, 宋国新, 平国强, 等. 结肠癌组织中LKB1的表达及其与上皮-间质转化的关系[J]. 临床与实验病理学杂志, 2016,32(10):1081-1083, 1088.
[18] Pang M F , Georgoudaki A M, Lambut L,etal. TGF-β1-induced EMT promotes targeted migration of breast cancer cells through the lymphatic system by the activation of CCR7/CCL21-mediated chemotaxis[J]. Oncogene, 2016,35(6):748-760.
R 735.3
A
1001-7399(2017)10-1126-03
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.015.html
10.13315/j.cnki.cjcep.2017.10.015
接受日期:2017-04-06
安徽省高校省级优秀青年人才基金重点项目(2013 SQRL147ZD)、安徽省高等学校自然科学研究一般项目(KJ2017B01)
皖西卫生职业学院基础部解剖教研室,六安 237005
张 磊,男,硕士,副教授。E-mail: 81057268@qq.com
孙景洲,男,教授,通讯作者。E-mail: 289843592@qq.com
