肺癌组织及细胞中MED27的表达及意义
2017-11-21朱晓静许鹏飞谢开鹏唐冉冉
朱晓静,许鹏飞,曹 彦,谢开鹏,唐冉冉
肺癌组织及细胞中MED27的表达及意义
朱晓静1,许鹏飞2,曹 彦2,谢开鹏2,唐冉冉2
目的探讨中介因子复合体(mediator 27, MED27)在肺癌组织样本和肺癌细胞中的表达并进一步观察MED27在肺癌细胞中的生物学功能。方法采用免疫组化法和Western blot法检测MED27在70例肺癌组织以及5种不同肺癌细胞中的表达,分析MED27蛋白表达与肺癌临床病理特征的相关性;设计沉默MED27基因的siRNA,利用Western blot法检测MED27 siRNA在肺癌细胞中的沉默效率;CCK-8法检测细胞增殖能力的变化,划痕和Transwell实验评估细胞的迁移和侵袭能力的变化;Western blot法检测迁移侵袭相关蛋白的变化。结果免疫组化和Western blot检测结果表明,MED27在肺癌组织以及肺癌细胞系中的表达水平明显上调(P<0.05)。MED27表达与淋巴结转移呈正相关(χ2=9.438,P=0.002,P<0.05),与患者性别、年龄、肿瘤T分期、远处转移等均无相关性(P>0.05);利用小干扰RNA沉默MED27的表达,可以抑制H460细胞的增殖、迁移和侵袭(P<0.05)。同时,迁移相关蛋白MMP-2和MMP-9表达明显下调,侵袭相关蛋白E-cadherin表达也明显下调,而E-cadherin的负性调控蛋白Snail表达升高。结论MED27在肺癌组织和细胞系中高表达,且MED27阳性肺癌患者预后更差。沉默MED27的表达可以抑制肺癌细胞的增殖、迁移和侵袭能力,以上结果提示MED27可以作为临床肺癌基因治疗的潜在靶标。
肺肿瘤;中介因子复合体27;迁移;侵袭
虽然肺癌的研究近年来已取得一定的进展,但是非小细胞肺癌的5年生存率并未显著提高[5-6]。MED27作为一种重要的转录因子,在人体各组织中广泛表达。目前,对MED27功能的研究主要集中在其转录调控方面。如MED27可以与甲状腺激素受体相互作用,或通过与其它转录因子和辅因子结合一起行使甲状腺激素受体功能[7]。但是,MED27在癌症发生、发展中的功能和机制却知之甚少。前期研究发现,MED27在黑色素瘤中异常高表达,可以作为评估黑色素瘤预后的潜在标志物[8]。本实验拟通过分析MED27在肺癌组织中的表达和与肺癌患者预后的关系,以及MED27对肺癌细胞生物学功能的影响,阐明MED27在肺癌发生、发展中的作用,以期为肺癌的临床靶向治疗提供新的靶点和思路。
1 材料与方法
1.1临床资料肺癌组织芯片购自上海芯超生物公司,含70例肺腺癌和对应的癌旁组织。所有的肺癌患者在手术之前均未行放、化疗,肿瘤的边缘组织经过病理证实无肿瘤侵犯为癌旁组织。其中,男性37例,女性33例;年龄36~83岁,中位年龄59岁;根据国际肺癌TNM标准分期:T1+T2者58例,T3+T4者12例;淋巴结转移:N0+N1者44例,N2+N3者26例,远处转移M0者67例,远处转移M1者3例。
1.2实验材料及主要试剂免疫组化试剂盒购自康为世纪公司,人肺癌细胞H1299、A549、H1975、H1437、H460均购自ATCC细胞库,由本实验室冻存保存及传代培养,正常人支气管上皮细胞(HBE)培养在10%的RPMI-1640中。DMEM细胞培养基和胎牛血清均购自Gibco公司,胰酶-EDTA购自Sigma公司;MED27人源的双链siRNA由上海吉玛制药公司合成(siRNA1:上游5′-GGCUCCAAUUUG UCUAUAATT-3′,下游5′-UUAUAGACAAAUUGGAG CCTT-3′;siRNA2:上游5′-GGUGGCCAUAGUUCG AUAUTT-3′,下游5′-AUAUCGAACUAUGGCCACC TT-3′),转染使用的脂质体Lipofectamine 2000购自Invitrogen公司;Transwell小室和Matrigel购自美国BD公司,CCK-8购自东仁化学科技公司,BCA蛋白定量试剂盒购自北京康为世纪公司,MED27、MMP-2、MMP-9抗体购自Santa Cruz公司(1 ∶500);E-cadherin、Snail抗体购自Cell Signaling Technology(1 ∶1 000),GAPDH购自Abcam公司(1 ∶1 000),HRP标记的山羊抗兔IgG(H+L)与山羊抗鼠IgG(H+L)购自ProteinTech公司。
1.3方法
1.3.1免疫组化法检测MED27在肺癌组织中的表达 免疫组化染色采用SP法,结果由两位病理医师分别独立读片。组织经二甲苯脱蜡,再通过梯度乙醇水化。微波炉中火10 min×5次进行抗原修复,3%H2O2孵育10 min,以消除内源性过氧化物酶活性。滴加山羊血清工作液室温孵育10~15 min,以去除非特异性结合。一抗4 ℃孵育过夜,PBS漂洗,PV9000室温孵育,DAB显色,苏木精复染,1%盐酸、75%乙醇分化,1%氨水返蓝,梯度乙醇脱水,封片。PBS代替一抗作为阴性对照,免疫组化结果判断:本实验根据细胞着色程度和阳性细胞占所观察细胞百分比的评分乘积进行半定量。200倍显微镜下随机选取10个无交叉重复的视野,每个视野计数100个肿瘤细胞,按细胞着色程度评分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。按阳性细胞占观察细胞百分比评分:无阳性细胞为0分,≤20%为1分,21%~49%为2分,≥50%为3分。将两项得分结果相乘:0分为阴性(-),1~3分为弱阳性(+),4~6分为中度阳性(),>6分为强阳性()。其中(-)定义为蛋白阴性,(+~)定义为蛋白阳性[5]。
1.3.2细胞的培养和传代 显微镜观察细胞生长密度,融合率达80%~90%时,吸去培养基,PBS缓冲液冲洗2次。加入1 mL胰蛋白酶液,置于37 ℃培养箱,并于显微镜下观察细胞形态,当细胞收缩变圆时,加入2 mL培养基中止消化。轻轻吹打待细胞脱落,将细胞悬液转移至15 mL离心管,1 000 r/min×5,弃上清,2 mL培养基重悬细胞,转移至培养瓶中,加入5 mL培养基,5%CO237 ℃培养箱继续培养。
1.3.3MED27siRNA转染H460细胞 本实验采用Lipofectamine 2000转染siRNA,具体操作过程如下:按照常规细胞培养的方法培养H460,转染前将对数生长的细胞接种于6孔板中,当细胞生长到融合度达70%~80%时进行细胞转染;转染前用无血清的培养基分别稀释MED27siRNA和Lipofectamine 2000,混匀,在室温下静置5~10 min后;用无血清培养基清洗细胞2~3次后补加2~3 mL培养基,将之前混匀好的转染混合试剂加入到培养板中进行转染,6~8 h后弃去转染培养液,加入新鲜的含血清不含双抗的培养基继续培养。
1.3.4CCK-8法检测细胞增殖能力 取对数期生长的H460细胞,分别转染对照和特异性的MED27siRNA 48 h以后,计数细胞:每100 μL细胞数为1 000~2 000个,加入到96孔板中,48 h以后,向每孔中加入10 μL CCK-8溶液,继续培养1~2 h,酶标仪测定在450 nm处的吸光度(A)值。
1.3.5迁移和侵袭实验 划痕实验:先用Marker笔在6孔板背后,采用直尺均匀划得横线,每隔0.5~1 cm一道,横穿过孔。在孔中加入约5×105个细胞,37 ℃培养过夜;当细胞铺满,用枪头比着直尺,尽量垂直于背后的横线划痕,枪头要垂直,不能倾斜,用PBS洗细胞2~3次,去除划下的细胞,加入无血清培养基,转染MED27siRNA 6~8 h,换正常培养基,放入37 ℃培养,按0、48 h取样,拍照。Transwell实验:小室上层加入1 mg/mL的基质胶20 μL后自然晾干,下层加入含20%血清的500 μL DMEM培养基,待细胞转染后分别计数,用100 μL不含血清的培养基重旋3×106个细胞,加入到小室上层,小室在24孔板中继续培养48 h后,4%多聚甲醛固定10 min后,用0.1%的结晶紫染色30 min后,倒置显微镜下拍照,计数。
1.3.6Western blot实验 MED27siRNA转染后继续培养48 h,弃去培养液,RIPA裂解法提取蛋白,收集细胞总蛋白先进行定量,然后进行电泳,电泳完成后采用湿法进行转膜,转膜后用5%脱脂奶粉室温下孵育封闭1.5~2 h,加入用抗体稀释液稀释的一抗,4 ℃孵育过夜,用TBST漂洗,重复3次,每次10~15 min,加入HRP标记的二抗在室温下孵育2 h,用TBST漂洗10 min×3次,采用ECL化学发光法显影后进行机器曝光,采用相关图像分析软件进行图像分析,测定灰度值,以GAPDH为内参照。
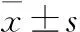
2 结果
2.1MED27在肺癌组织中的表达免疫组化染色结果显示,70例肺癌组织中MED27的表达水平明显高于癌旁组织(图1)。70例肺癌组织中,MED27的阳性率为87.1%(61/70),统计分析发现,MED27表达与淋巴结转移呈正相关(χ2=9.438,P=0.002,P<0.05,表1),与患者性别(χ2=0.809,P=0.369)、年龄(χ2=0.282,P=0.595)、肿瘤T分期(χ2=0.001,P=0.968)、远处转移(P>0.999)等无相关性(P>0.05,表1),以上结果提示,MED27可能是肺癌的潜在标志物。
2.2MED27在人支气管上皮细胞和肺癌细胞中的表达以人支气管上皮细胞HBE为对照,通过Western blot法检测MED27在不同肺癌细胞系中的表达。结果显示,MED27在肺癌细胞系H1437、A549、H1299、H460中的表达水平显著高于HBE细胞,表明MED27在不同类型肺癌细胞系中均异常高表达(P<0.05,图2)。

AB
图1MED27的表达:A.肺癌组织;B.癌旁组织,SP法

图2MED27在不同肺癌细胞系和正常细胞中的表达:A.电泳图;B.直方图
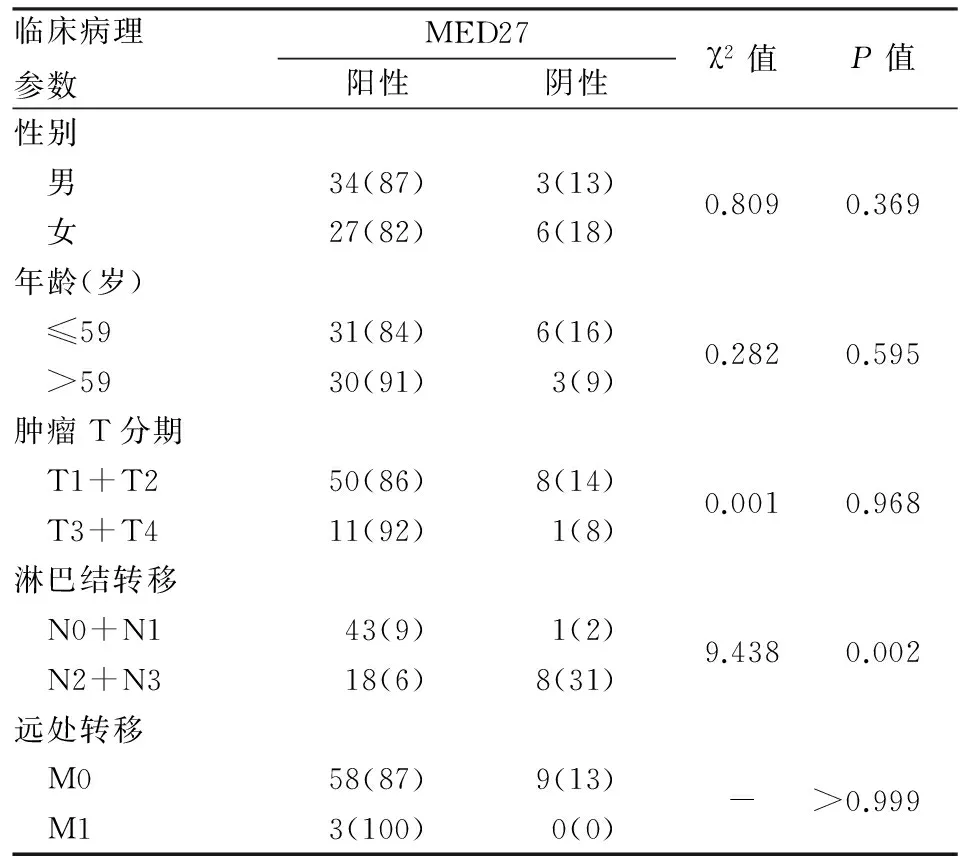
表1 MED27表达与肺癌临床病理特征的相关性
2.3沉默MED27对H460肺癌细胞增殖的影响鉴于MED27在H460细胞中表达量最高,且易转染,因此选择H460细胞作为后续研究对象。在转染MED27siRNA 48 h以后,通过Western blot法检测H460细胞中MED27的蛋白水平发现MED27的沉默成功(图3A)。进一步通过CCK-8法检测发现,沉默MED27可明显抑制H460肺癌细胞的增殖(P<0.05,图3B)。
2.4沉默MED27对H460肺癌细胞迁移和侵袭能力的影响采用划痕实验于0、48 h分别检测沉默MED27对H460肺癌细胞迁移能力的影响,结果显示,与对照组相比,MED27沉默后,H460肺癌细胞的迁移能力明显降低(P<0.05)。Transwell小室实验检测细胞侵袭能力,结果显示,MED27沉默组的侵袭能力同样显著低于对照组,差异均有统计学意义(P<0.05),提示沉默MED27的表达可明显抑制H460细胞的迁移(图4A)和侵袭能力(图4B)。

图3 H460细胞转染MED27siRNA后MED27的表达水平(A)及对细胞活力的影响(B)
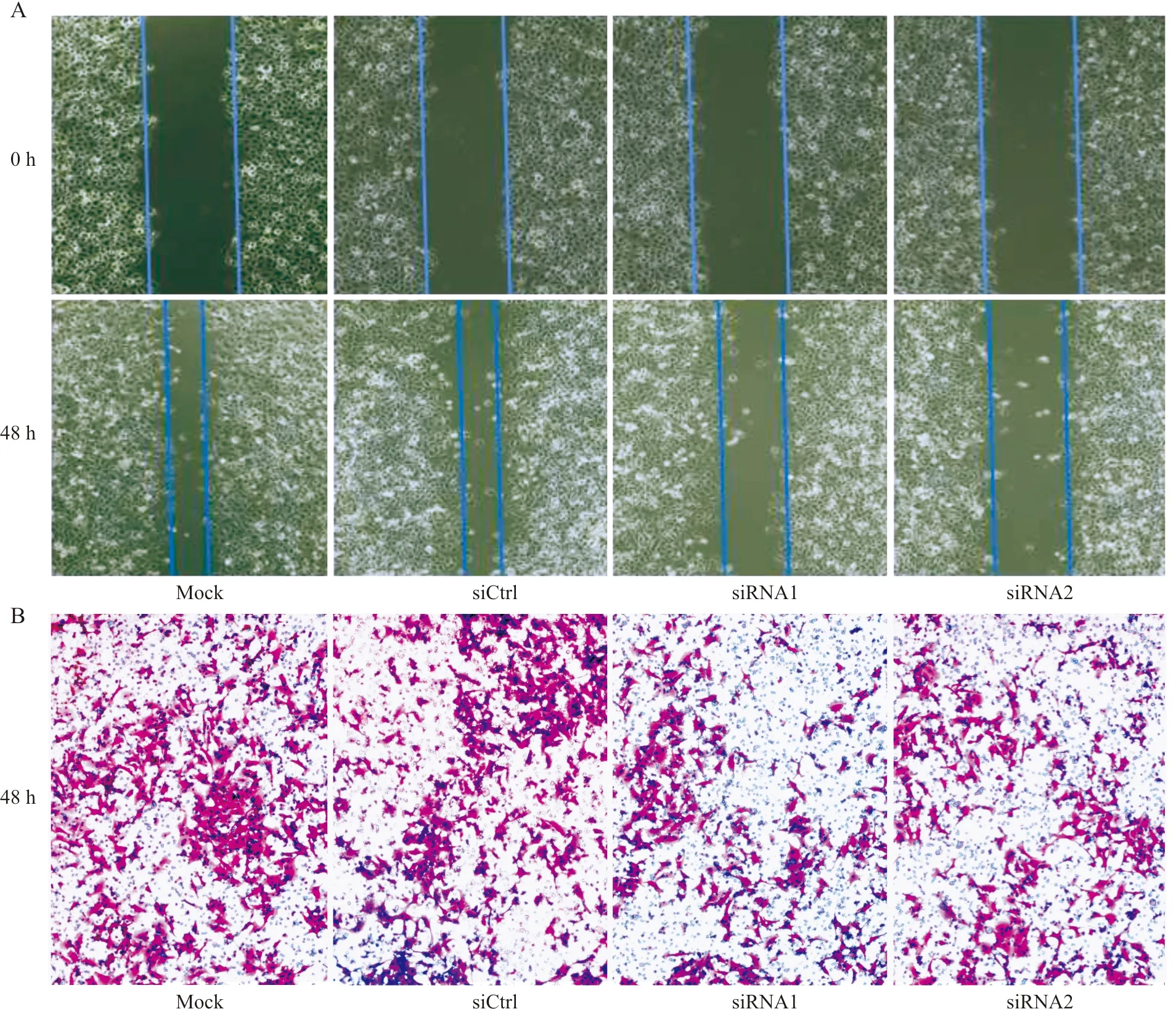
图4 沉默MED27的表达对H460细胞迁移(A)和侵袭(B)的影响
2.5MED27调控H460细胞迁移和侵袭相关蛋白的表达Western blot结果显示:与siCtrl组相比,MED27siRNA组抑制了迁移相关蛋白MMP-2和MMP-9的表达,同时抑制了侵袭相关蛋白E-cadherin的表达,而E-cadherin的负性调控蛋白Snail的表达水平明显升高(图5)。
图5 MED27沉默调控迁移(A)、侵袭(B)相关蛋白的表达
3 讨论
随着医疗水平的不断提高,肺癌的治疗手段也日益丰富,已发展为手术为主,化学药物、放射、免疫等治疗手段为辅的综合性治疗[9-11],但仍未达到令人满意的预后。随着分子生物学理论和技术的飞速发展,随着肿瘤生物治疗研究的不断加深和进步,基因治疗现已成为肺癌治疗的一种新模式,而理想的靶基因选择则成为研究的热点。鉴于各种人类肿瘤中一些中介复合物亚基(MED)的突变或过表达的出现,MED家族蛋白已在肿瘤发生、发展中发挥越来越重要的作用,如MED1和MED15在前列腺癌中异常高表达[12-13],MED12的突变在子宫平滑肌肉瘤和结肠癌中是不良预后因素[14]。
MED27的研究尚处于起步阶段,关于其和肿瘤的相关性更是少之又少。前期研究发现,抑制MED27的表达可以抑制黑色素瘤细胞的增殖,促进其凋亡,机制研究发现MED27可以调控肿瘤相关因子iNOS的表达,进而影响肿瘤的发生、发展[8]。因此,MED27可能在肿瘤的发生、发展过程中起重要作用。
总之,实验结果初步表明MED27在肺癌组织和细胞中均异常高表达,且MED27的表达水平和肺癌患者的预后呈负相关,提示其可能影响肺癌的发生、发展。为此,通过细胞功能学实验发现,沉默MED27的表达能够明显抑制肺癌细胞的增殖、迁移和侵袭能力,而复发和早期转移是导致其预后不良的主要因素,暗示MED27在肺癌中可能作为一种新的促癌不良因子,参与肺癌的进程。本组实验结果为深入进行MED27的研究提供线索,发现了一种潜在的肺癌诊断和判断预后的新标志物,有助于深入认识肺癌发生、发展的分子改变,但是MED27在肺癌中的临床意义有待于进一步探索。
[1] 袁艳龙, 赵静雅, 田云霄, 等. 肺癌中E95、Ki-67的表达及临床意义[J]. 临床与实验病理学杂志, 2017,32(22):1385-1388.
[2] Wang G Z, Cheng X, Li X C,etal. Tobacco smoke induces production of chemokine CCL20 to promote lung cancer[J]. Cancer Lett, 2015,363(1):60-70.
[3] Gomezcasal R, Bhattacharya C, Ganesh N,etal. Non-small cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes[J]. Mol Cancer, 2013,12(1):94.
[4] Westcott P M K, Halliwill K D, To M D,etal. The mutational landscapes of genetic and chemical models of Kras-driven lung cancer[J]. Nature, 2015,517(7535):489-492.
[5] 王志维, 雷珍牛, 林 辉, 等. 119例非小细胞肺癌中CCR9的表达及其预后分析[J]. 临床与实验病理学杂志, 2015,31(7):764-768.
[6] Jemal A, Thun M J, Ries L A G,etal. Annual report to the nation on the status of cancer, 1975-2005, featuring trends in lung cancer, tobacco use, and tobacco control[J]. J Natl Cancer Inst, 2008,100(23):1672-1694.
[7] Bourbon H M. Comparative genomics supports a deep evolutionary origin for the large, four-module transcriptional mediator complex[J]. Nucleic Acids Res, 2008,36(12):3993-4008.
[8] Tang R, Xu X, Yang W,etal. MED27 promotes melanoma growth by targeting AKT/MAPK and NF-κB/iNOS signaling pathways[J]. Cancer Lett, 2016,373(1):77-87.
[9] Rosell R, Bivona T G, Karachaliou N. Genetics and biomarkers in personalisation of lung cancer treatment[J]. Lancet, 2013,382(9893):720-731.
[10] Peters S, Adjei A A, Gridelli C,etal. Metastatic non-small-cell lung cancer (NSCLC): ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012,23(Suppl 7):vii56-64.
[11] Teixid C, Karachaliou N, Gonz Lez-Cao M,etal. Erratum to assays for predicting and monitoring responses to lung cancer immunotherapy[J]. Cancer Biol Med, 2015,12(2):87-95.
[12] Offermann A, Vlasic I, Syring I,etal. MED15 overexpression in prostate cancer arises during androgen deprivation therapy via PI3K/mTOR signaling[J]. Oncotarget, 2016,8(5):7964-7976.
[13] Hulf T, Sibbritt T, Wiklund E D,etal. Epigenetic-induced repression of microRNA-205 is associated with MED1 activation and a poorer prognosis in localized prostate cancer[J]. Oncogene, 2013,32(23):2891-2899.
[14] Kämpjärvi K, Mäkinen N, Kilpivaara O,etal. Somatic MED12 mutations in uterine leiomyosarcoma and colorectal cancer[J]. Br J Cancer, 2012,107(10):1761-1765.
ExpressionofMED27inlungcancertissuesandcellsanditssignificance
ZHU Xiao-jing1, XU Peng-fei2, CAO Yan2, XIE Kai-peng2, TANG Ran-ran2
(1DepartmentofPathology,JiangsuProvinceHospitalofIntegratedChineseandWesternMedicine,Nanjing210028,China;2MedicalResearchCenter,MaternityHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing210004,China)
PurposeTo investigate the expression level of MED27 in lung cancer tissue samples and lung cancer cell lines and to further study the biological function of MED27 in lung cancer cells.MethodsImmunohistochemistry and Western blot were used to detect MED27 expression in 70 lung cancer tissues and 5 different lung cancer cell lines, and the correlation between MED27 expression and gender, age as well as PTNM was also analyzed. The silence sequence of MED27 was designed by the siRNA technique. Western blot was used to detect the silence efficiency of MED27. The proliferation, migration and invasion ability of cells were assessed by CCK-8 assay, Scratch assay and Transwell assay after the MED27 was knocked down. Western blot was used to detect the expression of protein involved in the cell proliferation, migration and invasion.ResultsThe results of immunohistochemistry and Western blot showed that MED27 expression was higher in lung cancer tissues and cells (P<0.05). The expression of MED27 was positively correlated with lymph node metastasis (χ2=9.438,P=0.002,P<0.05). However, it was not related with gender, age, tumor size and distant metastasis (P>0.05). The knockdown of MED27 by MED27 specific siRNA could inhibit the proliferation, migration and invasion of H460 cells (P<0.05). The expression of MMP-2 and MMP-9 involved in the cell migration that were significantly inhibited in H460 cells transfected by MED27 siRNA, and the expression of E-cadherin, related with cell invasion was also decreased, while E-cadherin negative regulatory protein Snail was increased.ConclusionMED27 is highly expressed in lung cancer tissues and cells and high expression of MED27 predicts poor prognosis in lung cancer patients. The knockdown of MED27 inhibits the proliferation, migration and invasion ability of lung cancer cells. All of the above results suggest that MED27 is expected to be a candidate target of lung cancer gene therapy.
lung neoplasms; MED27; migration; invasion
R 734.2
A
1001-7399(2017)10-1086-06
10.13315/j.cnki.cjcep.2017.10.006
肺癌已经成为男性发病率和病死率最高的肿瘤之一[1],目前认为吸烟是肺癌最重要的高危因素[2],除此之外,各种化合物、电离辐射、既往肺部感染、遗传等因素也是导致肺癌的主要原因[3-4]。
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.006.html
接受日期:2017-08-13
国家自然科学青年基金(81702831、81402139)
1江苏省中西医结合医院病理科,南京 210028
2南京医科大学附属妇产医院医学研究中心,南京 210004
朱晓静,女,主治医师。E-mail: zhuxiaojing0331@163.com
唐冉冉,男,硕士,助理研究员。E-mail: 13190186401@163.com
