2016年福建省输入性黄热病的分子诊断
2017-11-20翁育伟王金章张拥军欧剑鸣洪荣涛官升灿林仲韩丽丰郑奎城王灵岚严延生
翁育伟 王金章 张拥军 欧剑鸣 洪荣涛 官升灿 林仲 韩丽丰 郑奎城 王灵岚 严延生
350001 福州,福建省疾病预防控制中心 福建省人兽共患病重点实验室(翁育伟、王金章、张拥军、欧剑鸣、洪荣涛、林仲、郑奎城、王灵岚、严延生);350025 福州,福建医科大学附属孟超肝胆医院(官升灿、韩丽丰)
·病毒病诊断与治疗·
2016年福建省输入性黄热病的分子诊断
翁育伟 王金章 张拥军 欧剑鸣 洪荣涛 官升灿 林仲 韩丽丰 郑奎城 王灵岚 严延生
350001 福州,福建省疾病预防控制中心 福建省人兽共患病重点实验室(翁育伟、王金章、张拥军、欧剑鸣、洪荣涛、林仲、郑奎城、王灵岚、严延生);350025 福州,福建医科大学附属孟超肝胆医院(官升灿、韩丽丰)
目的应用分子检测方法,对输入性黄热病病例进行实验诊断。方法采集病例血清和尿液标本,应用实时荧光定量逆转录PCR(Real-time RT-PCR)法检测黄热病毒特异性核酸;套式RT-PCR法扩增病毒基因片段,序列测定或片段长度多态性法鉴别野毒株或疫苗株。结果Real-time RT-PCR法检测5例黄热病毒核酸阳性病例,病毒在尿液标本中存在时间较血清中存在时间更长,序列测定及限制性片段长度多态性法证实Angola71型病毒感染。结论同时采用血液和尿液检测可以提高黄热病检测敏感性,RFLP分析方法可快速鉴别野病毒感染,排除因疫苗接种后可能出现的阳性结果。
黄热病(Yellow fever,YF)是由黄热病毒(Yellow fever virus,YFV)引起的、经蚊媒传播的急性传染病[1],主要表现发热、头痛、黄疸、肌肉痛、恶心、呕吐以及疲劳等。少数病例可发生严重的系统性感染,导致出血和多脏器衰竭,其中约半数病例死亡[2]。
表15例输入性YF病例人口学、旅行史、疫苗接种史及临床特征
Tab.1Demography, travel and immunization history, clinical manifestation and medical examination of five imported cases of YF

特征Characteristics病例Case12345人口学 Demography性别Gender女Female男Male女Female女Female男Male年龄(岁)Age(Year)4242365318旅行暴露及疫苗接种史Historyoftravel,mosquitoexposeandvaccination赴安哥拉日期DatetoAngola2015⁃32015⁃92011⁃32015⁃12015⁃9入境日期Dateofarrival2016⁃03⁃122016⁃03⁃192016⁃03⁃212016⁃03⁃212016⁃03⁃26媒介叮咬Mosquitobiting有Yes有Yes有Yes有Yes有Yes是否接种Vaccination有Yes有Yes有Yes有Yes有Yes接种日期Dateofvaccination2016⁃03⁃072016⁃03⁃102011⁃03⁃092016⁃03⁃122016⁃03⁃16接种地Addressofvaccination安哥拉Angola安哥拉Angola中国China安哥拉Angola安哥拉Angola病程(日期)Illnesscourse(Date)发病日期Illnessonset2016⁃03⁃112016⁃03⁃172016⁃03⁃152016⁃03⁃132016⁃03⁃12首诊日期Firstvisithospital2016⁃03⁃142016⁃03⁃202016⁃03⁃232016⁃03⁃252016⁃03⁃28住院(隔离)日期Hospitalization(Quarantine)2016⁃03⁃182016⁃03⁃202016⁃03⁃232016⁃03⁃252016⁃03⁃29首次采样日期Firstsampling2016⁃03⁃142016⁃03⁃202016⁃03⁃242016⁃03⁃252016⁃03⁃28出院日期Convalescence2016⁃04⁃022016⁃04⁃162016⁃04⁃092016⁃04⁃092016⁃04⁃09临床症状Clinicalsigns发热Fever有Yes有Yes有Yes有Yes有Yes头痛Headache有Yes有Yes无No有Yes有Yes关节痛Arthralgia无No有Yes无No无No有Yes黄疸Jaundice无No无No无No无No无No恶心Nausea无No是Yes无No无No无No呕吐Vomit无No是Yes无No无No无No血液学检查Hematologicalexamination白细胞Leukocyte(10E9cells/L)5 52 210 35 86 5血小板Platelet(10E9cells/L)204106320266373中性粒比率Ratioofneutrophils(%)51 061 472 145 253 1凝血功能Coagulation正常Normal正常Normal异常Abnormal异常Abnormal正常Normal生化检查Chemicalexamination总胆红数Totalbilirubin(μmol/L)155 419 1NANA丙氨酸氨基转移酶Alaninetransaminase(Unit/L)81127513978259天冬氨酸转氨酶Aspartateaminotransferase(Unit/L)491295756061γ谷氨酰基转移酶γ⁃gultamyltransferase(Unit/L)11992121NA177
注:血液和生化检查结果为病例在定点医院隔离期间检查结果。NA:未知
Note:The hematological and chemical examinations were performed during the time patients quarantined in designated hospital. NA: not available
YFV属于黄病毒科(Flaviviridae)黄病毒属(Flavivirusgenus)成员。根据病毒的进化关系以及地域分布,YFV至少可以分为7种基因型[3-5]。其中基因II型Asibi株已用于制备疫苗并使用几十年[6]。YFV感染可导致病毒血症,因此,世界卫生组织(WHO)推荐使用病例血清标本作为病毒核酸检测材料,并以此作为病例诊断依据之一[7-8]。然而,YFV感染者病毒血症期相对较短,仅能维持十天左右。同时有报道表明,减毒活疫苗接种同样可能导致病毒血症,因此在应用核酸检测方法开展实验室诊断过程中,对检测结果判定应十分谨慎[9]。本研究应用常规RT-PCR、基因测序、限制性片段长度多态性(Restrictive fragment length polymorphism,RFLP)等方法,从2016年自安哥拉回国的人员中血液和尿液标本中检测出Angola-71型YFV,为病例的及时诊断和实施预防控制提供了可靠依据。
1 材料与方法
表2rRT-PCR法从不同标本中检测YFV核酸的检出时间
Tab.2Specimens, time-point of sampling, and nucleotide acid detection of YFV by real time RT-PCR method

病例Case标本Sample采样时间(发病后,天)#Intervaltimesbetweenillnessonsetandsampling(days)123456789101112131415161718192021221血清Sera++⁃⁃尿液UreaNSNS++2血清Sera++⁃⁃尿液UreaNS+++3血清Sera⁃⁃尿液Urea++4血清Sera⁃⁃尿液Urea++5血清Sera⁃⁃⁃尿液Urea+++
注: 阳性和阴性检测结果分别以+/-表示;NS表示未采样。
Note: The plus and minus symbols denoted to the positive and negative of nucleotide acid detection respectively. NS: not sampled
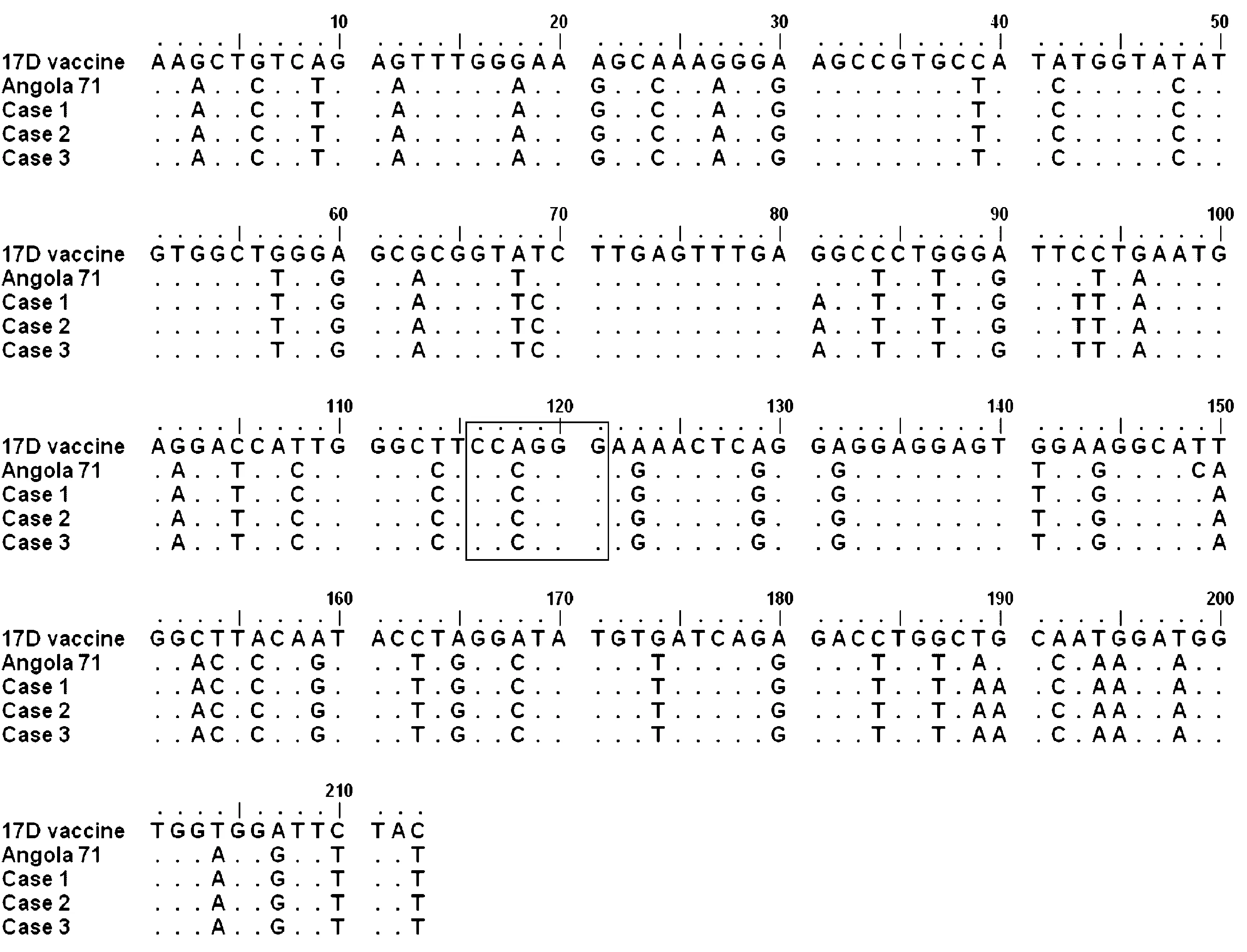
各序列来源:17D vaccine(北京天坛)扩增和测序结果,Angola为Genbank下载(AY968064),Case1-3为病例1-3标本的扩增和测序结果。图内方框表示SmaI内切酶位点图1 YF病例与疫苗株216扩增片段的序列比较The sequences of 17D vaccine strain and the viruses from case 1-3 were sequenced in this study, and that of Agola strain (AY968064) downloaded from Genbank. The frame in aligned sequences indicated the Smal I siteFig.1 Comparison of YFV sequences of 216bp fragment from YF cases and vaccine strain
1.1病例信息、临床数据和标本病例人口学、旅行史和免疫史等资料均通过现场流行病学调查获得;病例的临床、生化检测等结果来自福建医科大学附属孟超肝胆医院(YF定点收治医院)病案资料(见表1)。病例首次标本(血清或尿液)于病例入境后首诊当日或次日(病例3)采集,病例发病与首次采样时间间隔分别为3、3、9、12、16 d(见表2)。首次标本采集后,间隔不同天数继续采集患者血清和尿液标本。所有标本采集后,均于-4 ℃条件下送至福建省疾病预防控制中心检测。标本采集均获得患者知情同意 ,本研究通过福建医科大学附属孟超肝胆医院伦理委员会审查通过。
1.2试剂病毒核酸提取试剂QIAamp viral RNA mini kit及一步法通用Real time RT-PCR(rRT-PCR)试剂均购置Qiagen公司,一步法RT-PCR试剂以及Bigdye 3.1 cycling sequencing测序试剂均采购自Life technologies公司,其他试剂为实验室常规试剂。中国疾病预防控制中心提供常规实时RT-PCR引物和探针。黄病毒属通用引物[10-11](MA:5′-CATGATGGGRAARAGRGARRAG-3′,cFD2:5′-GTGTCCCAGCCGGCGGTGTCATCAGC-3′)由上海生工合成。黄热病17D减毒活疫苗购自天坛生物有限公司。
1.3实时荧光RT-PCR病毒RNA提取按试剂操作说明,特异性rRT-PCR扩增体系包括无RNase去离子水5.25 μl、2×反应体系混合物12.5 μl、正反向引物(10 μmol/L)各0.5 μl、探针(10 μmol/L) 0.25 μl、酶混合物1 μl、病毒RNA模板5 μl。反应条件为50 ℃ 30 min; 95 ℃ 10 min; 94 ℃ 15 s、 60 ℃ 45 s,共45个循环。CT值小于等于35判为阳性。
1.4病毒基因片段的扩增和测序采用反转录套式RT-PCR扩增部分病毒基因片段,第一轮反应体系包括无RNase去离子水32 μl、10×RT-PCR缓冲液5 μl、dNTP (10 mmol/L) 2 μl、MA 和 cFD2 引物 (10 μmol/L)各2 μl、酶混合液2 μl、RNA 模板5 μl。反应条件为:50 ℃ 30 min; 95 ℃ 15 min; 94 ℃ 1 min、53 ℃ 30 s、72 ℃ 1 min,共30个循环;72 ℃延伸5 min。第二轮反应条件为去离子水31 μl、10×反应缓冲液5 μl、dNTP (2.5 mmol/L each) 4 μl、ExTaq 聚合酶 (TaKaRa) 1 μl, MA和cFD2引物(10 μmol/L) 各2 μl,最后加入5 μl 40倍稀释的第一轮产物为模板。反应条件为:95 ℃ 5 min; 94 ℃ 30 s、53 ℃ 30 s、72 ℃ 1 min,共30 循环;72 ℃延伸5 min。取40 μl 套式反应产物经琼脂糖凝胶电泳后纯化,使用Bigdye 3.1 试剂盒(Life Technologies)及MA与cFD2 引物,按说明书操作,ABI3500 测序仪测序。
1.5RFLP在病毒序列比较基础上,应用RFLP法进行病毒野生株和疫苗株的快速鉴别。取反转录套式RT-PCR反应产物10 μl,加入10×SmaI限制性内切酶缓冲液1.5 μl,去离子水2.5 μl,SmaI(10 U/μl)1 μl,37 ℃消化30 min后,2%琼脂糖凝胶电泳。
2 结果
2.1实时RT-PCR检测在首次采集的血液和尿液标本中,有2例血液标本检测阳性,3例尿液标本检测阳性。持续采样检测结果显示,尿液标本中的病毒存在时间较血液中更长。在所有采集的标本中,血液中病毒存在时间最长为发病后8 d(病例1),而尿液中病毒存在时间最长为发病后22 d(病例5)。不同病例的采样时间、样本类型及检测结果见表2。
2.2病毒基因片段扩增及测序应用黄病毒属通用引物MA和cFD2,从所有病例的血清或尿液标本中均扩增出261 bp片段。病例1-3扩增产物的测序结果表明,病毒核酸序列的一致性为100%,见图1。与GenBank中序列比对结果表明,与片段序列最为相似的病毒为YFV Angola-71株(序列号:AY968064),序列一致性为98%。
2.3RFLP分析病例1-3标本扩增的片段序列与17D疫苗株序列比较发现,3例输入性病例感染的病毒序列中存在SmaI内切酶位点(图1),而在17D疫苗株及其衍生株(17DD、17D-204、17D-213等)的对应序列中,均未发现该位点。采用SmaI内切酶对病例4尿液中扩增的产物进行了酶切消化,可见该扩增片段可被酶切成大小约为140 bp 和 121 bp两个片段,病例5扩增产物酶切结果与此类似,而对应的17D疫苗株则无法被该内切酶消化。
3 讨论
YFV感染后可产生病毒血症,因此WHO推荐采用血清标本作为实验室诊断材料[9]。然而在该起境外输入YF病例疫情事件中,应用实时rRT-PCR法,本研究只能从2例发病1周内的病例血清标本中检出病毒特异性核酸,其他3例发病超过1周的病例血清样本检测结果则为阴性。以往曾有自疫苗接种者尿液中检出病毒核酸的报道[12],因此,本研究尝试利用病例的尿液标本作为检测材料,结果表明,3例血清检测阴性病例以及2例血清检测阳性的病例尿液中均可检出病毒特异性核酸,并且病毒在尿液中检出的时间可长达22 d(病例5)。此结果提示,在YFV感染的实验室检测中,除了可应用血清标本外,还可使用尿液作为检测材料,并且后者可检出病毒的时间较前者更长。
YF是一种法定报告的国际卫生检疫传染病,境外YF病例输入是重大公共卫生事件,因此对实验室检测结果的判读必需十分谨慎。在该起疫情中,所有病例的临床表现均较轻微,未见有明显的内脏或神经系统损伤,且病例均有疫苗接种史(表1)。为排除疫苗接种后可能出现的接种副反应[10-11,13],同时排除因疫苗接种后,血液等检材中存在疫苗株病毒而出现的假阳性结果,本研究扩增了病毒部分基因片段进行测序分析,并利用序列分析结果发展RFLP方法,证明了该起疫情系Angola-71样病毒感染引起,从而为后续可能输入的病例提供了快速、可靠的检测方法,并显著提高了检测时效。
本次疫情确诊的5例YF病例中,有4例系在安哥拉黄热病暴发疫情发生期间,因居住地周边出现病例,担心感染而在发病1周前后曾接种疫苗。疫苗接种后感染野生型YFV的原因推测与疫苗接种时间较短有关,一般认为,YF疫苗接种后1周左右产生IgM抗体,约两周左右才能产生中和抗体。而上述病例在安哥拉期间,居住周边环境条件普遍较差,均有蚊虫叮咬史,因此推测病例在疫苗接种前后感染YFV,而在此阶段,病例虽接种疫苗,但体内产生特异性中和抗体水平尚不足以提供有效保护。
17D YFV减毒活疫苗是最有效的疫苗之一。单剂次接种即可提供终身的免疫保护而无需加强免疫[14]。疫苗接种失败的案例极为罕见。然而,值得注意的是,在本次疫情中,1例病例(病例3)在发病前5年即接种过17D疫苗(2011年3月9日),并能追溯到接种记录。根据WHO的立场文件[15],导致YFV疫苗接种失败的因素包括接种时妊娠、HIV感染以及营养不良等。根据流行病学调查以及实验室检测,本研究排除该病例HIV感染和营养不良的可能;但回顾性调查发现,该病例接种时正处于妊娠期,因此推测,该病例发生野生型YFV感染的原因可能系妊娠导致疫苗接种失败所致。此现象提示,在今后疫苗接种过程中,需详细了解病例的接种适应症,避免导致可能的接种失败或严重不良反应。
此次疫情系国内首次境外YF输入事件。由于埃及伊蚊等YF传播媒介在中国分布广泛,同时有些地区存在大量的免疫空白人群,因此有理由担心输入性病例可能导致在国内的传播扩散。在不断增长的国内外交流和经济来往日益密切的今天,为有效预防控制YF等虫媒病毒病的输入以及可能导致的本土扩散,亟需加强病例监测、出入境检疫、媒介控制等防控措施。
[1] Monath TP, Vasconcelos PF. Yellow fever[J]. J Clin Virol, 2015, 64(2015):160-173. doi: 10.1016/j.jcv.2014.08.030.
[2] Monath TP. Treatment of yellow fever[J]. Antiviral Res., 2008, 78(1):116-124. doi:10.1016/j.antiviral.2007.10.009.
[3] Mutebi JP, Wang H, Li L, et al. Phylogenetic and evolutionary relationships among yellow fever virus isolates in Africa[J]. J Virol, 2001, 75(15):6999-7008. doi: 10.1128/JVI.75.15.6999-7008.2001.
[4] Von Lindern JJ, Aroner S, Barrett ND, et al. Genome analysis and phylogenetic relationships between east, central and west African isolates of Yellow fever virus[J]. J Gen Virol, 2006, 87(Pt 4):895-907. doi:10.1099/vir.0.81236-0.
[5] Wang E, Weaver SC, Shope RE, et al. Genetic variation in yellow fever virus: duplication in the 3′ noncoding region of strains from Africa[J]. Virology, 1996, 225(2):274-281. doi:10.1006/viro.1996.0601.
[6] Monath TP. Yellow fever vaccine[J]. Expert Rev Vaccines, 2005, 4(4):553-574. doi:10.1586/14760584.4.4.553.
[7] Domingo C, Patel P, Yillah J, et al. Advanced yellow fever virus genome detection in point-of-care facilities and reference laboratories[J]. J Clin Microbiol, 2012, 50(12):4054-4060. doi:10.1128/JCM.01799-12.
[8] Nunes MR, Palacios G, Nunes KN, et al. Evaluation of two molecular methods for the detection of Yellow fever virus genome[J]. J Virol Methods, 2011, 174(1-2):29-34. doi:10.1016/j.jviromet.2011.02.025.
[9] WHO. Yellow fever laboratory diagnostic testing in Africa, Interim guidence.,2016. http://apps.who.int/iris/bitstream/10665/246226/1/WHO-OHE-YF-LAB-16.1-eng.pdf.
[10] Gerin M, Wroblewski I, Bost-Bru C, et al. YEL-AND meningoencephalitis in a 4-year-old boy consecutive to a yellow-fever vaccine[J]. Arch Pediatr, 2014, 21(4):384-387. doi: 10.1016/j.arcped.2014.01.014.
[11] Leung WS, Chan MC, Chik SH, et al. First case of yellow fever vaccine-associated viscerotropic disease (YEL-AVD) in Hong Kong[J]. J Travel Med, 2016, 23(4):1-3. doi:10.1093/jtm/taw020.
[12] Domingo C, Yactayo S, Agbenu E, et al. Detection of yellow fever 17D genome in urine [J]. J Clini Microbiol, 2011, 49(2):760-762. doi: 10.1128/JCM.01775-10.
[13] Lindsey NP, Schroeder BA, Miller ER, et al. Adverse event reports following yellow fever vaccination[J]. Vaccine, 2008, 26(48):6077-6082. doi:10.1016/j.vaccine.2008.09.009.
[14] Wieten RW, Jonker EF, Van Leeuwen EM, et al. A Single 17D Yellow Fever Vaccination Provides Lifelong Immunity; Characterization of Yellow-Fever-Specific Neutralizing Antibody and T-Cell Responses after Vaccination[J]. PloS One, 2016, 11(3):e0149871. doi: 10.1371/journal.pone.0149871.
[15] WHO. Vaccines and vaccination against yellow fever. WHO position paper, 2013-recommendations. Vaccine, 2015, 33(1):76-77. doi:10.1016/j.vaccine.2014.05.040.
2017-06-04)
(本文编辑:唐浏英)
MoleculardiagnosisofyellowfeverimportedintoFujianprovince,2016
WengYuwei,WangJinzhang,ZhangYongjun,OuJianming,HongRongtao,GuanShengcan,LinZhong,HanLifeng,ZhengKuicheng,WangLinglan,YanYansheng
FujianCenterforDiseaseControlandPrevention,FujianProvincialKeyLaboratoryofZoonosis,Fuzhou350001,China(WengYW,WangJZ,ZhangYJ,OuJM,HongRT,LinZ,ZhengKC,WangLL,YanYS);FuzhouMengchaoHepatobiliaryHospitalofFujianMedicalUniversity.Fuzhou350025,China(GuanSC,HanLF)
WengYuwei,Email:wengywfjcdc@aliyun.com
ObjectiveTo make laboratorial diagnosis of imported yellow fever (YF) cases in Fujian province with molecular method .MethodsSerum and urine samples were collected from suspected cases at various time-points post illness onset. Real-time RT-PCR and nested RT-PCR were performed respectively for viral specific nucleotide detection and fragment amplification. Sequencing and restrictive fragment length polymorphism (RFLP) method were used to identify the wild virus infection.ResultsA total of five cases with wild yellow fever virus (YFV) infection were confirmed in this study. It revealed that the viral agent belonged to Angola-71 like YFV, and the duration of viral agent in urine was longer than that in serum.ConclusionsSimultaneous detection of serum and urine samples would increase detection sensitivity, and further RFLP method contributed to rapid identification of wild YFV infection and exclusion of positive result due to recent vaccination.
Yellow fever; Imported case; Molecular diagnosis; Vaccine
翁育伟,Email: wengywfjcdc@aliyun.com
10.3760/cma.j.issn.1003-9279.2017.05.014
黄热病;病例,输入性;分子诊断;疫苗
国家高技术研究发展计划(2011AA02A114);国家重大科技专项(2012ZX10004-210-003);福建省医学创新课题(2015-CXB-13)
FundprogramsNational Hi-tech Research and Development Project (2011AA02A114);National Major Scientific and Technological Project (2012ZX10004-210-003);Fujian Provincial Medical Innovation Project (2015-CXB-13)
