河北省2015—2016年诺如病毒感染性腹泻疫情的病原分子特征分析
2017-11-20刘莹莹于秋丽苏通赵文娜谢赟鲍文齐顺祥
刘莹莹 于秋丽 苏通 赵文娜 谢赟 鲍文 齐顺祥
050021 石家庄,河北省疾病预防控制中心
河北省2015—2016年诺如病毒感染性腹泻疫情的病原分子特征分析
刘莹莹 于秋丽 苏通 赵文娜 谢赟 鲍文 齐顺祥
050021 石家庄,河北省疾病预防控制中心
目的了解河北省诺如病毒(Norovirus, NoV)感染性腹泻疫情的病原流行特点及基因型变异情况。方法收集2015年1月至2016年12月间,共8起感染性腹泻疫情临床标本和相关临床信息,采用实时荧光RT-PCR法检测NoV核酸,阳性标本经传统RT-PCR扩增衣壳蛋白区部分序列进行测序和系统进化分析。结果河北省2015年1月至2016年12月间共发生8起腹泻疫情,病例265例,7起疫情中检测到NoV核酸阳性病例53例,检出率66.25%,罹患率波动在0.70%~8.13%,主要为小区居民、幼儿及学生。成功测序分型28份标本,基因型包括GⅠ.3型、GⅡ.2型、GⅡ.4型、GⅡ.13型和GⅡ.17型。结论河北省NoV感染性腹泻疫情呈现病毒基因型多样性。
诺如病毒(Norovirus,NoV)是导致全球急性胃肠炎散发和暴发的主要致病原之一,根据NoV聚合酶和结构蛋白氨基酸序列同源性,将NoV分为GⅠ~GⅦ共7 组和至少36种不同的基因型[1],可感染人类的包括GⅠ、GⅡ 和GⅣ 组毒株,其中GⅠ有8个基因型(GⅠ.1~GⅠ.8),GⅡ至少有21个基因型(GⅡ.1~GⅡ.21)。
NoV变异快和环境中稳定的特点使其每隔几年就有新变异株出现,不同国家和地区的NoV在不同时间流行的病毒株系不同,可进化逃避人群的免疫压力,使其具有导致全球每2~3年周期性流行的潜能[2]。GⅡ.4基因型一直占据全球NoV暴发疫情的主导地位。2012年冬,世界多个国家和地区的NoV监测网均监测到NoV的高位流行,检出了GⅡ.4/Sydney_2012新型变异株[3];2014—2015年,GⅡ.17型代替了GⅡ.4型,成为亚洲部分地区的NoV暴发的主要病原体[4];2016年底,我国以及德国、法国、日本等同期相继报道了由重组NoV GⅡ.P16/GⅡ.2型导致的暴发疫情或感染病例[1, 4],提示该型NoV有成为全球流行株的可能性。因此,详细了解我省NoV感染性腹泻疫情的病原流行特点及基因型演化情况,对采取有效预防措施控制NoV感染和暴发具有重大意义。
1 材料与方法
1.1资料来源收集河北省2015年1月至2016年12月间共8起NoV感染疑似聚集性/聚集性/暴发疫情处置资料。疑似聚集性疫情、聚集性疫情及暴发疫情定义详见《诺如病毒感染暴发调查和预防控制技术指南(2015版)》[5]。
1.2病例搜索采用中国疾病预防控制中心编制的“诺如病毒急性胃肠炎暴发疫情个案调查表”,病例定义[5]为:急性胃肠炎病例,24 h内出现排便≥3 次且有性状改变(呈稀水样便),和/或24 h 内出现呕吐≥2 次者。
1.3标本采集及检测疫情现场采集患者粪便/肛拭子和呕吐物标本,置于病毒采样管内,-4 ℃条件下运输,置-80 ℃冷柜保存待检。
采用美国Promega公司Maxwell©16 Tissue LEV Total RNA Purification Kit试剂盒提取RNA,按试剂盒说明书操作。使用NoV GⅠ/GⅡ核酸检测试剂盒(荧光定量PCR法,江苏硕世生物科技有限公司)检测,反应体系参照试剂盒说明。反应在ABI 7500荧光定量PCR仪上进行。
核酸阳性标本采用美国Invitrogen公司SuperScript©Ⅲ Reverse Transcriptase进行反转录。应用Promega公司GoTaq©Colorless Master Mix体系,进行RT-PCR扩增。引物序列见《诺如病毒感染暴发调查和预防控制技术指南(2015版)》[5],由生工生物工程(上海)股份有限公司合成,具体反应步骤参照试剂盒说明。
1.4序列测定与分析PCR阳性产物送生工生物工程(上海)股份有限公司纯化和测序。根据NoV衣壳蛋白区的核苷酸序列对病毒进行基因分型,采用DNAStar、Mega5.2等生物信息学软件对序列进行同源性比较和构建系统进化树。进化树中所有参考株序列均来自源于GenBank 数据库。
2 结果
2.1疫情概况河北省2015年1月至2016年12月间共发生8起腹泻暴发/聚集(疑似聚集性)疫情,其中,2015年5起,2016年3起,波及人口11 396人,其中病例265例,无死亡病例,罹患率波动在0.70%~8.13%。疫情流行期最短4 d,最长9 d,中位数6 d。8起疫情的分布在承德(3起)、石家庄(2起)、沧州(1起)、廊坊(1起)和保定(1起)。疫情发生地点分别为4个住宅小区、2 所幼儿园和2所中学。病例主要为小区居民(63.02%, 167/265),其次为幼儿(19.24%, 51/265)及学生(17.74%, 47/265)。疫情主要发生在4月至6月和12月,病例的主要临床表现有腹痛(100%)、腹泻(87.79%)、恶心呕吐(48.09%)、发热(10.69%)等。
2.2实验室检测结果采集8起疫情中患者粪便/肛拭子和呕吐物标本共计80份,其中7起疫情检测到NoV核酸阳性标本共53份,阳性检出率66.25%,其中GⅠ 4份(7.55%, 4/53份),GⅡ 48份(90.56%, 48/53份),其中2015年沧州的一起疫情检测GⅠ+GⅡ混合感染1份(1.89%, 1/53份),并成功测得28株NoV株序列,见表1。
2.3同源性及进化树分析系统进化分析显示,本研究测得的28株NoV株序列分别分布在GI.3c型、GⅡ.2型、GⅡ.4 Sydney型、GⅡ.13型和GⅡ.17型分支上(图1)。
3株GI.3c型毒株来自沧州华油疫情,同源性达到98.9%~99.3%,与2013 年山东株的亲缘关系较近,同源性达到98.6%~100.0%。
GII.2型7株,其中6株来自廊坊广阳疫情,同源性达到99.2%~100.0%,与2016年中国(广东、香港)、法国等新报道的GⅡ.P16/GⅡ.2型病毒株亲缘关系较近,同源性高达98.6%~98.9%,而来自保定高碑店疫情的1株毒株,则与2013年山东株GⅡ.2型的亲缘关系较近,同源性为96.1%,两起疫情毒株的同源性为94.4%~95.3%。2016年中国(广东、香港)、法国等新报道的GⅡ.P16/GⅡ.2型病毒株与2013年GⅡ.2型的山东株的同源性为96.8%~97.9%。
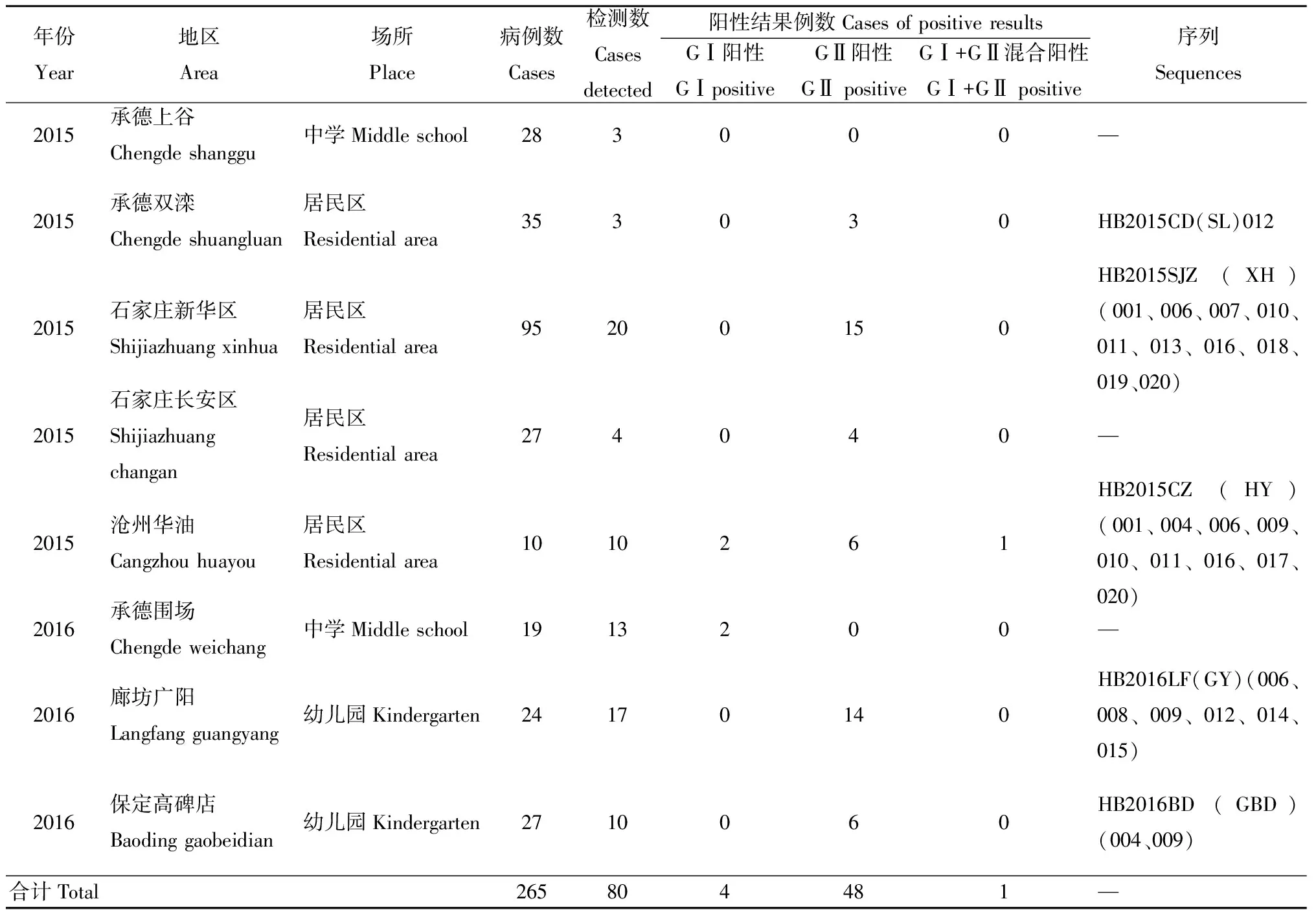
表1 2015—2016年8起诺如病毒感染性腹泻疫情核酸检测阳性结果
保定高碑店疫情1株GII.4/Sydney_2012新型变异株,与2014 年的安徽株和2016 年的中国台湾株亲缘关系较近,同源性达到94.0%~94.7%。
GII.13型3株,2株来自沧州华油疫情,同源性为99.6%,与来自承德双滦区疫情的1株同源性达到99.6%~100.0%, 两起疫情毒株均与2013年的山东株和2010年的尼泊尔株亲缘关系较近,同源性达96.9%~100.0%。
GII.17型14株,其中4株来自沧州华油疫情,同源性达到99.6%~100.0%,其余10株来自石家庄新华区疫情,同源性100.0%,两起疫情毒株的同源性达到99.6%~100%,与2014—2016年中国(北京、广州、香港、台湾)、美国及韩国报道的各毒株亲缘关系均较近,同源性达到96.3%~100.0%。
3 讨论
以往报道的资料表明,NoV具有感染剂量低和传染性强等特点,可在空间相对封闭的情况下迅速传播,常引起急性胃肠炎暴发流行,其所带来的社会恐慌和社会经济负担巨大[3]。2015年1月至2016年12月间,河北省共发生8起NoV感染性腹泻疫情,发生地点主要在居民区、幼儿园和中学,与其他国家和地区的相关报道较为相近[6-9]。其中7起疫情检出NoV核酸阳性标本53份,阳性检出率66.25%,确定这些疫情均为NoV感染所致。
本研究经测序成功分型28份标本,基因型包括GI.3型、GⅡ.2型、GⅡ.4型、GⅡ.13型和GⅡ.17型。2015年1月至2016年12月间,河北省大部分胃肠炎疫情均由单一型别引起,有2起疫情检测出至少两种型别毒株,2015年沧州疫情分别检测出GⅠ.3型、GⅡ.13型和GⅡ.17型,2016年保定疫情检测出GⅡ.2型和GⅡ.4型两种型别,表明NoV感染性腹泻疫情具有基因型多样性。但由于每起疫情成功测到的序列较少,只能说明可能存在多种型别的NoV感染,而不能完全确证是哪种型别为主而导致的疫情,或者不排除其中某种型别仅属于散发。NoV复杂多变的基因型对疾病防控措施是一个很大的挑战,所以更加需要完善NoV感染性腹泻监测网络,加强长期病原学监测,及时发现流行型别的动态变化及变异变迁规律。
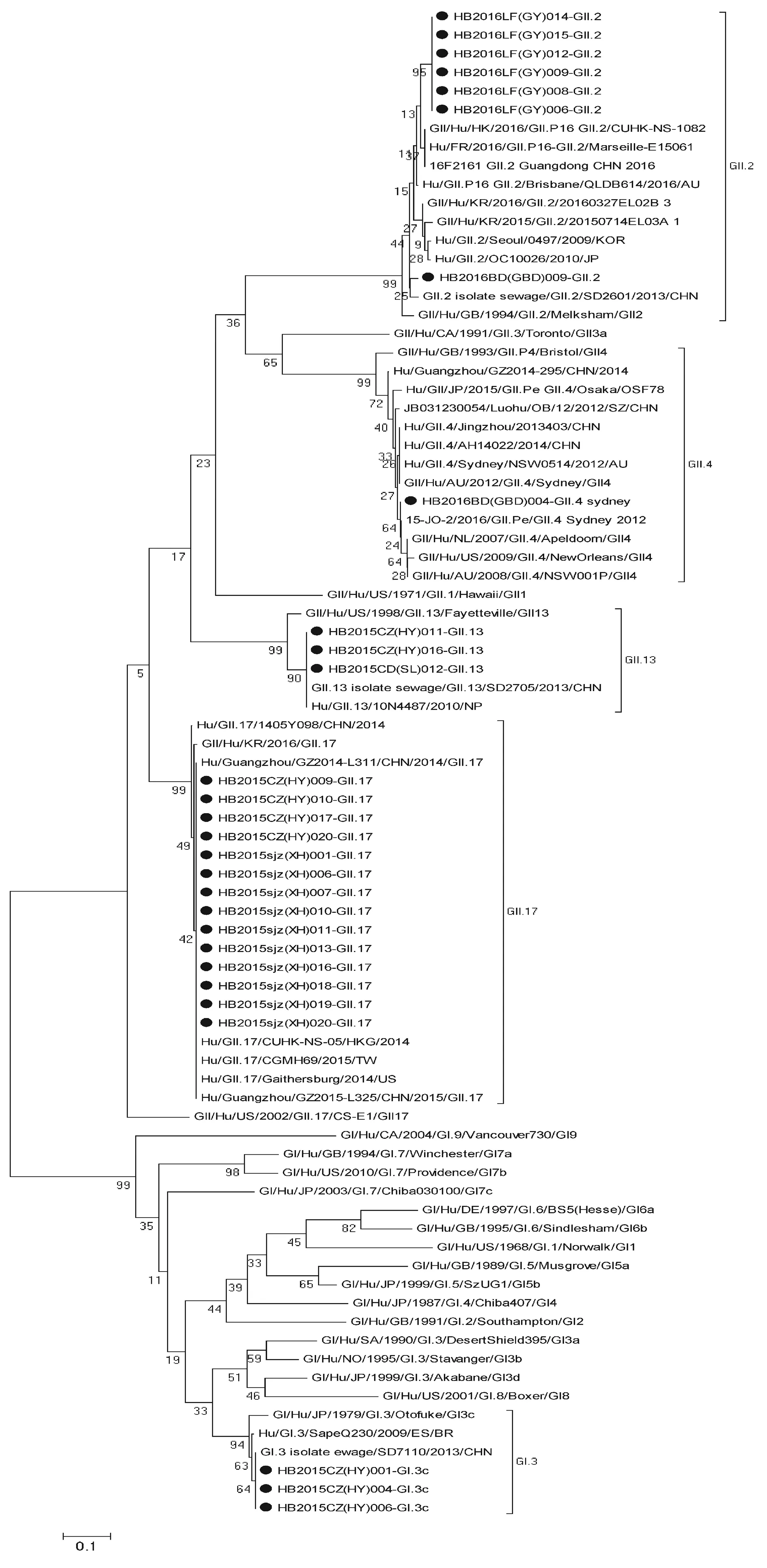
注:● 表示河北毒株图1 NoV ORF2区核苷酸序列系统进化树Note: ● indicates Hebei virus strainsFig.1 Phylogenetic tree based on partial ORF2 gene sequences from NoV strains
[1] Ao Y, Wang J, Ling H, et al. Norovirus GⅡ.P16/GⅡ.2-associated gastroenteritis, China, 2016[J]. Emerg Infect Dis, 2017, 23(7):1172-1175. doi: 10.3201/eid2307.170034.
[2] Patel MM, Hall AJ, Vinjé J, et al. Noroviruses: a comprehensive review[J]. J Clin Virol, 2009, 44(1): 1-8. doi: 10.1016/j.jcv.2008.10.009.
[3] Van Beek J, Ambert-Balay K, Botteldoorn N, et al. Indications for worldwide increased norovirus activity associated with emergence of a new variant of genotype II.4, late 2012[J]. Euro Surveill, 2013,18(1):8-9.
[4] Jin M, Zhou YK, Xie HP, et al. Characterization of the new GII.17 norovirus variant that emerged recently as the predominant strain in China[J]. J Gen Virol, 2016, 97(10):2620-2632. doi: 10.1099/jgv.0.000582.
[5] 廖巧红, 冉陆, 靳淼, 等. 诺如病毒感染暴发调查和预防控制技术指南(2015版)[J]. 中国病毒病杂志, 2015, 5 (6):448-458. doi:10.3760/cma.j.issn.0253-9624.2016.01.003.
[6] 靳淼, 孙军玲, 常昭瑞, 等. 中国2006-2007 年诺如病毒胃肠炎暴发及其病原学特征分析[J]. 中华流行病学杂志, 2010, 31(5): 549-553. doi: 10.3760/cma.j.issn.0254-6450.2010. 05.017.
[7] Chan MC, Chan PK. Complete genome sequence of a novel recombinant human norovirus genogroup II genotype 4 strain associated with an epidemic during summer of 2012 in Hong Kong[J]. Genome Announc, 2013, 1(1):e00140-12. doi: 10.1128/genomeA.00140-12.
[8] Hen Z, Qian F, Li Y, et al. Novel norovirus GⅡ.4 variant, Shanghai, China, 2012[J]. Emerg Infect Dis, 2013, 19(8): 1337-1339. doi: 10.3201/eid1908.130026.
[9] 史永林, 孔翔羽, 靳淼, 等. 安徽省诺如病毒胃肠炎暴发的分子病原学特征研究[J]. 中华实验和临床病毒学杂志, 2015, 29(4): 310-312. doi: 10.3760/cma.j.issn.1003-9279. 2015.04.007.
2017-03-28)
(本文编辑:吕新军)
AnalysisofmolecularcharacteristicsofaggregationepidemicinducedbynorovirusinfectioninHebeiprovince,2015-2016
LiuYingying,YuQiuli,SuTong,ZhaoWenna,XieYun,BaoWen,QiShunxiang
HebeiProvincialCenterforDiseaseControlandPrevention,Shijiazhuang050021,China
QiShunxiang,Email:hbcdc999@163.com
ObjectiveTo understand epidemiological characteristics of the pathogens and evolution of the genotype associated with infectious diarrhea epidemic caused by norovirus in Hebei Province.MethodsA total of 8 infectious diarrhea outbreaks caused by norovirus were reported from Jan 2015 to Dec 2016, of which epidemic treatment materials and specimens were collected at the same time. Norovirus nucleic acid was detected by using real-time PCR, and the partial ORF2 of the all positive specimens were amplified by RT-PCR and sequenced. Phylogenetic tree was constructed by using Mega5.2 based on partial ORF2 sequences of norovirus to perform phylogenetic analysis.ResultsA total of 8 norovirus outbreaks, involving 265 cases who were mainly for residential inhabitents, children and students, were reported during this period, and the overall attack rate ranged from 0.70% to 8.13%. The overall positive detection rate of norovirus was 66.25%. The PCR products were sequenced,and sequencing result were obtained for 28 samples, which included GⅠ.3, GⅡ.2, GⅡ.4, GⅡ.13 and GⅡ.17.ConclusionsMultiple genotypes of infectious diarrhea outbreaks caused by norovirus were found in Hebei province.
Norovirus; Outbreaks; Genotypes; Molecular characteristics
齐顺祥,Email: hbcdc999@163.com
10.3760/cma.j.issn.1003-9279.2017.05.012
诺如病毒;暴发;基因型;分子特征
国家“十二五”重大科技专项子课题(2013ZX10004202);河北省科技支撑计划项目(14277761D);河北省医学科学研究重点课题(20160059)
FundprogramsNational Science and Technology Major Project of China (2013ZX10004202); The Science and Technology Support Project of Hebei Province (14277761D); Major Medical and Scientific Research Projects of Hebei Province (20160059)
