日粮添加亮氨酸和苯丙氨酸对荷斯坦公犊生长性能及血清代谢物的影响
2017-11-18杨昕涧曹阳春郑辰刘凯郭龙蔡传江刘宝龙姚军虎
杨昕涧,曹阳春,郑辰,刘凯,郭龙,蔡传江,刘宝龙,姚军虎
日粮添加亮氨酸和苯丙氨酸对荷斯坦公犊生长性能及血清代谢物的影响
杨昕涧,曹阳春,郑辰,刘凯,郭龙,蔡传江,刘宝龙,姚军虎
(西北农林科技大学动物科技学院,陕西杨凌712100)
研究日粮添加亮氨酸和苯丙氨酸对犊牛生长性能和血清代谢物的影响,为亮氨酸和苯丙氨酸在奶牛高效生产中的应用提供理论参考。试验选取20头1日龄体重为(38±3)kg的荷斯坦公犊,随机分为4组,分别为对照组、亮氨酸组(1.435 g·L-1)、苯丙氨酸组(0.725 g·L-1)、混合氨基酸组(1.435 g·L-1亮氨酸和0.725 g·L-1苯丙氨酸),每组5头牛,各组以丙氨酸调节为等氮日粮。犊牛单独饲喂,试验共8周,预试期1周,正试期7周。试验犊牛单圈饲养,试验日粮由原奶和开食料组成。犊牛出生后,1 h内饲喂4.0 L初乳。此后1周为过渡期,日喂原奶2次,每次3.0 L。过渡期内以氨基酸添加量的20%为梯度逐天增加,至出生第6 天达到添加量的100%。2—8周为正试期,日饲喂添加氨基酸的原奶2次。第2—3周每次3.5 L,4—8周每次4.0 L。第3周开始定量供给开食料,自由饮水。在犊牛1、3、5、7、8周龄测定体重、体高、体斜长和胸围,计算体躯指数和体长指数;采集10 mL血液用于获得血清,并检测其氨基酸组成、葡萄糖、尿素氮、胰岛素和胆囊收缩素。采用IBM SPSS Statistics V22.0 统计软件GLM过程进行统计分析,采用LSD法进行多重比较。混合氨基酸组平均日增重显著低于其余3组(<0.05)。相对于对照组,各处理组显著提高最终体斜长(<0.05)。亮氨酸和苯丙氨酸具有降低最终体高的趋势(<0.10),而苯丙氨酸显著降低最终胸围(<0.05)。与对照组相比,亮氨酸组和混合氨基酸组显著提高犊牛8周龄体躯指数(<0.05)。但各组犊牛初始体重、体斜长、体高、胸围、体躯指数、体长指数和最终体重及体躯指数无显著差异(>0.05)。添加亮氨酸显著提高血清组氨酸、亮氨酸、苏氨酸、甘氨酸和总必需氨基酸的浓度(<0.05),趋于增加天冬氨酸和总氨酸浓度(<0.10),但显著降低丙氨酸和甘氨酸浓度(<0.05)。苯丙氨酸显著提高血清苯丙氨酸、谷氨酸和甘氨酸浓度(<0.05),对照组因添加丙氨酸调节为等氮日粮,其血清丙氨酸浓度显著高于亮氨酸组与混合氨基酸组(<0.05)。苯丙氨酸和亮氨酸对血清各种氨基酸浓度无交互效应(>0.05)。亮氨酸显著提高血清葡萄糖浓度(<0.05),苯丙氨酸降低血清葡萄糖浓度(<0.05),且与亮氨酸存在负交互效应(<0.05)。此外,苯丙氨酸显著提高血清尿素氮含量(<0.05),但亮氨酸和苯丙氨酸添加对血清中胰岛素及胆囊收缩素浓度无显著影响(>0.05)。日粮中添加亮氨酸可提高犊牛血清部分必需氨基酸、葡萄糖浓度、8周龄体躯指数和平均日增重。从以上指标可见,亮氨酸添加效果优于苯丙氨酸,但二者在影响血清葡萄糖浓度方面存在负交互效应。
亮氨酸; 苯丙氨酸; 犊牛; 生长性能; 血清代谢物
0 引言
【研究意义】亮氨酸作为一种功能性氨基酸[1],可通过激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路调控动物机体蛋白合成及分解代谢[2-3]。苯丙氨酸是芳香族氨基酸的一种,可通过钙敏感受体促进胆囊收缩素(cholecysto-kinin,CCK)的分泌[4]。CCK可促进胰腺合成胰淀粉酶、胰蛋白酶和胰蛋白酶原,并刺激胰酶释放,增强胰酶活性[5]。【前人研究进展】研究表明,日粮中添加1 g过瘤胃亮氨酸可促进绵羊骨骼肌mTOR信号通路中4E-BP1和S6K1的磷酸化,进而促进骨骼肌蛋白合成[6]。此外,亮氨酸代谢产物α-酮异己酸也可显著促进绵羊股二头肌和背最长肌的蛋白合成[7]。LIU等[8]的研究也证实亮氨酸可作为营养信号分子促进α-淀粉酶分泌,调控荷斯坦青年母牛胰腺外分泌功能,从而改善能量供应,但其是否可促进奶牛生长发育尚不清楚。YU等[9]对山羊十二指肠灌注苯丙氨酸,结果表明,苯丙氨酸可促进胰酶的分泌。胰酶分泌增多,理论上可改善动物对营养物质的利用,但其是否会影响奶牛生长性能却不得而知。【本研究切入点】初生犊牛处于高蛋白周转与骨骼肌蛋白快速合成时期。与成年牛相比,哺乳犊牛可更有效的利用氨基酸等营养物质用于自身生长发育。且此期犊牛前胃系统并未发育完全,其消化系统与单胃动物相似,摄食的牛奶可不经瘤网胃而直接到达皱胃进行初步消化,继而到达小肠被消化吸收[10],这避免了瘤网胃微生物对日粮营养组分的改变。【拟解决的关键问题】利用这一生理特性,笔者研究了亮氨酸和苯丙氨酸对奶公犊生长发育及血清代谢物的影响,以期为功能性氨基酸在奶牛生产中的应用提供理论依据。
1 材料与方法
1.1 试验时间、地点
试验于2015年4—9月在现代牧业(宝鸡)有限公司犊牛岛进行。
1.2 试验设计
试验以20头1日龄体重为(38±3)kg的荷斯坦公犊为试验对象,按体重相近原则随机分为对照组(C)、亮氨酸组(L)、苯丙氨酸组(P)、混合氨基酸组(M)4组,每组5头牛,试验期8周。
试验处理通过向原奶中添加亮氨酸和苯丙氨酸实现,并通过添加丙氨酸调节为等氮日粮。处理组添加亮氨酸和苯丙氨酸的依据参考YU等[11]和LIU等[8]的试验结果,按照本试验所测原奶中氨基酸含量,添加其基础氨基酸含量的42%,各处理添加量见表1。L-亮氨酸和L-苯丙氨酸由宁波大榭开发区海德氨基酸工业有限公司提供,纯度均为99.0%;L-丙氨酸由淮北新旗氨基酸有限公司提供,纯度为99.2%。
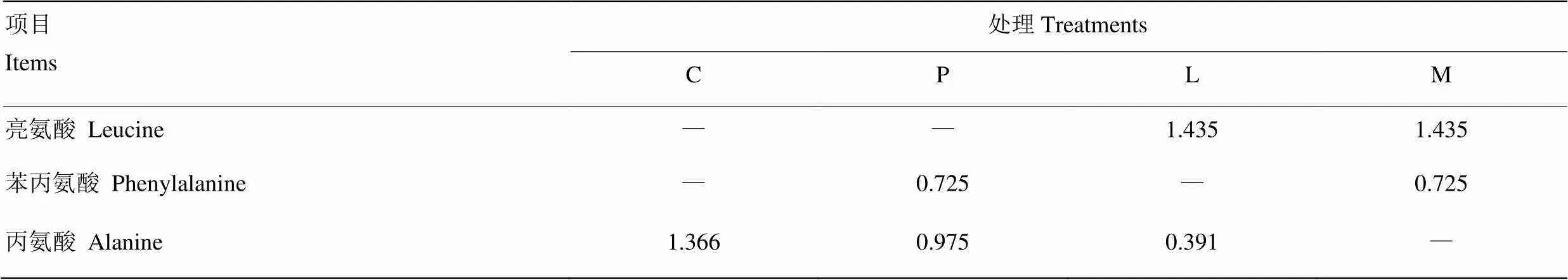
表1 原奶中氨基酸添加量
C=对照组,P=苯丙氨酸组,L=亮氨酸组,M=混合氨基酸组,所有处理组添加丙氨酸调节为等氮日粮。下同
C=milk with added alanine as control, P=milk with added phenylalanine and alanine, L=milk with added leucine and alanine, M=milk with added leucine and phenylalanine. Animal were fed with isonitrogenous diets was achieved by added alanine. the same as below
1.3 饲养管理
动物试验在现代牧业(宝鸡)有限公司犊牛岛进行,试验日粮由原奶和开食料组成。犊牛出生后,1 h内饲喂4 L初乳。此后1周为过渡期,日喂原奶2次,每次3 L。过渡期内以氨基酸添加量的10%为梯度逐天增加,至出生第6天达到添加量的100%。2—8周为正试期,日饲喂添加氨基酸的原奶2次。第2—3周每次3.5 L,4—8周每次4 L。第3周开始定量供给开食料,自由饮水。
1.4 样品采集与指标测定
1.4.1 日粮组成 普瑞纳犊牛开食料由玉米、豆粕、麦麸、甘蔗糖蜜、磷酸氢钙、石粉、食盐、L-赖氨酸、维生素A、维生素D3、维生素E、硫酸铜、硫酸亚铁等组成。干物质(dry matter,DM)、粗蛋白(crude protein,CP)、淀粉(starch)、粗灰分(crude ash)、钙(calcium,Ca)、总磷(total phosphorus,TP)和L-赖氨酸(L-lysine)测定方法参照中华人民共和国国家标准中相应的方法进行;中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量参照Van Soest等[12]方法测定。开食料化学组成见表2。每两周采集一次原奶,测定氨基酸组成,方法参照GB/T5009.124—2003。原奶中精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、缬氨酸、丙氨酸、天冬氨酸、胱氨酸、谷氨酸、酪氨酸、甘氨酸、丝氨酸和脯氨酸的含量(g·L-1,DM)分别为1.429、0.920、1.744、3.432、3.055、0.950、1.731、1.804、2.372、1.356、2.869、0.358、7.605、1.846、0.838、2.260和6.458。

表2 试验用犊牛开食料化学组成(干物质基础)
除了L-赖氨酸数据由普瑞纳提供外,其余指标均为实测值Analyzed values except L-lysine offered by Purina
1.4.2 生长性能 于晨饲前逐头称量犊牛1、3、5、7、8周龄体重、体高、体斜长和胸围,计算体躯指数和体长指数。
体躯指数(%)=胸围(cm)/体斜长(cm)×100;
体长指数(%)=体斜长(cm)/体高(cm)×100。
1.4.3 血清样品采集与测定 于犊牛1、3、5、7、8周龄,晨饲后90 min以真空采血管颈静脉采血约10 mL,37℃倾斜放置至血清析出,3 000 r/min离心15 min,收集血清于2 mL离心管中,加入抑肽酶(10 000 IU·mL-1),-80℃保存待测。检测血清葡萄糖(Glucose,Glu)、血清氨基酸组成(Amino acids,AA)、尿素氮(Serum urea nitrogen,SUN)、胰岛素(Insulin)、CCK。
血清葡萄糖于采样当日采用葡萄糖氧化酶-过氧化物酶法检测,采用葡萄糖测试盒(南京建成生物工程研究所),使用多功能酶标仪(Bio-tek SynergyTMHT,美国)测定。采用试剂盒(南京建成生物工程研究所)测定SUN、STP、Alb、Glb。采用Elisa试剂盒(Cloud-Clone Crop,美国)方法测定Insulin和CCK。
参照文献[13]的方法,略加改进后应用全自动氨基酸分析仪(日立L-8900,日本)进行AA测定。取400 μL血清于2 mL离心管中,加入40 μL正亮氨酸(5 μmol·L-1)、100 μL10%磺基水杨酸溶液和400 μL pH 2.2的柠檬酸钠缓冲液,充分混匀,置于4℃30 min,然后于4℃下10 000 r/min离心30 min,取上清,经2.2 μm水相滤膜过滤到进样瓶中,上机待测。
1.5 统计分析
试验数据用Excel 2016进行初步处理后,利用IBM SPSS Statistics V22.0 统计软件GLM过程进行统计分析,采用LSD法进行多重比较。
2 结果
2.1 亮氨酸和苯丙氨酸对奶公犊生长性能的影响
原奶中添加亮氨酸和苯丙氨酸对奶公犊生长性能的影响见表3。由表3可知,各组犊牛初始体重、体斜长、体高、胸围、体躯指数、体长指数和最终体重及体躯指数无显著差异(>0.05)。相对于对照组,各处理组显著提高最终体斜长(<0.05)。亮氨酸和苯丙氨酸具有降低最终体高的趋势(<0.10),而苯丙氨酸显著降低最终胸围(<0.05)。与对照组相比,亮氨酸组和混合氨基酸组显著提高犊牛8周龄体躯指数(<0.05)。混合氨基酸组平均日增重(Average daily gain,ADG)显著低于其余3组(<0.05)。
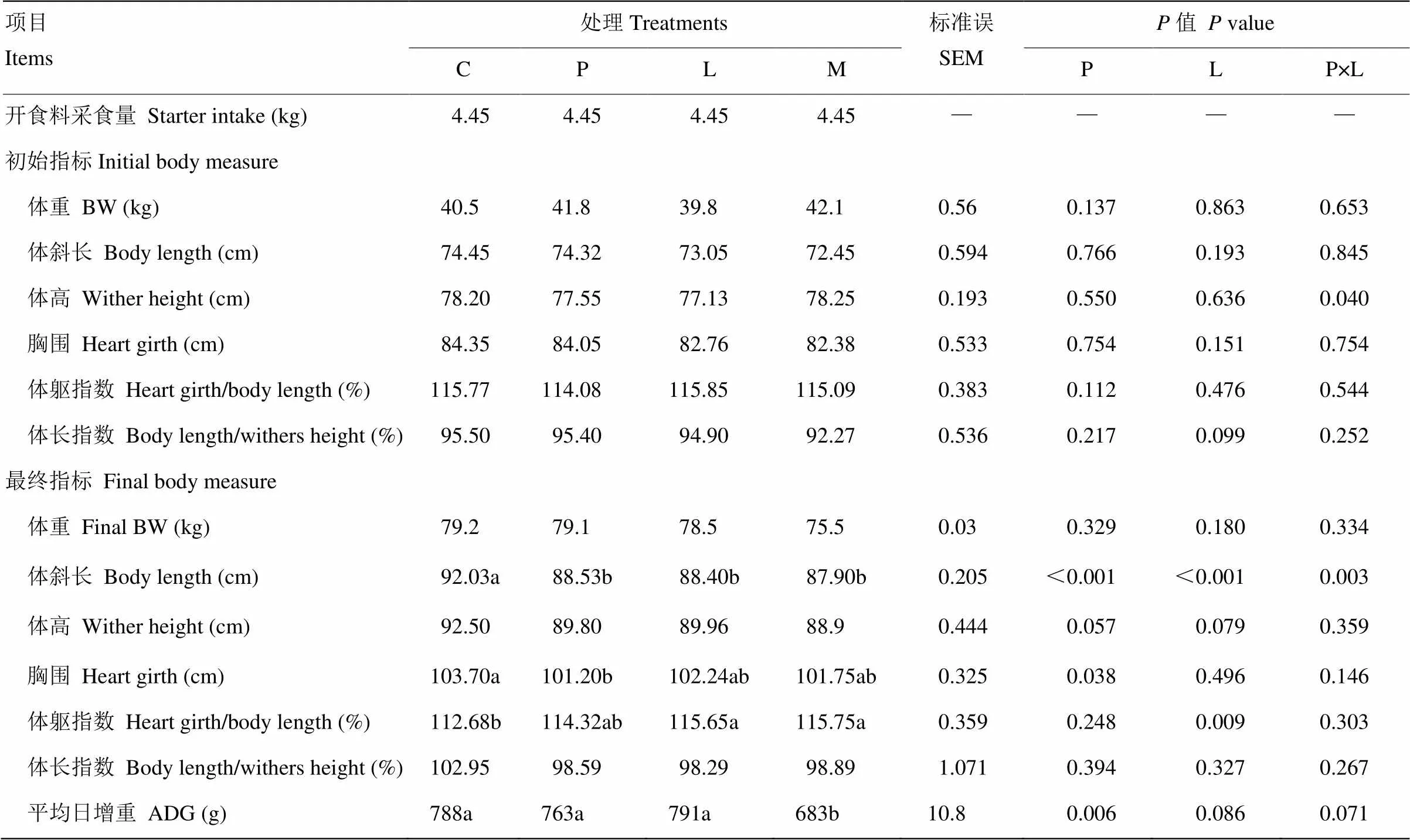
表3 原奶中添加亮氨酸和苯丙氨酸对奶公犊生长性能的影响
同行不同小写字母表示差异显著(<0.05)。下同
Different lowercases in a row indicate significantly (<0.05). The same as below
2.2 亮氨酸和苯丙氨酸对奶公犊血清氨基酸浓度的影响
表4所示为原奶中添加亮氨酸和苯丙氨酸对奶公犊血清氨基酸浓度的影响。亮氨酸显著提高血清组氨酸、亮氨酸、苏氨酸、甘氨酸和总必需氨基酸的浓度(<0.05),趋于增加天冬氨酸和总氨酸浓度(<0.10),但显著降低丙氨酸和甘氨酸浓度(<0.05)。与对照组、苯丙氨酸组和混合氨基酸组相比,亮氨酸组组氨酸浓度分别提高14.3%、20.6%和10.8%,亮氨酸浓度分别提高128.7%、127.5%和7.6%,苏氨酸浓度分别提高11.8%、13.3%和降低0.5%,甘氨酸浓度分别降低10.7%、17.2%和9.0%,总必需氨基酸浓度分别提高18.1%、15.2%和降低3.6%。苯丙氨酸显著提高血清苯丙氨酸、谷氨酸和甘氨酸浓度(<0.05),与对照组、亮氨酸组、混合氨基酸组相比,苯丙氨酸组苯丙氨酸浓度提高98.9%、81.6%和降低3.5%。对照组因添加丙氨酸调节为等氮日粮,其血清丙氨酸浓度显著高于亮氨酸组与混合添加组(<0.05)。苯丙氨酸和亮氨酸对血清各种氨基酸浓度无交互效应(>0.05)。
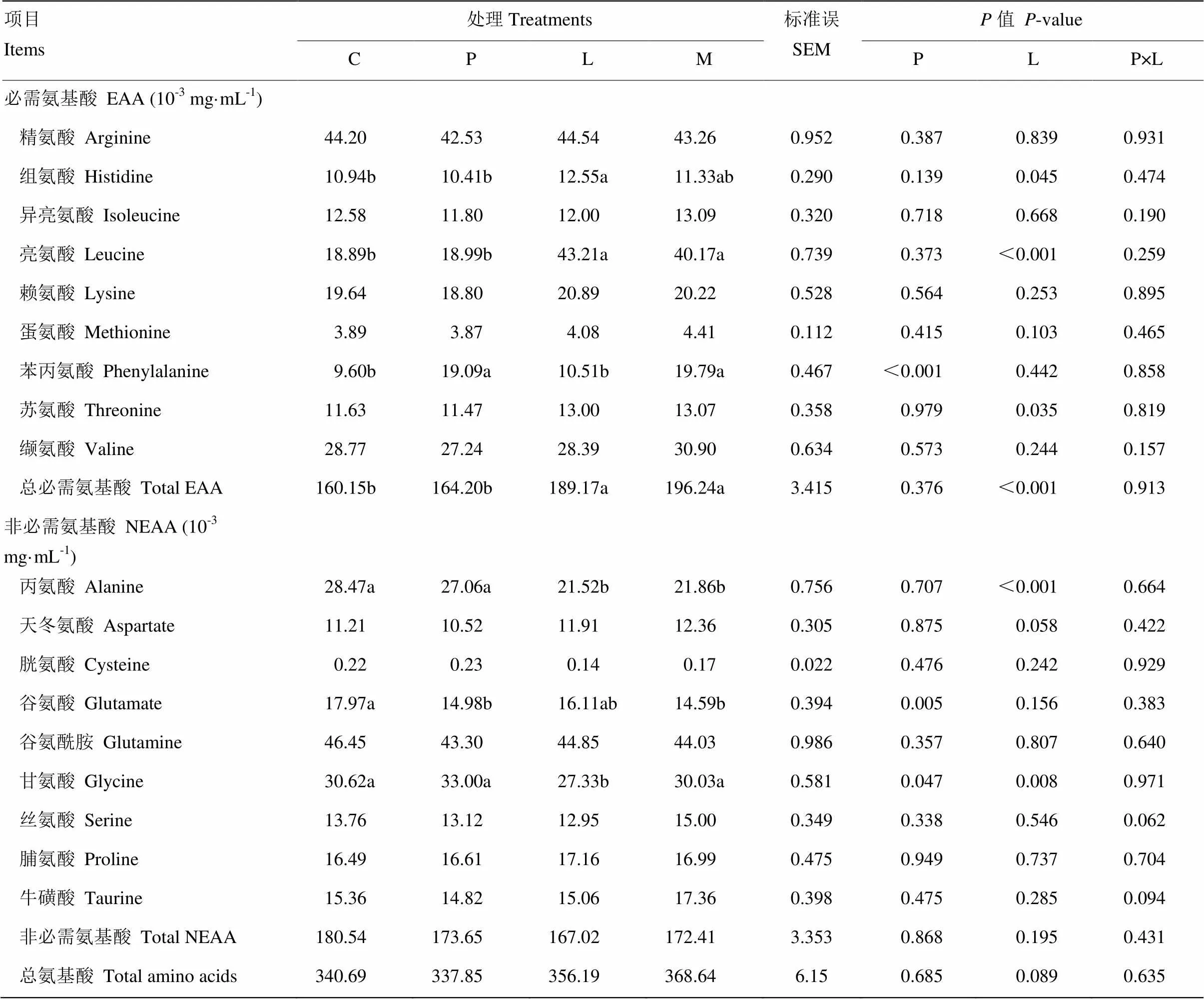
表4 原奶中添加亮氨酸和苯丙氨酸对奶公犊血清氨基酸浓度的影响
2.3 亮氨酸和苯丙氨酸对奶公犊血清代谢物浓度的影响
表5所示为原奶中添加亮氨酸和苯丙氨酸对奶公犊血清代谢物浓度的影响。亮氨酸显著提高血清葡萄糖浓度(<0.05)。与对照组、苯丙氨酸组和混合氨基酸组相比,亮氨酸组血清葡萄糖浓度分别提高22.9%、23.7%和20.7%。苯丙氨酸降低血清葡萄糖浓度(<0.05),且与亮氨酸存在负交互效应(<0.05)。
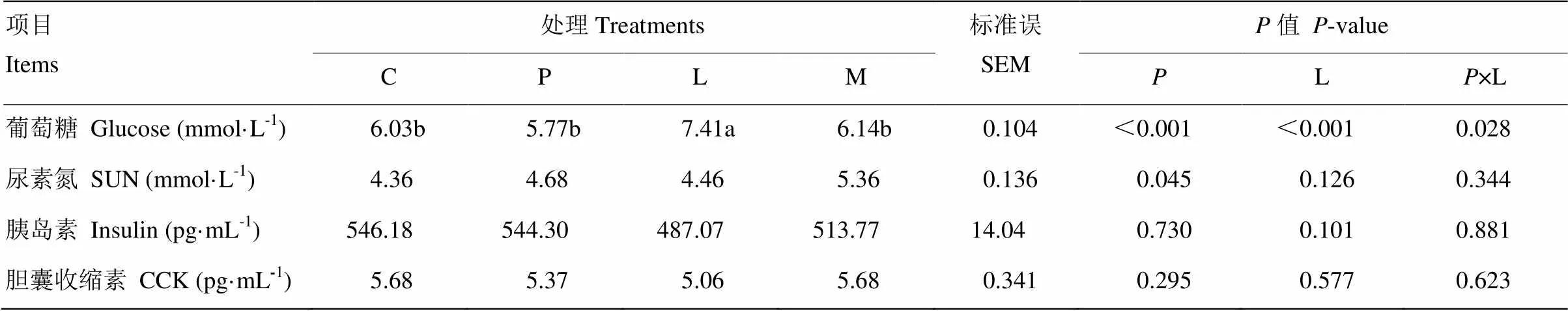
表5 原奶中添加亮氨酸和苯丙氨酸对奶公犊血清代谢物浓度的影响
此外,苯丙氨酸显著提高血清尿素氮含量(<0.05)。亮氨酸和苯丙氨酸添加对血清中胰岛素及胆囊收缩素浓度无显著影响(>0.05)。
3 讨论
经典营养学理论将亮氨酸和苯丙氨酸归为必需氨基酸,动物细胞常不能通过自身合成此类氨基酸或合成量不足以满足需求,因此必须通过日粮摄入来维持机体生长及生产活动正常进行[14]。增加哺乳仔猪亮氨酸摄入量,可通过改善仔猪肠道发育,从而促进其生长发育[15]。苯丙氨酸属于芳香族氨基酸,被广泛应用于医药和阿巴斯甜的主要原料,可在肾脏和肝脏经羟化酶催化作用氧化成酪氨酸[16],并与酪氨酸一起合成儿茶酚胺、黑色素等神经递质和激素。通过十二指肠长期灌注低剂量(2 g·d-1)苯丙氨酸可通过增加血液CCK浓度调控反刍动物胰腺淀粉酶[9],从而提高动物生产性能。但SWANEPOEL等[17]研究表明,以菜籽粕为主要蛋白来源的高产奶牛日粮中添加过瘤胃苯丙氨酸对生产性能无影响。目前,将亮氨酸和苯丙氨酸作为功能性氨基酸,主要研究其对反刍动物乳蛋白合成的调控及机制[18-20],关于其对犊牛生长性能、血清氨基酸、葡萄糖及相关激素的影响尚不清楚。本试验通过向原奶中添加亮氨酸和苯丙氨酸研究二者对奶公犊生长发育及血清代谢物的影响,并通过添加丙氨酸进行等氮处理,使得4组原奶中粗蛋白水平一致。
亮氨酸和苯丙氨酸等功能性氨基酸不仅可作为机体蛋白质合成底物,还能调控机体组织及部分功能性蛋白合成,在动物生长发育过程中起着重要作用[21-22]。本试验通过向犊牛摄食的原奶中添加亮氨酸和苯丙氨酸,虽然8周龄断奶时各组体重无显著差异,但亮氨酸有提高平均日增重的趋势,亮氨酸组的平均日增重为各组最高。混合氨基酸组日增重显著低于对照组,且血清尿素氮含量最高,这可能由氨基酸的不平衡性所致。血清尿素氮浓度可较准确的反映动物体内蛋白质代谢和氨基酸之间的平衡,较低的尿素氮浓度预示着更好的氨基酸平衡状况[23]。混合氨基酸组具有较高的尿素氮浓度,预示着氨基酸平衡状况较差,其生长发育因氨基酸的不平衡而受到抑制。体尺大小主要由遗传力所决定,但营养水平和饲喂制度可促进或阻碍遗传力发挥。优秀的体躯指数预示着较高的体躯容积,体躯容积与产奶量存在潜在正遗传相关[24]。添加亮氨酸显著提高犊牛8周龄体躯指数,说明亮氨酸可促进犊牛向拥有更高生产潜力方向发育。而混合氨基酸组可能由于氨基酸不平衡降低了奶公犊蛋白质利用效率,抑制了骨骼和骨骼肌的生长发育,导致最终体斜长和平均日增重相对较低。
本试验通过向原奶中添加亮氨酸和苯丙氨酸,发现亮氨酸可显著提高犊牛血清组氨酸、亮氨酸、苏氨酸和总必需氨基酸浓度,对总氨基酸浓度也有提高的趋势,与对照组相比亮氨酸组血清亮氨酸水平浓度提高128.7%。SUN等[15]通过向哺乳仔猪基础日粮中添加2倍的亮氨酸,发现亮氨酸具有促进仔猪肠道发育、提高亮氨酸转运载体表达及21 d体重的作用,与对照相比处理组血浆亮氨酸浓度提高62.0%,天冬酰胺浓度提高23.6%,而其余氨基酸无显著差异。NEWGARD等[25-26]也分别阐述了亮氨酸对小鼠和早期断奶仔猪血液氨基酸的影响。本试验结果与上述研究不完全一致,可能是受日粮、动物、日龄及氨基酸添加比例不同所致。犊牛氨基酸代谢池中可利用氨基酸浓度的增加,表明亮氨酸具有促进部分氨基酸吸收入血的作用,其可能是通过促进肠道发育及提高氨基酸转运载体表达实现。本研究发现,额外添加亮氨酸饲喂犊牛,并未造成亮氨酸与缬氨酸、异亮氨酸间竞争性拮抗作用的发生。
近年来,苯丙氨酸作为乳蛋白合成过程中重要氨基酸而受到一定关注[27]。GLOAGUEN等[28]研究添加不同比例苯丙氨酸对仔猪生长性能的影响,发现提供较高比例的苯丙氨酸会抑制仔猪的生长发育。SWANEPOEL等[17]研究添加苯丙氨酸对高产奶牛的影响,结果表明每日提供7.5 g小肠可吸收苯丙氨酸,不影响其生产性能和血清氨基酸组成,但影响奶牛体况评分。本试验中,添加苯丙氨酸显著提高血清苯丙氨酸和甘氨酸浓度,降低谷氨酸浓度,对其余氨基酸无显著影响。以上结果表明,亮氨酸和苯丙氨酸对犊牛的影响存在差异,具体表现在对血清氨基酸组成及体型的影响不同。
葡萄糖是所有脊椎动物碳水化合物代谢过程中居中心位置的一种单糖,同时也是动物机体内唯一可通过血液和细胞在全身循环的碳水化合物,可为机体提供能量的同时,参与多种生理功能[29]。反刍动物葡萄糖代谢与蛋白质之间存在着密切的联系,TOMÁŠ[30]通过静脉注射葡萄糖研究其对羔羊血清氨基酸的影响,发现血清葡萄糖增多显著降低哺乳羔羊血清氨基酸水平,同时发现注射葡萄糖显著降低饲喂高脂日粮断奶羔羊的血清必需和非必需氨基酸水平。孙海洲等[31]利用代谢葡萄糖和代谢蛋白质两个整体营养指标研究生长肥育绵羊葡萄糖和蛋白质的平衡,结果表明生长肥育羊日粮存在一个最佳代谢蛋白/代谢葡萄糖平衡,在饲喂1.1倍维持能量水平日粮条件下,其值介于1.00—1.07之间。近期研究表明,与葡萄糖对氨基酸代谢的影响类似,氨基酸同样影响反刍动物葡萄糖代谢。YU等[11]利用十二指肠灌注法研究亮氨酸和苯丙氨酸对山羊胰腺外分泌功能的影响,结果表明亮氨酸和苯丙氨酸可促进胰腺α-淀粉酶分泌,提高小肠淀粉消化率,进而为机体提供更多葡萄糖。LIU等[8]也证实亮氨酸可作为营养信号分子促进α-淀粉酶分泌,调控荷斯坦青年母牛胰腺外分泌功能,从而改善其能量供应。
本试验中,各组犊牛血清葡萄糖浓度在3.5—10.0 mmol·L-1范围内变动。亮氨酸显著提高血清葡萄糖浓度,苯丙氨酸则显著降低血清葡萄糖、提高血清尿素氮浓度。血清葡萄糖浓度越高,意味着可供动物直接利用的能量就越多。而较高的血清尿素氮浓度意味着犊牛血清氨基酸平衡状况较差[23],血清氨基酸并没有很好的参与机体蛋白合成,血清中大量存在的必需与非必需氨基酸在说明亮氨酸可能促进部分氨基酸吸收的同时,也一定程度说明这些氨基酸没能被机体及时合理利用参与机体蛋白合成。以上结果说明,亮氨酸组氨基酸平衡状况较好,血清氨基酸更好的参与了组织蛋白的合成。添加亮氨酸可提高血清葡萄糖浓度,其可能是通过促进胰腺及肠道相关消化酶合成来实现。
血液葡萄糖主要受胰岛素和胰高血糖素的调控。胰岛素是由胰腺胰岛β细胞受内源或外源性物质如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等刺激而分泌的一种蛋白质激素,是动物机体内唯一可降低血糖的激素。亮氨酸可通过激活mTOR通路影响肾上腺素活力,调控胰岛素分泌[32]。本试验发现亮氨酸对血清胰岛素含量无显著影响。与YANG等[32-33]的研究结果存在差异,可能是由于此期血液中持续高浓度亮氨酸通过激活mTORC1通路,提高胰腺细胞内低氧诱导因子1-α水平,从而抑制胰腺内分泌前体细胞向胰岛β细胞的分化所致[34-35]。
CCK是由肠道黏膜Ⅰ细胞分泌,在含115个氨基酸残基的CCK原基础上加工剪切形成的一类多肽[36]。CCK是胰酶合成和释放的强效刺激剂,且能够增强胰酶的活性。苯丙氨酸可通过钙敏感受体有效刺激CCK的释放[37]。YU等[9]在奶山羊上的研究发现十二指肠灌注苯丙氨酸可通过增加血液CCK浓度促进胰酶分泌。理论上,相关消化酶分泌增多,动物对营养物质的利用效率将会在一定程度上得到提高。本试验,添加苯丙氨酸显著降低血清葡萄糖浓度,但不影响血清CCK浓度。苯丙氨酸组与对照组血清葡萄糖浓度差异并不显著,但其值较低。原因可能是苯丙氨酸促进胰岛素分泌所致,苯丙氨酸组胰岛素/葡萄糖浓度比显著高于亮氨酸组,且在数值上高于对照组。苯丙氨酸对CCK没有影响的原因可能是因此期食糜流速较快,肠道缺乏一个持续的刺激源所致[38]。
4 结论
日粮中添加亮氨酸可提高犊牛血清组氨酸、亮氨酸、苏氨酸、甘氨酸、总必需氨基酸和葡萄糖浓度,提高8周龄体躯指数和平均日增重。从以上指标来说,亮氨酸添加效果优于苯丙氨酸,但二者在影响血清葡萄糖浓度方面存在负交互效应。而混合氨基酸组可能因奶公犊摄入氨基酸不平衡降低其蛋白质利用效率和生长发育。本试验条件下,日粮中添加亮氨酸和苯丙氨酸对犊牛的生长发育没有促进作用。
[1] WU G Y. Functional amino acids in nutrition and health., 2013, 45(3): 407-411.
[2] BOULTWOOD J, YIP B H, VUPPUSETTY C, PELLAGATTI A, WAINSCOAT J S. Activation of the mTOR pathway by the amino acid L-leucine in the 5q-syndrome and other ribosomopathies., 2013, 53(1): 8-17.
[3] KIM J, SONG G, WU G Y, GAO H J, JOHNSON G A, BAZER F W. Arginine, leucine, and glutamine stimulate proliferation of porcine trophectoderm cells through the MTOR-RPS6K-RPS6-EIF4EBP1 signal transduction pathway., 2013, 88(5): 1-9.
[4] LIOU A P, SEI Y, ZHAO X, FENG J, LU X, THOMAS C, PECHHOLD S, RAYBOULD H E, WANK S A. The extracellular calcium-sensing receptor is required for cholecystokinin secretion in response to L-phenylalanine in acutely isolated intestinal I cells., 2011, 300(4): 538-546.
[5] 于志清. 青藤碱对消化液分泌的影响及其机制的实验研究[D]. 兰州: 兰州大学, 2013.
YU Z Q. Effects of sinomenine on digestive juice secretion: an experimental study[D]. Lanzhou: Lanzhou University, 2013. (in Chinese)
[6] 桑丹, 孙海洲, 郭俊清, 赵存发. 过瘤胃保护性亮氨酸对绵羊骨骼肌哺乳动物雷帕霉素靶蛋白(mTOR) 信号传导通路关键因子的影响. 动物营养学报, 2011, 23(1): 61-65.
SANG D, SUN H Z, GUO J Q, ZHAO C F. Effects of rumen-protected leucine on the key factors controlling mTOR signal transduction pathway in the skeletal muscle of sheep., 2011, 23(1): 61-65.(in Chinese)
[7] 桑丹. 亮氨酸及α−酮异己酸钙对绵羊机体蛋白质合成的影响研究[D]. 呼和浩特:内蒙古农业大学, 2009.
SANG D. Study on effects of leucine and α-KIC-Ca on protein synthesis in sheep[D]. Hohhot: Innner Mongolia Agriculture University, 2009. (in Chinese)
[8] LIU K, LIU Y, LIU S M, XU M, YU Z P, WANG X, CAO Y C, YAO J H. Relationships between leucine and the pancreatic exocrine function for improving starch digestibility in ruminants., 2015, 98(4): 2576-2582.
[9] YU Z P, XU M, YAO J H, LIU K, LI F, LIU Y, WANG F, SUN F F, LIU N N. Regulation of pancreatic exocrine secretion in goats: differential effects of short-and long-term duodenal phenylalanine treatment., 2013, 97(3): 431-438.
[10] ABE M, IRIKI T, KONDOH K, SHIBUI H. Effects of nipple or bucket feeding of milk-substitute on rumen by-pass and on rate of passage in calves., 1979, 41(1): 175-181.
[11] YU Z P, XU M, WANG F, LIU K, YAO J H, WU Z, QIN D K, SUN F F. Effect of duodenal infusion of leucine and phenylalanine on intestinal enzyme activities and starch digestibility in goats., 2014, 162: 134-140.
[12] VAN SOEST P J, ROBERTSON J B. LEWIS B A. Symposium: carbohydrate methodology, metabolism, and nutritional implications in dairy cattle, methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition., 1991, 74: 3583-3597.
[13] JONES B N, Gilligan J. Amino acid analysis by o-phthaldialdehyde precolumn derivatization and reverse-phase HPLC//. New Jersey: Humana Press, 1986: 121-151.
[14] WU G Y. Dietary requirements of synthesizable amino acids by animals: a paradigm shift in protein nutrition., 2014, 5(1): 1-12.
[15] SUN Y L, WU Z L, LI W, ZHANG C, SUN K L, JI Y, WANG B, JIAO N, HE B B, WANG W W, DAI A L, WU G Y. Dietary L-leucine supplementation enhances intestinal development in suckling piglets., 2015, 47(8): 1517-1525.
[16] FITZPATRICK P F. Allosteric regulation of phenylalanine hydroxylase., 2012, 519(2): 194-201.
[17] SWANEPOEL N, ROBINSON P H, ERASMUS L J. Effects of ruminally protected methionine and/or phenylalanine on performance of high producing Holstein cows fed rations with very high levels of canola meal., 2015, 205: 10-22.
[18] RIUS A G, APPUHAMY J A, CYRIAC J, KIROVSKI D, BECVAR O, ESCOBAR J, MCGILLIARD M L, BEQUETTE B J, AKERS R M, HANIGAN M D. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids., 2010, 93(7): 3114-3127.
[19] 高海娜, 郑楠, 胡菡, 王加启. 必需氨基酸通过哺乳动物雷帕霉素靶蛋白信号通路调控乳蛋白合成的研究进展. 动物营养学报, 2014, 26(9): 2451-2456.
GAO H N, ZHENG N, HU H, WANG J Q. Research progress on the regulation of milk protein synthesis by essential amino acid through mammalian target of rapamycin signaling pathway., 2014, 26(9): 2415-2456. (in Chinese)
[20] 代文婷, 李爱军, 郑楠, 王加启. 亮氨酸水平对奶牛乳腺上皮细胞增殖及κ-酪蛋白合成相关基因表达的影响. 动物营养学报, 2015, 27(5): 1559-1566.
DAI W T, LI A J, ZHENG N, WANG J Q. Effects of leucine level on proliferation and κ-Casein synthesis related gene expressions of bovine mammary epithelial cells., 2015, 27(5): 1559-1566. (in Chinese)
[21] GANG L, WANG X Q, WU G Y, FENG C P, ZHOU H J, LI D F, WANG J J. Improving amino acid nutrition to prevent intrauterine growth restriction in mammals., 2014, 46(7): 1605-1623.
[22] WU G Y, BAZER F W, DAI Z L, LI D F, WANG J J, WU Z L. Amino acid nutrition in animals: protein synthesis and beyond., 2014, 2(2): 387-417.
[23] 席鹏彬, 李德发, 高天增, 龚丽敏. 赖氨酸与蛋白质比例对断奶仔猪生长性能, 血清尿素氮及游离氨基酸浓度的影响. 动物营养学报, 2002, 14(1): 36-41.
XI P B, LI D F, GAO T Z, GONG L M. A study on the effect of lysine to protein ratio on growth performance, serum urea nitrogen and serum free amino acids concentrations in weaned pigs., 2002, 14(1): 36-41. (in Chinese)
[24] 储明星, 师守. 奶牛体型线性评定数据的应用. 中国奶牛, 1994, 1: 26-27.
CHU M X, SHI S. Application of linear evaluation data of dairy cows.1994, 1: 26-27. (in Chinese)
[25] NEWGARD C B. Interplay between lipids and branched-chain amino acids in development of insulin resistance., 2012, 15(5): 606-614.
[26] ZHANG S H, QIAO S Y, REN M, ZENG X F, MA X, WU Z L, THACKER P, WU G Y. Supplementation with branched-chain amino acids to a low-protein diet regulates intestinal expression of amino acid and peptide transporters in weanling pigs., 2013, 45(5): 1191-1205.
[27] IROSHAN I H. The effect of a limited supply of phenylalanine, threonine, or tryptophan on mammary metabolism in dairy cows[D]. Calgary: University of Calgary, 2015.
[28] GLOAGUEN M, FLOC'H N L, PRIMOT Y, CORRENT E, MILGEN J V. Performance of piglets in response to the standardized ileal digestible phenylalanine and tyrosine supply in low-protein diets., 2014, 8(9): 1412-1419.
[29] 卢德勋. 反刍动物葡萄糖营养调控理论体系及其应用. 畜牧与饲料科学, 2010, 31(6/7): 402-409.
LU D X. The theoretical system and application of glucose nutrition regulation in ruminant.2010, 31(6/7): 402-409. (in Chinese)
[30] TOMÁŠ J, KOPPEL J, KUCHÁR S. The effect of glucose and xylazine on free amino acids concentrations in suckling and ruminating lambs., 1987, 57(1-5): 196-204.
[31] 孙海洲, 卢德勋, 张海鹰, 羿静, 赵秀英, 冯宗慈. 不同代谢葡萄糖与代谢蛋白质比例的日粮对生长肥育绵羊葡萄糖营养影响的研究. 动物营养学报, 2001, 13(1): 43-48.
SUN H Z, LU D X, ZHANG H Y, YI J, ZHAO X Y, FENG Z C. Effects of different ratio of dietary metabolizable glucose (MG) to metabolizable protein on glucose nutrition in growing-finishing sheep., 2001, 13(1): 43-48. (in Chinese)
[32] YANG J, DOLINGER M, RITACCIO G, CONTI D, ZHU X J, HUANG Y F. Leucine as a stimulant of insulin., 2015: 49-62.
[33] XU G, KWON G, CRUZ W S, MARSHALL C A, MCDANIEL M L. Metabolic regulation by leucine of translation initiation through the mTOR-signaling pathway by pancreatic β-cells., 2001, 50(2): 353-360.
[34] RACHDI L, AÏELLO V, DUVILLIÉ B, SCHARFMANN R. L-leucine alters pancreatic β-cell differentiation and function via the mTOR signaling pathway., 2012, 61(2): 409-417.
[35] 骆超超, 郑楠, 赵圣国,李松励, 文芳, 王加启, 张养东. 氨基酸调控哺乳动物细胞mTORC1上游通路研究进展. 中国农业科学, 2015, 48(S):67-74.
LUO C C, ZHENG N, ZHAO S G, LI S L, WEN F, WANG J Q, ZHANG Y D. Advances of the regulation of amino acids-mediated- mTORC1 upstream pathway in mammalian cells., 2015, 48(S):67-74. (in Chinese)
[36] NILAWEERA K N, GIBLIN L, ROSS R P. Nutrient regulation of enteroendocrine cellular activity linked to cholecystokinin gene expression and secretion., 2010, 66(1): 85-92.
[37] BALLINGER A B, CLARK M L. L-phenylalanine releases cholecystokinin (CCK) and is associated with reduced food intake in humans: evidence for a physiological role of CCK in control of eating., 1994, 43(6): 735-738.
[38] STEINERT R E, LANDROCK M F, HOROWITZ M, FEINLE- BISSET C. Effects of intraduodenal infusions of l-phenylalanine and l-glutamine on antropyloroduodenal motility and plasma cholecystokinin in healthy men., 2015, 21(3): 404-413.
(责任编辑 林鉴非)
Effect of Leucine and Phenylalanine Supplementation on Growth Performance and Serum Metabolites of Holstein Male Calves
YANG Xinjian, CAO Yangchun, ZHENG Chen, LIU Kai, GUO Long, CAI Chuanjiang, LIU Baolong, YAO Junhu
(College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi)
The objective of the study was to know the effect of leucine and phenylalanine supplementation on growth performance and serum metabolites of Holstein male calves. The study could provide a reference for the high efficient use of leucine and phenylalanine on dairy cows.A total of 20 Holstein male calves (birth weight (38±3) kg) were randomly assigned into treatment groups of control, L (1.435 g·L-1leucine), P (0.725 g·L-1phenylalanine), M (1.435 g·L-1leucine and 0.725 g·L-1phenylalanine), and each treatment added alanine as isonitrogenous diet. The experiment lasted for eight weeks, one week for adaption and seven weeks for feeding experiment. The calves were fed individually. Within one hour after birth, each calf was fed 4.0 L of colostrum. During the first week, the calves were fed their assigned milk twice daily, 3.0 L each. For adaption, the amino acid supplementation was increased 20% daily until it reached 100% of the target supplementation on the sixth day after birth. From week 2 to 3, the calves were fed their assigned milk twice a day, 3.5 L each, while from week 4 to 8, the volume of the milk fed increased to 4 L each time. From the third week after birth of the calves, a quantitative supply of the starter feed was provided, with free access to the drinking water. Body weight, withers height, body length, heart girth, heart girth/body length, body length/withers height were recorded at the 1, 3, 5, 7, and 8 week old, respectively. At the same time, 10 mL of blood was drawn from the jugular vein and placed at a tilted angle for serum precipitation. The serum samples were used to determine the amino acids, glucose, serum urea nitrogen, insulin, and cholecysto-kinin, respectively. Data were analyzed using the GLM procedure of IBM SPSS Statistics V22.0 software, differences among treatments were compared using LSD’s multiple range tests.Average daily gain in M group was significantly lower than control, L and P groups (<0.05). Compared with control group, other three groups significantly increased the final body length (<0.05). L and M treatments tended to increase the final wither height (<0.10), while P treatment significantly decreased the final heart girth (<0.05). Compared with control group, L and M treatments significantly increased the heart girth/body length (<0.05), whereas no difference in initial body weight, body length, wither height, heart girth, heart girth/body length, body length/withers height, final body weight and final body length/withers height was found among treatments (>0.05). L treatment significantly increased the concentrations of histidine, leucine, threonine, glycine, and total essential amino acids (<0.05), tended to increase the concentrations of aspartate and total amino acids (<0.10), while significantly decreased the concentrations of alanine and glycine (<0.05). P treatment significantly increased the concentrations of phenylalanine, glutamate and glycine (<0.05). Compared with L and M groups, control group significantly increased the concentrations of serum alanine (<0.05). For serum concentrations of amino acids, no significant interactions between L and P treatments were detected in our study (<0.05). L treatment significantly increased the concentrations of glucose (<0.05), while P treatment significantly decreased the concentrations of glucose (<0.05). For serum concentrations of glucose, significant interactions between L and P treatments were detected in our study (<0.05). Serum urea nitrogen in P group was significantly higher than other three groups (<0.05), whereas no difference in concentration of insulin and cholecysto-kinin were found among treatments (>0.05).In conclusion, leucine supplementation had a better effect than that of phenylalanine on the serum concentration of essential amino acids, glucose, heart girth/body length and average daily gain of Holstein male calves, whereas negative interactions existed between the two kinds of supplementation.
leucine; phenylalanine; calves; growth performance; serum metabolites
2016-11-30;接受日期:2017-09-18
国家自然科学基金(31472122)、陕西省科技统筹创新工程项目(2015KTCQ02-19)
杨昕涧,E-mail:18729548121@163.com。曹阳春,E-mail:caoyangchun@126.com。杨昕涧和曹阳春为同等贡献作者。通信作者姚军虎,E-mail:yaojunhu2004@sohu.com
