EDTA抗原修复液用于促蓝液的应用和体会
2017-11-16吴冬梅陈小玲陈永华郭润民
吴冬梅 陈小玲 陈永华 郭润民
1.广东医科大学附属医院病理科,广东湛江 524001;2.广东医科大学附属医院药剂科,广东湛江 524001;3. 广东医科大学附属医院心血管内科,广东湛江 524001
EDTA抗原修复液用于促蓝液的应用和体会
吴冬梅1陈小玲2陈永华1郭润民3▲
1.广东医科大学附属医院病理科,广东湛江 524001;2.广东医科大学附属医院药剂科,广东湛江 524001;3. 广东医科大学附属医院心血管内科,广东湛江 524001
目的 探讨EDTA抗原修复液是否可用做HE染色和免疫组织化学染色的促蓝液。 方法 分别采用HE染色法及免疫组织化学染色对脱钙后骨组织(10例)﹑冰冻脂肪组织(10例)﹑平滑肌组织(10例)﹑甲状腺组织(10例)及肠癌组织进行染色(10例)。分别采用流水冲洗﹑43℃温水﹑即用型PBS﹑pH=9.0 EDTA修复液作为促蓝液进行蓝化。 结果 在HE染色组的5种蓝化方式中,以EDTA抗原修复液蓝化2min(实验时间为夏天)蓝化最充分﹑效果最佳﹑不易脱片﹑层次分明﹑细胞核蓝色鲜艳﹑核膜及染色质形态结构特点清楚﹑核浆对比度明显;在免疫组织化学染色组,复染苏木精后,经EDTA抗原修复液蓝化2min,各组组织细胞核结构显示清晰,能很好的衬托组化阳性信号。 结论 HE染色和免疫组织化学染色均可以将EDTA抗原修复液用于促蓝液,且在免疫组织化学染色中,EDTA抗原修复液的效果与流水冲洗效果相当,而且节省了蓝化的时间。
EDTA抗原修复液;促蓝液;HE染色法;免疫组织化学染色
苏木素-伊红染色法(hematoxylin eosin staining,HE染色)中的显蓝,又称返蓝﹑促蓝﹑蓝化,苏木素染色的组织切片经分化液分化后,其颜色由蓝色变为红色,再经弱碱性水溶液处理,使其由浅蓝色变为蓝色,苏木素染色这一蓝化过程是HE染色所必需的,蓝化处理得当,细胞核才能呈现鲜艳的蓝色,细胞核膜及染色质形态结构清楚,并且与伊红的红色形成鲜明的对比,红蓝相衬。HE染色切片的质量好坏不但取决予苏木素﹑伊红染液的质量﹑染色时间﹑染色温度,而且在很大程度上还取决于染色过程中分化液﹑蓝化液性质和类型的选择,以及分色与蓝化的时间[1-3]。在临床工作中,一些前期处理好的切片,当以氨水蓝化时会出现个别脱片情况,尤其是脱钙后的骨组织﹑冷冻切片中的脂肪组织﹑平滑肌组织及甲状腺等纤维或脂肪多的组织尤其显著[4-5]。因此,本研究通过比较EDTA抗原修复液在HE染色和免疫组织化学染色促蓝液应用比较,试图找到快速而且稳定的蓝化方法,从而提高HE染色和免疫组织化学染色的蓝化速度。

表1 HE染色5种蓝化所用时间(min)
1 材料与方法
1.1 材料
2016年1~6月广东医科大学附属医院病理中心的临床标本中随机挑取脱钙后骨组织﹑冰冻脂肪组织﹑平滑肌组织﹑甲状腺组织及肠癌组织各10例。本研究经广东医科大学附属医院伦理委员会审核批准,均获得本研究所有患者的书面知情同意。
1.2 试剂
HE染色常用试剂,苏木精﹑伊红﹑二甲苯﹑乙醇﹑1%盐酸乙醇,可调温度的摊片机﹑pH为7.4~7.6的PBS溶液﹑pH=9.0 EDTA修复液。
1.3 方法
1.3.1 HE染色 (1)石蜡切片4um脱蜡至水;(2)苏木精染色5~8min;(3)1%盐酸乙醇分化数秒,水洗;(4)按表一所列方法对石蜡切片进行蓝化处理,充分水洗;(5)0.5% 伊红2~5min,水洗;(6)梯度乙醇脱水;(7)二甲苯透明;(8)中性树胶封片.1.3.2 免疫组化染色 (1)石蜡切片常规脱蜡至水;(2)常规免疫组织化学染色到DAB显色;(3)苏木素复染,水洗干净;(4)用pH 9.0抗原修复液蓝化 2min;(5)梯度乙醇脱水;(6)二甲苯透明;(7)中性树胶封片。
1.4 结果判定
显微镜下观察,HE染色细胞核与细胞质染色染色对比是否清晰,颜色是否鲜艳。显微镜下观察,免疫组化染色显色后,细胞核染色是否深浅恰当,是否能清晰地显示组织结构。
2 结果
2.1 HE染色采用5种蓝化方式所用的时间
HE染色中分别采用流水冲洗﹑43℃温水﹑即用型PBS﹑pH=9.0 EDTA修复液作为促蓝液进行蓝化,对应所耗时间具体结果见表1。可见EDTA抗原修复液不仅仅所用时间少,而且同一试剂可以多种用途。这样,EDTA作为修复液使用后,可以继续作为促蓝液使用,在基层单位可以既节约成本又节省时间。
2.2 HE染色后蓝化结果
HE染色采用5种蓝化方式,以pH 9.0 EDTA溶液蓝化2min(实验时间为夏天)蓝化最充分,效果最佳,不易脱片,层次分明,细胞核蓝色鲜艳,核膜及染色质形态结构特点清楚,核浆对比度明显,其他4种蓝化方法相对于EDTA溶液蓝化效果稍差。在实验过程中各种组织经过5种蓝化方法蓝化后并未发现组织脱片。见图1。
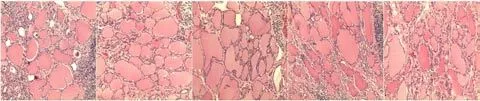
图1 EDTA抗原修复液蓝化HE染色甲状腺组织
2.3 免疫组织化学染色蓝化结果
免疫组织化学染色复染苏木精后,经pH 9.0 EDTA溶液蓝化2min后,各组组织细胞核结构显示清晰,能很好的衬托组化阳性信号。本次实验中,固定良好的组织在实验过程中并未发现蓝化后脱片。
3 讨论
苏木素伊红染色(简称HE染色)和免疫组织化学染色是目前应用最广泛的组织化学染色方法。在HE染色中,苏木素染色后蓝化得当是否也非常重要,如果蓝化不足,染色偏弱,若蓝化时间太长,又会加长染色时间。采用弱碱性水溶液尽管会很快使组织蓝化,但是碱性水溶液会使细胞的PH发生改变,导致伊红不容易上色。经过碱性水溶液蓝化的切片,伊红染色时间往往需要30~60s,甚至需要几分钟;而流水蓝化的切片,伊红染色时间只需要2~10s。长时间的伊红染色会使伊红吸附在细胞核上,形成核浆共染现象,使细胞核呈紫红色,导致核浆染色对比不明显,这在自动染色时特别明显。自来水的pH为6~7,相对于盐酸和苏木精来说,都成弱碱性,组织在染色过程中,这种蓝-红-蓝变色的现象,是苏木红和铝离子所形成的蓝色色淀的结合﹑解离和再结合的过程[6]。一般来说,蓝色色淀在酸性环境中处于离子状态,呈红色,这种现象称为色淀解离;相反,红色离子状态的色淀,在中性或碱性环境中处于结合状态,呈蓝色,这时就称为色淀形成。有研究表明[7],染苏木精后在43℃温水中既能达到快速蓝化的目的,又不引起脱片。也有用PBS作为促蓝液有很好效果[8]。当然更常用的是用流水冲洗蓝化[9-10]。本实验采用了几种平常HE染色过程中较容易脱片的组织,实验结果表明,当组织固定良好的情况下,pH 9.0的EDTA蓝化并未出现脱片现象。并且无论HE染色或者免疫组化染色,用pH 9.0 EDTA(修复前或修复后)作为促蓝液能达到很好的效果。能较好的和快速的使细胞核蓝化,且在组织固定良好的情况下,未发现脱片现象;要注意的是,HE染色过程中,在用碱性促蓝液进行蓝化后必须用自来水充分冲洗,待完全冲去玻片中的促蓝液后再继续后续的伊红染色。我们发现:EDTA抗原修复液可应用于HE染色和免疫组织化学染色的促蓝液,且在免疫组织化学染色中,EDTA抗原修复液能快速达到蓝化效果,这可能与其PH值﹑脱钙等有关[11-16]。
[1] Alers JC,Krijtenburg PJ,Vissers KJ,et al.Effect of bone decalcification procedures on DNA in situ hybridization and comparative genomic hybridization: EDTA is highly preferable to a routinely used acid decalcifier[J].Journal of Histochemistry and Cytochemistry,1999,47(5):703-710.
[2] Schrijver WAME,Van der Groep P,Hoefnagel LD,et al.Influence of decalcification procedures on immunohistochemistry and molecular pathology in breast cancer[J].Modern Pathology,2016,29:1460-1470.
[3] Hatta H,Tsuneyama K,Nomoto K,et al.A simple and rapid decalcification procedure of skeletal tissues for pathology using an ultrasonic cleaner with D-mannitol and formic acid[J].Acta Histochemica,2014,116(5):753-757.
[4] Sangeetha R,Uma K,Chandavarkar V.Comparison of routine decalcification methods with microwave decalcification of bone and teeth[J].Journal of Oral and Maxillofacial Pathology,2013,17(3):386–391.
[5] Singh VM,Salunga RC,Huang VJ,et al.Analysis of the effect of various decalcification agents on the quantity and quality of nucleic acid (DNA and RNA) recovered from bone biopsies[J].Annals of Diagnostic Pathology,2013,17(4):322-326.
[6] 丁伟,王德田.简明病理学[M].杭州:浙江科学技术出版社,2014:29-30.
[7] 梁英杰,凌启波,张威.临床病理学技术[M].北京:人民卫生出版社,2011:75.
[8] 孙廷谊,孔令非.医药论坛杂志[J].苏木精-曙红染色中快速蓝化的方法,2003,5(24):58.
[9] 王永军,刘世正.诊断病理学杂志[J].常规HE染色中蓝化方法的改进,2005.12(6):475-476.
[10] 章克萍,龙飞,汪雁.江西医学院学报[J].常规HE染色过程中分色蓝化透明方法的改良,2008(48):85-89.
[11] Ramos-Vara JA,Miller MA.When tissue antigens and antibodies get along:revisiting the technical aspects of immunohistochemistry-the red,brown,and blue technique[J].Veterinary Pathology,2014,51(1):42-87.
[12] González-Chávez SA,Pacheco-Tena C,Macías-Vázquez CE,et al.Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence[J].International Journal of Clinical and Experimental Pathology,2013,6(10):1972–1983.
[13] Ying Y,Wang S,Wang F,et al.The influence of different decalcifying fluid on the section staining of articular joint tissue of rabbit knee[J].Chinese Animal Husbandry and Veterinary Medicine,2012,39(2):221-224.
[14] Alers JC,Krijtenburg PJ,Vissers KJ,et al.Effect of bone decalcification procedures on DNA in situ hybridization and comparative genomic hybridization:EDTA is highly preferable to a routinely used acid decalcifier[J].Journal of Histochemistry and Cytochemistry,1999,47(5):703-710.
[15] 马恒辉,周晓军.HE染色常见问题与对策被引量[J].临床与实验病理学杂志,2008,34(4):478-481.
[16] 马恒辉,周晓军.组织固定处理及包埋常见问题与对策[J].临床与实验病理学杂志,2011,27(6):638-641.
Application of EDTA antigen retrieval solution in blue solution of HE staining
WU Dongmei1CHEN Xiaoling2CHEN Yonghua1GUO Runmin3
1.Department of Pathology,Guangdong Medical University,Zhanjiang 524001,China;2.Department of Pharmacy,Guangdong Medical University,Zhanjiang 524001,China;3.Department of Cardiology,3.The Affiliated Hospital,Guangdong Medical University,Zhanjiang 524001,China
Objective To investigate whether EDTA antigen retrieval solution can be used for blue solution of HE staining and immunohistochemical staining. Methods Using HE staining and immunohistochemical staining of decalcified bone (10 cases),frozen adipose tissue (10 cases),muscle tissue (10 cases) and thyroid tissues (10 cases)and colorectal carcinoma tissues were stained (10 cases).Rinse with tap water,43 degree warm water and instant PBS respectively,pH=9.0 EDTA retrieval solution were used as blue solution. Results In HE staining groups,after blue staining using EDTA antigen retrieval solution for 2 min (experiments performed in summer),which effects were best,as evidenced by blue staining thoroughly,stripping off difficultly,more bright blue nuclei,more clear nuclear structure,significantly contrast between cytoplasm and nucleus.In immunohistochemical staining groups,after hematoxylin staining and blue staining using EDTA antigen retrieval solution for 2 min,the EDTA antigen retrieval solution made nucleus structure more clear,and immunohistochemical staining positive signals better. Conclusion EDTA antigen retrieval liquid can be used for blue solution of HE staining and immunohistochemical staining,EDTA antigen retrieval liquid have similar effects and expends less time compared with flush with streams.
EDTA antigen retrieval solution;Blue solution;HE staining;Immunohistochemical staining
R783.3
A < class="emphasis_bold"> [文章编号]]
] 2095-0616(2017)21-28-03
国家自然科学基金资助项目(81670348;81703762);广东省自然科学基金项目(2015A030310359;2016A030313678;2016A030310359)。
▲通讯作者
2017-09-15)
