白蛋白结合型紫杉醇单药作为二线及以上方案治疗晚期乳腺癌的临床观察
2017-11-16王丽莉黄伟炜李重颖
王丽莉 黄伟炜 吴 凡 陈 侃 洪 熠 李重颖 刘 健
福建省肿瘤医院内科 福建医科大学附属肿瘤医院,福建福州 350014
白蛋白结合型紫杉醇单药作为二线及以上方案治疗晚期乳腺癌的临床观察
王丽莉 黄伟炜 吴 凡 陈 侃 洪 熠 李重颖 刘 健▲
福建省肿瘤医院内科 福建医科大学附属肿瘤医院,福建福州 350014
目的 探讨白蛋白结合型紫杉醇单药作为二线及以上方案治疗晚期乳腺癌的临床资料,探讨白蛋白结合型紫杉醇在晚期乳腺癌多线治疗中的疗效和安全性。方法 将2013年1月~2016年1月在我院已接受过一线治疗的46例晚期乳腺癌患者作为研究对象,所有患者均给予白蛋白结合型紫杉醇治疗,对患者临床治疗有效率﹑中位无进展生存时间(PFS)及不良反应发生情况进行综合评价。结果 46例晚期乳腺癌患者中无完全缓解者,部分缓解(PR)为15例,疾病稳定(SD)者19例,疾病进展12例,有效率(RR)为32.6%,疾病控制率达到73.9%,PFS为5.0个月;且患者不良反应主要以白细胞减少﹑血小板减少﹑脱发等为主,经过治疗患者均耐受。结论 白蛋白结合型紫杉醇单药作为二线及以上方案治疗晚期乳腺癌,操作简单,疗效显著,毒副作用低,值得推广应用。
白蛋白结合型紫杉醇;单药;多线方案;晚期乳腺癌;毒副作用
作为临床中一种极为常见的恶性肿瘤疾病,乳腺癌具有较高的发病率与病死率,通常当患者确诊时已发展到晚期,错失了手术治疗最佳时期[1],二线及以上治疗失败后化疗方案的选择成为临床工作的难点[2]。作为一种新辅剂型紫杉醇,白蛋白结合型紫杉醇能够于肿瘤局部产生高浓度紫杉醇,对于延长患者生存质量有着重要的作用[3]。为探究其临床安全性与有效性,研究收集我院46例晚期乳腺癌患者的病例资料予以分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年1月~2016年1月我院晚期乳腺癌患者的临床资料,共46例,年龄27~64岁,平均(51.5±6.6)岁,其中浸润性导管癌38例(82.6%),浸润性小叶癌 4例(8.7%),单纯癌 3例(6.5%),乳头状癌1例(2.2%);绝经前 12例(26.1%),绝经后34例(73.9%)。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)[4]评分:0分2例,1分36例,2分8例。纳入标准:(1)经过临床诊断及病理学检查,所有患者均符合晚期乳腺癌的临床诊断标准[5];(2)接受一线及以上方案化疗失败者;(3)预计生存期≥3个月。
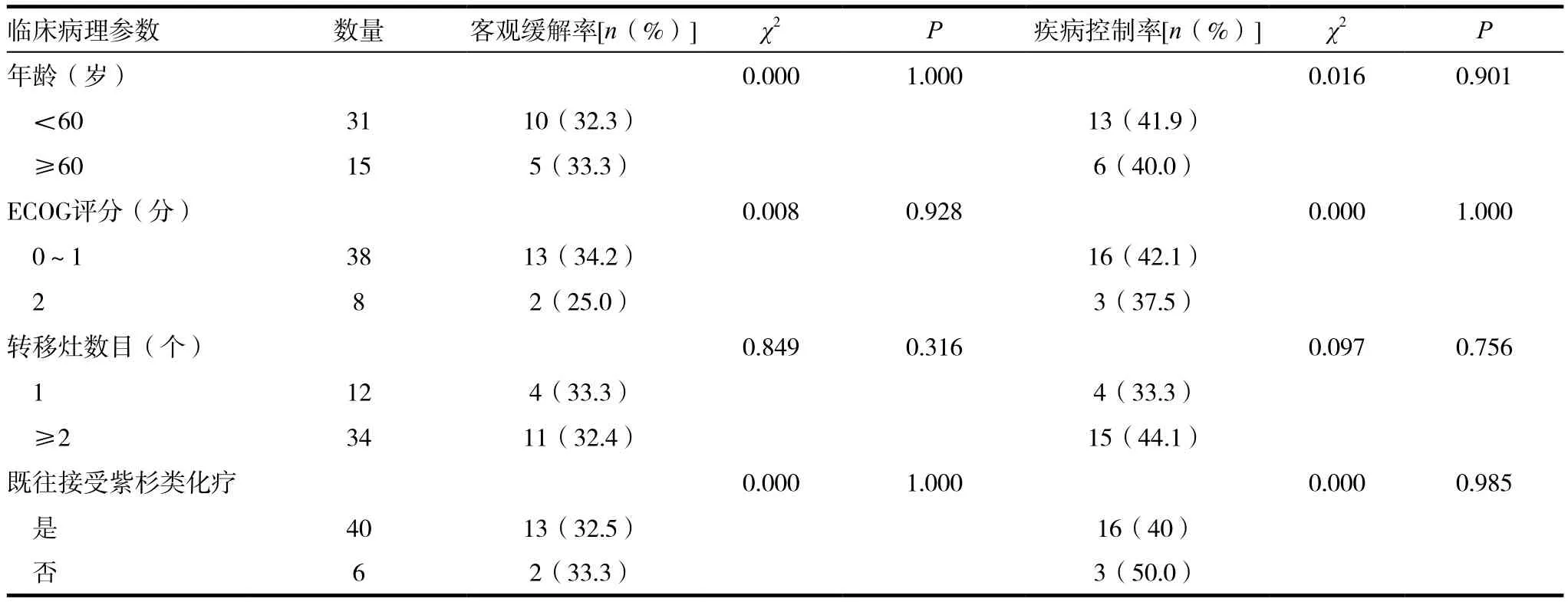
表1 46例晚期乳腺癌患者临床疗效评价[n(%)]
1.2 药物来源
注射用白蛋白结合型紫杉醇由美国Abraxis生物科学公司生产提供,规格为100mg/瓶,准字号:H20130650。
1.3 方法
所有患者均给予白蛋白结合型紫杉醇治疗,严格按照说明书将白蛋白结合型紫杉醇冻干粉采用0.9%氯化钠注射液溶解,给予患者静脉滴注,以30min 为宜,剂量为 130mg/m2,第 1﹑8﹑15 天,每 28天为一个周期。用药前无需给予抗过敏预处理,治疗期间给予5-羟色胺受体3拮抗剂预防恶心﹑呕吐等不良反应。至少完成2个周期化疗。
1.4 疗效评价与不良反应
所有可测量病灶均有化疗前的基线测量,每2周期进行影像学检查测量。根据国际RECRST判定标准[6],将治疗效果分别完全缓解(CR)﹑部分缓解(PR)﹑疾病稳定(SD)﹑疾病进展(PD)四个级别。客观缓解率(ORR)是指CR+PR患者占全组患者的百分率。疾病控制率(DCR)是指CR+PR+SD患者占全组患者的百分率。无进展生存期(PFS)是指患者从首次用药到疾病进展或任何原因死亡的时间(以发生在先的事件计算)。按照美国国立癌症研究所不良反应评价标准(CTC)第4版进行分级[7]。
1.5 统计学方法
2 结果
2.1 46例晚期乳腺癌患者临床疗效评价
46例晚期乳腺癌患者中无CR者,PR者为15例,SD者19例,PD者12例,ORR为32.6%,DCR达73.9%。其中既往使用过及未使用过紫杉烷类药物(紫杉醇/多西他赛)的晚期乳腺癌患者ORR分别为 32.5%﹑33.3%,DCR 分别为 40%﹑50%,两者相比均无统计学意义。且患者近期疗效与年龄﹑ECOG评分﹑转移灶数目亦无相关性。见表1。
2.2 46例晚期乳腺癌患者远期疗效
治疗后对患者予以为期1年的随访,结果显示有40例患者存活,6例死亡,中位PFS为5.0个月。
2.3 46例晚期乳腺癌患者不良反应发生情况
患者不良反应主要以白细胞减少﹑血小板减少﹑脱发等为主,经过治疗患者均耐受。见表2。
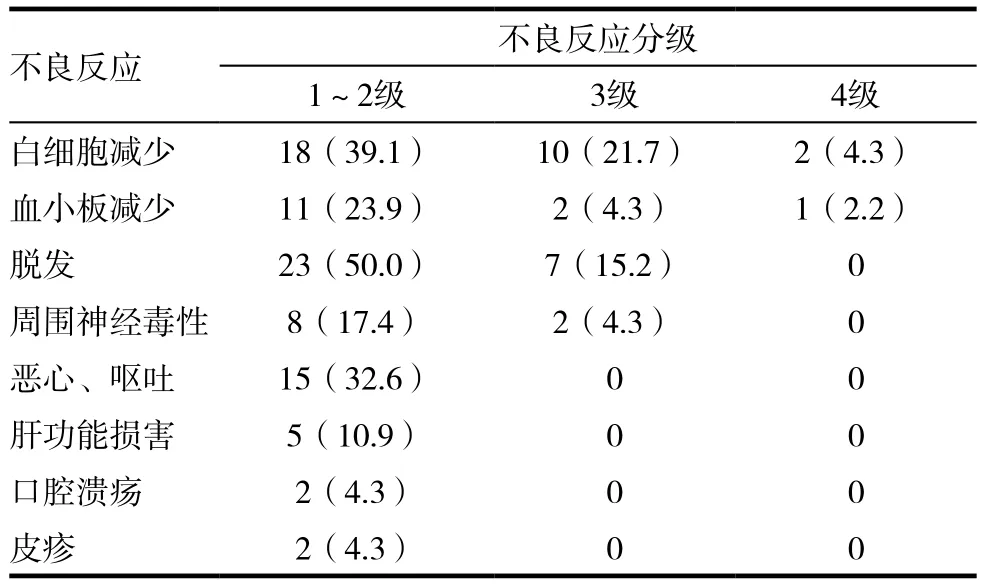
表2 46例晚期乳腺癌患者不良反应发生情况[n(%)]
3 讨论
紫杉醇作为乳腺癌治疗中一种常见的抗癌药物,研究显示,乳腺癌在应用紫杉醇治疗期间容易产生一系列不良反应,降低药物量效关系[8],阻碍药物的吸收与利用。白蛋白结合型紫杉醇是白蛋白(直径为130nm)与紫杉醇的结合,使用时向瓶内注射20mL生理盐水,即可形成纳米粒紫杉醇悬浮液,直接用于静脉滴注[9]。与传统的紫杉醇及多西紫杉醇相比,白蛋白结合型紫杉醇独特的作用机制可显著增加肿瘤细胞内的有效药物浓度,从而明显增强其抗肿瘤活性[10],从而使其在疗效上更有优势,无论是260mg/m2,第1天给药,每21天1个周期还是100~ 125mg/m2,第 1﹑8﹑15天给药,每 28天 1个周期,2种治疗模式均有效,且疗效相当[11-13]。
2005年Gradishar等[14]对454例晚期乳腺癌患者进行了一项随机对照Ⅲ期临床研究,结果显示白蛋白结合型紫杉醇的ORR为37%,传统型紫杉醇ORR为19%,且前者的疾病进展时间明显延长至23周,基于这一研究,白蛋白结合型紫杉醇被批准用于晚期乳腺癌的治疗。该研究亚组分析提示白蛋白结合型紫杉醇对比传统紫杉醇治疗二线以上的晚期乳腺癌在延长总生存方面更有优势,两组中位总生存分别为56.4周和46.7周(P=0.024)。亦有学者在研究中发现,白蛋白结合型紫杉醇在恶性肿瘤二线及二线以上治疗中均体现出显著疗效[15]。此次研究对我院46例晚期乳腺癌患者给予白蛋白结合型紫杉醇治疗,其疾病控制率达73.9%,PFS为5.0个月,且安全性良好。Blum等[16]进行的一项Ⅱ期临床研究结果表明,白蛋白结合型紫杉醇2种给药方案(100mg/m2组与 125mg/m2组,均第 1﹑8﹑15天给药,每28天1个周期)治疗既往使用普通溶剂型紫杉醇治疗后耐药的晚期乳腺癌依然有效且耐受良好。两组ORR分别为14%与16%,DCR分别为26%与37%,两组差异无统计学意义。本研究中白蛋白结合型紫杉醇对既往使用过紫杉烷类药物(紫杉醇/多西他赛)的晚期乳腺癌仍有较好的疗效,ORR为 32.5%,DCR为40%,较上述研究结果明显增加,可能与个体差异及本研究例数少有关。
白蛋白结合型紫杉醇去除了助溶剂,从而显著降低了过敏反应以及严重神经毒性的发生率效[17]。与传统紫杉醇制剂相比,白蛋白结合型紫杉醇的疗效明显提高而不良反应有所下降[18-20]。患者不良反应主要以血液学毒性为主,经过治疗患者均耐受。
综上所述,白蛋白结合型紫杉醇单药作为二线及以上方案治疗晚期乳腺癌,疗效好,毒副反应低,可广泛应用于临床。但由于本研究病例数少,观察时间短,故该药的疗效和毒副作用仍有待临床进一步探索。
[1] 范丽萍,焦园园,郭子寒,等.白蛋白结合型紫杉醇与溶剂型紫杉醇治疗转移性乳腺癌的最小成本分析[J].中国药房,2016,27(32):4477-4479.
[2] 朱华云,孙小峰,陈嘉,等.曲妥珠单抗联合白蛋白结合型紫杉醇治疗晚期乳腺癌的疗效和安全性[J].徐州医学院学报,2015,12(11):752-755.
[3] 李旭,艾斌,张萍,等.以白蛋白结合型紫杉醇为基础的方案治疗晚期肺癌的临床疗效及安全性观察[J].中国肺癌杂志,2017,20(7):479-484.
[4] Malalasekera A,Tan CSY,Phan V,et al.Eastern cooperative oncology group score:agreement between nonsmallcell lung cancer patients and their oncologists and clinical mplications[J].Cancer Treatment Communications,2016,5:17-21.
[5] Azim HA,Abdalkader YS,Mousa MM,et al.Taxanebased regimens as adjuvant treatment for breast cancer:a retrospective study in egyptian cancer patients[J].Asian Pacific Journal of Cancer Prevention Apjcp,2015,16(1):65-9.
[6] Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].European Journal of Cancer,2009,45(2):228-247.
[7] Hay JL,Atkinson TM,Reeve BB,et al.Cognitive interviewing of the US national cancer institute’s patientreported outcomes version of the common terminology criteria for adverse events(PRO-CTCAE)[J].Quality of Life Research An International Journal of Quality of Life Aspects of Treatment Care & Rehabilitation,2014,23(1):257-269.
[8] 李娜妮,刘健,吴凡,等.拉帕替尼联合白蛋白结合型紫杉醇治疗曲妥珠单抗治疗失败的HER2阳性乳腺癌的临床观察[J].中华内分泌外科杂志,2016,10(5):369-373.
[9] Desai N,Trieu V,Yao Z,et al.Increased antitumor activity, intratumor paclitaxel concentrations, and endothelial cell transport of cremophor-free,albumin-bound paclitaxel,ABI-007,compared with cremophor-based paclitaxel[J].Clin Cancer Res,2006,12(4):1317-1324.
[10] Sparreboom A,Scripture CD,Trieu V,et al.Comparative preclinical and clinical pharmacokinetics of a cremophorfree,nanoparticle albumin-bound paclitaxel (ABI-007)and paclitaxel formulated in Cremophor (Taxol)[J].Clinical Cancer Research,2005,11:4136-4143.
[11] Gradishar WJ,Tjulandin S,Davidson N,et al.Phase Ⅲtrial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer[J].J Clin Oncol,2005,23(31):7794-7803.
[12] Gradishar WJ,Krasnojon D,Cheporov S,et al.Significantly longer progression-free survival with nabpaclitaxel compared with docetaxel as first-line therapy for metastatic breast cancer[J].J Clin Oncol,2009,27(22):3611-3619.
[13] Gradishar WJ,Krasnojon D,Cheporov S,et al.Phase Ⅱtrial of nab-paclitaxel compared with docetaxel as firstline chemotherapy in patients with metastatic breast cancer: final analysis of overall survival[J].Clin Breast 845 Cancer,2012,12(5): 313-321.
[14] Gradishar WJ,Tjulandin S,Davidson N,et al.Phase Ⅲtrial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer[J].J Clin Oncol,2005,23(31):7794-7803.
[15] Carrara GFA,Scapulatempo-Neto C,Abraho-Machado LF,et al.Breast-conserving surgery in locally advanced breast cancer submitted to neoadjuvant chemotherapy. Safety and effectiveness based on ipsilateral breast tumor recurrence and long-term follow-up[J].Clinics,2017,72(3):134-142.
[16] Blum JL,Savin MA,Edelman G,et al.Phase II study of weekly albumin-bound paclitaxel for patients with metastatic breast cancer heavily pretreated with taxanes[J].Clin Breast Cancer,2007,7(11):850-856.
[17] Safety and Efficacy of nab-Paclitaxel in the Treatment of Patients with Breast Cancer[J].Breast Cancer: Basic and Clinical Research,2011:553-565
[18] Yamamoto Y,Kawano I,Iwase H.Nab-paclitaxel for the treatment of breast cancer:efficacy,safety,and approval[J].Onco TargetsTher,2011,4:123-136.
[19] DI Costanzo F,Gasperoni S,Rotella V,et al.Targeted delivery of albumin bound paclitaxel in the treatment of advanced breast cancer[J].Onco Targets Ther,2009,2:179-188.
[20] Ibrahim NK,Desai N,Leqha S,et al.Phase Ⅰ and pharmacokinetic study of ABI-007,a Cremophorfree,protein-stabilized, nanoparticle formulation of paclitaxel[J].Clin Cancer Res,2002,8(5):1038-1044.
Clinical observation of albumin bound paclitaxel monotherapy as second-line and advanced regimens for advanced breast cancer
WANG Lili HUANG Weiwei WU Fan CHEN Kan HONG Yi LI Zhongying LIU Jian
Department of Internal Medicine, Fujian Tumor Hospital, Affiliated Tumor Hospital of Fujian Medical University,Fujian, Fuzhou 350014, China
Objective To investigate the clinical value of albumin bound paclitaxel monotherapy as second-line and advanced regimens in the treatment of advanced breast cancer, and to evaluate the efficacy and safety of albumin bound paclitaxel in multi line therapy for advanced breast cancer. Methods 46 patients with advanced breast cancer who
first-line treatment in our hospital from January 2013 to January 2016 were selected as the subjects, all patients were treated with albumin bound paclitaxel. The clinical treatment efficiency, median progression free survival time (PFS) and adverse reactions were evaluated comprehensively. Results No complete remission was found in 46 patients with advanced breast cancer, with 15 cases of partial remission (PR), 19 cases of stable disease (SD), and 12 cases of disease progression. The effective rate (RR) was 32.6%, the disease control rate was 73.9%, and the PFS was 5 months; The main adverse reactions were mainly white blood cell reduction,thrombocytopenia, alopecia and so on. All patients were tolerant after treatment. Conclusion Albumin bound paclitaxel monotherapy as second-line and advanced regimens in the treatment of advanced breast cancer has simple operation, obvious curative effect and low toxic side effect, so it is worthy of popularization and application.
Albumin tuberculosis paclitaxel; Monotherapy; Multi-line regimen; Advanced breast cancer; Side effects
R734.2
A < class="emphasis_bold"> [文章编号]]
] 2095-0616(2017)21-09-04
福建省卫生系统中青年骨干人才培养项目(2015-ZQN-JC-6);福建省自然科学基金资助项目(2015J01381)。
▲通讯作者
2017-09-28)
