艾司奥美拉唑镁肠溶微丸型片剂的制备
2017-11-15陈海建产运霞柴继峰丁平田
陈海建,产运霞,咸 磊,柴继峰,丁平田*
艾司奥美拉唑镁肠溶微丸型片剂的制备
陈海建1,2,产运霞2,咸 磊1,柴继峰2,丁平田1*
(1. 沈阳药科大学药学院,辽宁沈阳 110016; 2. 北京万生药业有限责任公司,北京 101113)
研究艾司奥美拉唑镁肠溶微丸型片剂的制备方法。采用流化床包衣技术制备艾司奥美拉唑镁肠溶微丸,采用中心组合设计、三因素三水平响应曲面法,研究微丸肠溶层增塑剂比例、片剂辅料与肠溶微丸的比例及压片压力对片剂耐酸力和脆碎度的影响。微丸肠溶层增塑剂含量质量分数在20%~30%内,耐酸力随片剂辅料与肠溶微丸的质量比增加而增加,同时增加增塑剂的用量也可改善片剂的耐酸力;增加片剂辅料与肠溶微丸的质量比和压片压力可降低片剂的脆碎度。优化的最佳处方及参数为:微丸肠溶层增塑剂含量质量分数30%、片剂辅料与肠溶微丸的质量比为2.7、压片压力10~12 kN,片剂耐酸120 min含量下降2.1%,脆碎度为0.09%。制备的艾司奥美拉唑镁肠溶片的释药行为与参比制剂一致,该技术和处方可应用于工业化生产。
药剂学;微丸压片;响应曲面法;艾司奥美拉唑镁;耐酸力;肠溶微丸
艾司奥美拉唑(esomeprazole)为阿斯利康公司2002年推出的更新换代产品,为奥美拉唑的异构体,是全球第一个采用氧化合成技术生产的质子泵抑制剂,比奥美拉唑的抑酸疗效持续时间更久且用药量更低。因T艾司奥美拉唑在酸性条件下极易降解,因此通常制备成肠溶制剂以避免口服过程中胃酸的破坏。目前国内上市的口服艾司奥美拉唑制剂有:艾司奥美拉唑肠溶胶囊(商品名为莱美舒,重庆莱美药业股份有限公司)和艾司奥美拉唑镁肠溶片(商品名为耐信,阿斯利康制药有限公司)。其中艾司奥美拉唑镁肠溶片采用了肠溶微丸压片工艺,该工艺要求肠溶微丸在压片过程中衣膜可以发生一定的形变,但不能破裂,以保证微丸的耐酸性,因此具有较高的技术难度。作者采用流化床包衣工艺制备艾司奥美拉唑肠溶微丸,采用响应曲面法研究微丸肠溶层增塑剂比例、片剂辅料与肠溶微丸的比例及压片压力对片剂耐酸力和脆碎度的影响,优化肠溶层增塑剂柠檬酸三乙酯的用量、外加压片辅料的比例及压片压力,以制备出耐酸性及释放度均良好的艾司奥美拉唑镁肠溶片。
1 仪器与材料
LC-20AT高效液相色谱仪、UV-1800紫外分光光度计(日本岛津公司),Agilent 1200高效液相色谱仪(Agilent科技公司),ZRS-8G药物溶出仪、FT-2000A脆碎度检查仪、YD-35片剂硬度仪(天大天发科技有限公司),BSA124S电子天平(德国赛多利斯公司),DPL-Ⅱ制粒包衣机(重庆精工制药机械有限责任公司),DP30单冲压片机(北京国药龙立科技有限公司),ZPT10旋转式压片机(辽宁天亿机械有限公司)。
艾司奥美拉唑镁二水合物(METROCHEM API PRIVATE LIMITED,印度),羟丙甲基纤维素HPMC(E5)]、胃溶型薄膜包衣预混剂(上海卡乐康包衣技术有限公司),羟丙纤维素[HPC(EXF),美国AQUALON公司],EudragitL30D-55 水分散体(德国EVONIK公司),蔗糖丸芯(杭州高成生物营养技术公司),柠檬酸三乙酯(TEC,蚌埠丰原涂山制药有限公司),聚山梨酯80(南京威尔化工有限公司),滑石粉(广西龙胜华美滑石开发有限公司),单-双硬脂酸甘油酯(湖南尔康制药股份有限公司),微晶纤维素(MCC 105,JRSPHARMA GMBH & CO.KG,德国),聚维酮(PVP k30)、交联聚维酮(PVPP-XL)(德国BASF公司),硬脂酸镁(安徽山河药用辅料股份有限公司)。
2 方法
2.1 艾司奥美拉唑镁不同介质中的稳定性
精密称取艾司奥美拉唑镁二水合物原料药约108.5 mg,置于100 mL棕色量瓶中,用乙醇-水(体积比3∶1)混合溶剂溶解并定容至刻度,摇匀,制成质量浓度为1 g∙L-1艾司奥美拉唑的储备液。
精密量取上述储备液2 mL,置于100 mL棕色量瓶中,加pH值11.0磷酸盐缓冲液(每1 000 mL中含磷酸钠13.7 mmol与磷酸氢二钠55.1 mmol)稀释至刻度,摇匀,作为起始浓度测试溶液。
另精密量取艾司奥美拉唑储备液2 mL,分别用水、乙醇-水(体积比3∶1)混合溶剂、pH值1.0的盐酸溶液和pH值为4.0、6.0、6.8、7.4、11.0的磷酸盐缓冲液稀释至100 mL,摇匀。室温避光放置,分别于0、0.5、1、2、5、8 h取样,按“2.5”条色谱条件检测样品溶液的峰面积,以初始样品溶液的质量浓度设定为100折算各取样点含艾司奥美拉唑的相对百分含量,考察含量的变化,以评估主药在不同介质溶剂中稳定性。
2.2 艾司奥美拉唑镁肠溶片的制备
2.2.1 载药微丸的制备
称取羟丙纤维素EXF 10.4 g,分散溶解于292.5 g乙醇和97.5 g纯化水的混合溶剂中,依次加入聚山梨酯800.26 g、艾司奥美拉唑镁二水合物56.42 g和碳酸钙18.2 g,室温下搅拌10 min,经高速剪切分散均匀。称取糖丸40 g(180 ~25 μm)置于流化床中,设置进风频率20~30 Hz,进风温度45~55 ℃,预热10 min后采用流化床底喷工艺喷入含药混悬溶液进行包衣,泵液频率为6~12 Hz。喷液结束后,降低进风频率至15 Hz,干燥5 min,即得载药微丸。
2.2.2 隔离微丸的制备
称取羟丙甲纤维素E 523.4 g和羟丙纤维素(EXF)7.8 g,加入到780 g乙醇-水(质量比为3∶1)的混合溶液中搅拌分散溶解。将载药微丸52.8 g置于流化床中,设置进风频率20~35 Hz,进风温度45~55 ℃,预热10 min后喷入隔离包衣液进行包衣,泵液频率为6~12 Hz。喷液结束后,降低进风频率至15 Hz,干燥5 min,即得隔离微丸。
2.2.3 肠溶微丸的制备
称取单-双硬脂酸甘油酯2.54 g加至62.4 g热水中(温度不低于85 ℃),搅拌熔融完全,加入聚山梨酯800.51 g和适量柠檬酸三乙酯,高速剪切分散2 min,加入纯化水78 g并搅拌至室温,边加边搅拌缓慢倒入169 g EudragitL30D-55的水分散体中,搅拌5 min,制成肠溶层包衣液。将隔离微丸76.8 g置于流化床中,设置进风频率25~35 Hz,进风温度25~35 ℃,泵液频率为3~9 Hz,喷入肠溶层包衣液进行包衣。喷液结束后,降低进风频率至15 Hz,干燥5 min。将肠溶微丸平铺于托盘中,于38~42 ℃熟化2 h。将肠溶微丸与相当于肠溶微丸质量3%的滑石粉混合均匀,备用。
2.2.4 微晶纤维素颗粒的制备
称取微晶纤维素335 g置于流化床中,流化状态下采用顶喷工艺喷入质量分数5%的聚维酮K30水溶液制粒,进风频率20~30 Hz,进风温度50~60 ℃,喷液频率为20~30 Hz,喷液结束后,干燥至颗粒水分质量分数不大于3%。干燥后颗粒采用83 μm筛进行筛分和整粒,备用。
2.2.5 肠溶片剂的制备
按适当的比例分别称取艾司奥美拉唑镁肠溶微丸、微晶纤维素颗粒、交联聚维酮(PVPP-XL)、硬脂酸镁混合均匀,压片,采用胃溶型薄膜包衣预混剂进行包衣。
2.3 耐酸力(艾司奥美拉唑镁降解百分含量)检查
取本品适量,按《中华人民共和国药典》2015年版四部通则0931方法2中的溶出度与释放度测定法,以0.1 mol∙L-1盐酸溶液300 mL为释放介质,转速为100 r∙min-1,依法操作。经120 min时,加入0.3 mol∙L-1氢氧化钠溶液100 mL中和,用适量pH值11.0磷酸盐缓冲液转移至500 mL棕色量瓶中,超声溶解,冷却,加pH值11.0磷酸盐缓冲液定容至刻度,摇匀,过滤,取续滤液作为供试溶液。另取奥美拉唑对照品约20 mg,精密称定,置于100 mL量瓶中,加乙醇20 mL,超声使溶解,用pH值11.0磷酸盐缓冲液稀释至刻度,摇匀,滤过,精密量取续滤液5 mL,置于25 mL量瓶中,用水稀释至刻度,摇匀,作为对照溶液。按“2.5”条方法测定,按外标法以峰面积计算耐酸120 min后的微丸含量,以其与初始含量的差值评估耐酸力。
2.4 释放度检查
取本品适量,按《中华人民共和国药典》2015年版四部通则0931方法2中的溶出度与释放度测定法,以0.1 mol∙L-1盐酸溶液300 mL为释放介质,转速为100 r∙min-1,依法操作。经120 min时,在操作容器中加预热至37 ℃的86 mmol∙L-1磷酸氢二钠溶液700 mL,转速不变,继续依法操作,经30 min时,取溶液适量过0.45 μm微孔滤膜,精密量取续滤液5.0 mL置具塞试管中,精密加0.25 mol∙L-1氢氧化钠溶液1.0 mL,摇匀,作为供试溶液;另精密称取奥美拉唑对照品约50 mg,置于100 mL棕色量瓶中,加乙醇10 mL使溶解,用pH值6.8磷酸盐缓冲液稀释至刻度,摇匀,精密量取5.0 mL,置于50 mL棕色量瓶中,加pH值6.8磷酸盐缓冲液稀释至刻度,摇匀,精密量取5.0 mL,置具塞试管中,立即精密加入0.25 mol∙L-1氢氧化钠溶液1.0 mL,摇匀,作为对照溶液。取供试溶液和对照溶液,按“2.5”条方法测定,计算每粒的溶出量。
2.5 含量测定
色谱条件与系统适用性试验:色谱柱用十八烷基硅烷键合硅胶为填充剂,以乙腈-磷酸盐缓冲液(pH值7.3)(每1 000 mL中含磷酸二氢钠10.5 mmol与磷酸氢二钠30.0 mmol)-水(体积比35∶50∶15)为流动相,检测波长为302 nm。艾司奥美拉唑峰的保留时间应不小于3.5 min,理论板数按艾司奥美拉唑峰计算不低于2 000。
测定法:精密称取相当于含艾司奥美拉唑20 mg的微丸,置于100 mL量瓶中,加pH值11.0磷酸盐缓冲液(每1 000 mL中含磷酸钠13.7 mmol与磷酸氢二钠55.1 mmol) 60 mL,振摇20 min,加乙醇20 mL,超声使艾司奥美拉唑溶解,用pH值11.0磷酸盐缓冲液稀释至刻度,摇匀,滤过。精密量取续滤液5 mL,置于25 mL量瓶中,用水稀释至刻度,摇匀,作为供试溶液。精密量取供试溶液20 µL,注入液相色谱仪,记录色谱图;另取奥美拉唑对照品约20 mg,精密称定,置于100 mL量瓶中,加乙醇20 mL,超声使溶解,用pH值11.0磷酸盐缓冲液稀释至刻度,摇匀,滤过。精密量取续滤液5 mL,置于25 mL量瓶中,用水稀释至刻度,摇匀,同法测定,按外标法以峰面积计算含量,即得。
3 结果与讨论
3.1 艾司奥美拉唑镁在不同介质中的稳定性结果
艾司奥美拉唑在不同介质中的稳定性见表1。数据表明,药物在酸性介质中的稳定性很差,极易发生降解,在碱性介质中稳定,因此在制剂处方中因尽量避免主药与酸性辅料或酸性环境接触。
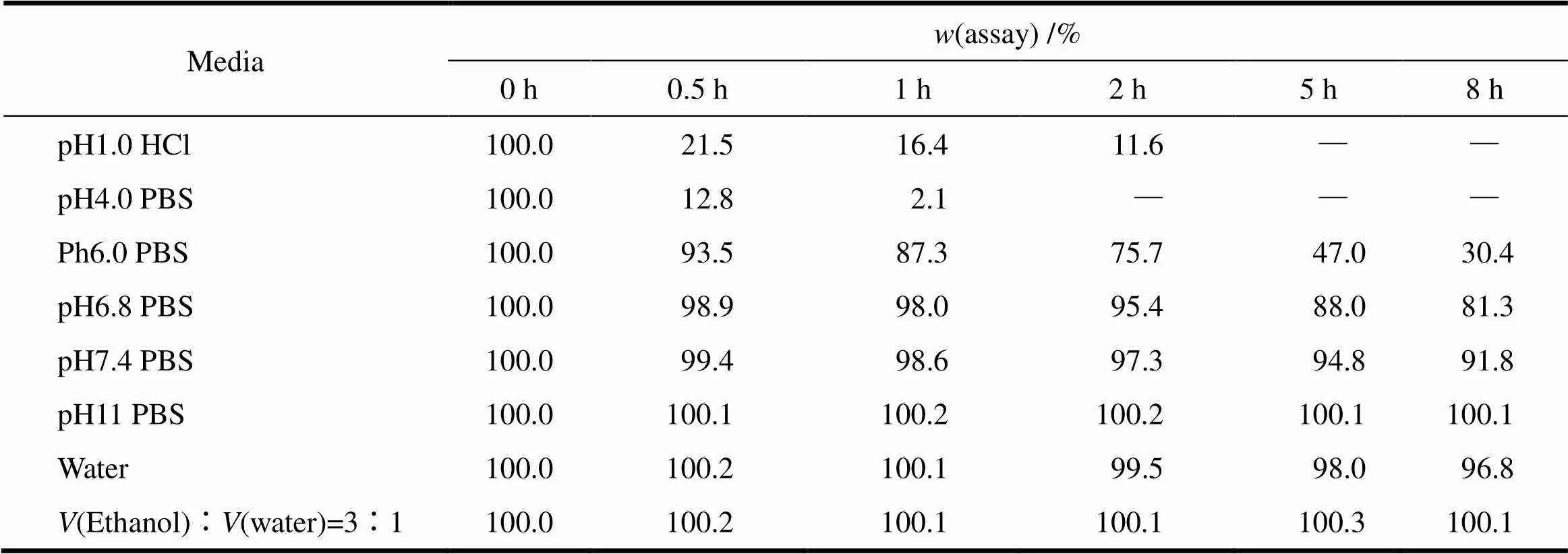
Table 1 Stability of esomeprazole magnesium in different media
3.2 采用相应曲面法优化艾司奥美拉唑镁肠溶片的处方工艺
3.2.1 参数设计
艾司奥美拉唑镁肠溶片采用肠溶微丸和适当的片剂辅料混合后压片,压片过程肠溶微丸的肠溶层因受到压片压力发生形变,如肠溶层韧性不足或片剂中辅料对肠溶微丸的保护不够会导致肠溶层破裂,从而降低艾司奥美拉唑镁肠溶片的耐酸力,影响片剂主药的释放和吸收。肠溶层的韧性主要由肠溶材料的种类、增塑剂的加入比例和包衣增质量决定,本品采用常用的Eudragit L30D-55作为肠溶材料,增塑剂TEC的加入量以肠溶材料固含量的20%~30%为宜,包衣增质量为55%~65%[1-2]。参考耐信P®P艾司奥美拉唑镁肠溶片中片剂辅料质量与肠溶微丸质量之比为2.5∶1,拟定片剂辅料质量与肠溶微丸质量的考察比例为1∶1~3∶1。压片过程中压片压力对片剂的成型影响非常大,增加压片压力可改善素片外观、硬度、脆碎度,其中脆碎度降低可增加包衣过程素片的耐磨性,降低包衣难度及改善包衣外观。增加压片压力的同时也会增加肠溶微丸肠溶层的形变,增加肠溶层破裂的风险,使肠溶片的耐酸力下降,因此将压片压力作为关键的参数进行研究,考察范围为8~16 kNP[3-7]。
3.2.2 响应曲面试验设计
采用上述3个变量参数,根据Box-Behnken响应曲面法的设计原理,设计了三因素三水平的响应曲面分析试验。试验共有17个试验点,3个因素为自变量,片剂耐酸力和脆碎度为响应值。试验因素和水平的选值见表2。按照Box-Behnken试验设计的统计学要求,采用Design–Expert 8.0.5b软件对方程中各项回归系数以17组试验进行回归拟合(表3)。从不同模型方差分析中的均方及检验结果综合来看(表4、5),二次多项式模型的拟合效果好于其它模型,因此优先采用二次多项式模型。
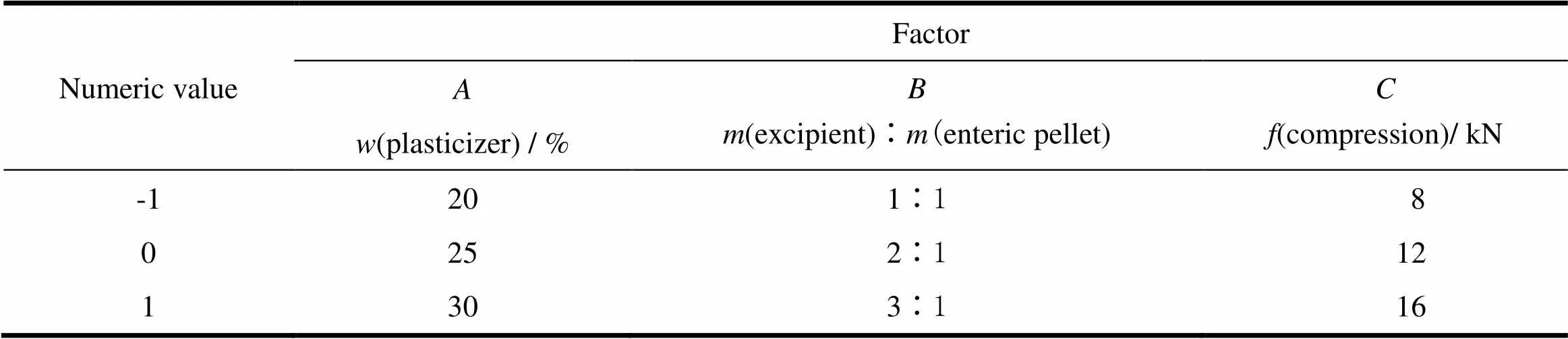
Table 2 Experiment factors and numeric value
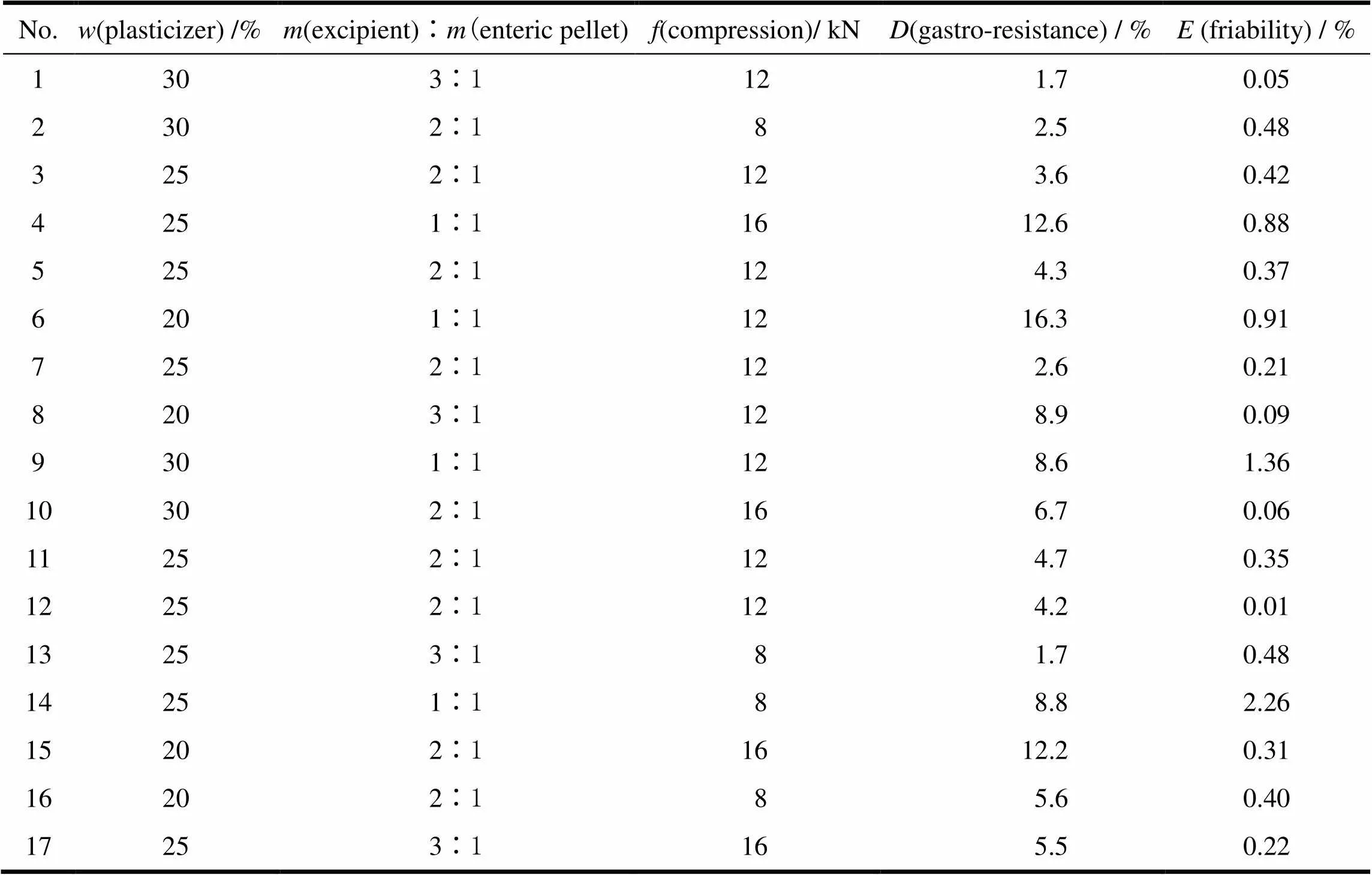
Table 3 The experiment design and results
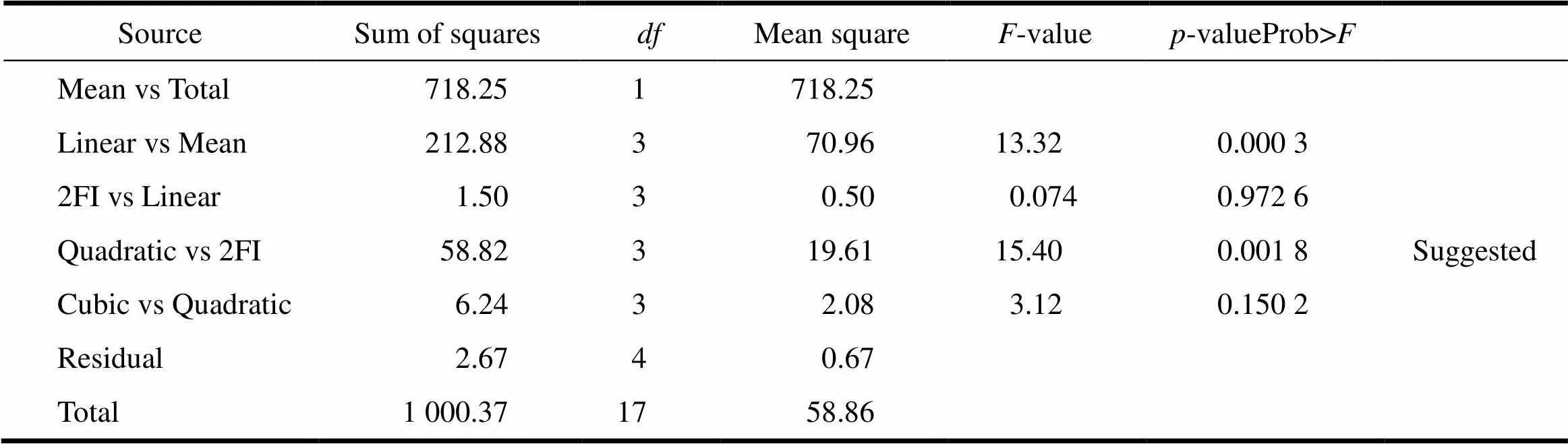
Table 4 The variance analysis of different models for gastro-resistance D
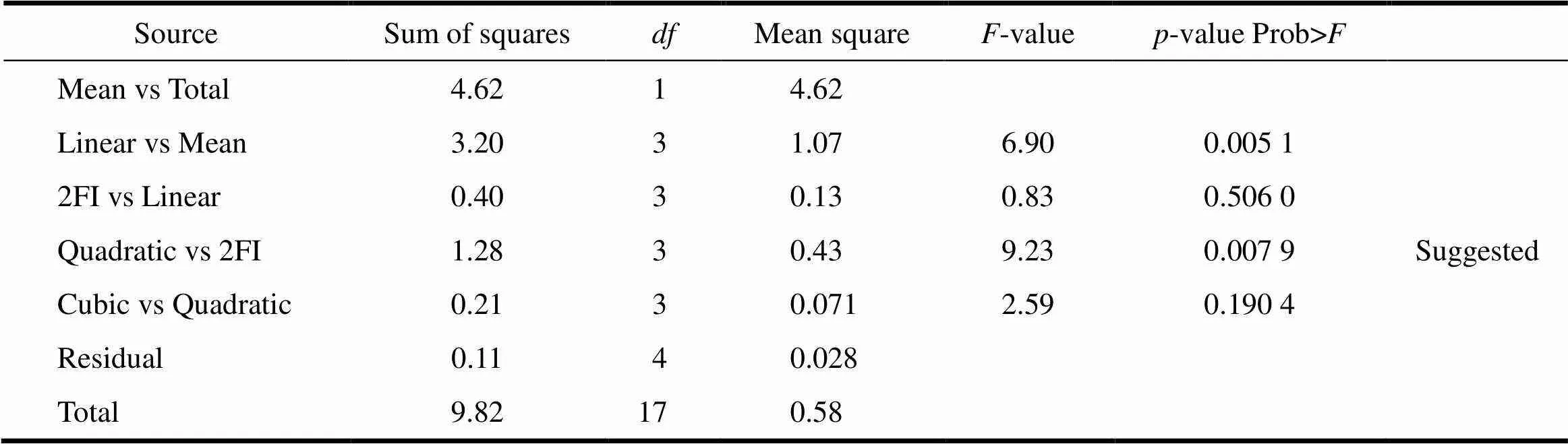
Table 5 The variance analysis of different models for friability E
3.2.3 相应方程的建立与显著性检验
通过对表3中耐酸力()和脆碎度()的试验数据进行多元回归,分别得到耐酸力()和脆碎度()对3个变量的二次多项回归方程:
=2.05+2.33-1.72+0.26+6.3×10-2-0.38+2.302+0.672+0.222;
=0.79-0.19-0.50-0.50-6.1×10P-2-5.2×10-2+8.7×10-2-0.162+0.122+7.8×10P-22。
耐酸力()和脆碎度()的回归模型方差分析和回归方程系数显著性检测见表6、7。由表6、7中模型的方差分析数据可知,模型拟合的效果是显著的(<0.05),失拟误差均不显著。在耐酸力()的反应曲面中,单因素片剂辅料与微丸质量之比()反应显著,二次项中增塑剂(TEC)含量质量分数2、辅料与微丸质量之比2显著,其他单因素、交互影响和二次项均不显著;在脆碎度()的反应曲面中,单因素片剂辅料与微丸质量之比()、压片压力()反应显著,片剂辅料与微丸质量之比()与压片压力()的交互影响显著,二次项中片剂辅料与微丸质量之比2显著,其他单因素、交互影响和二次项均不显著[8]。
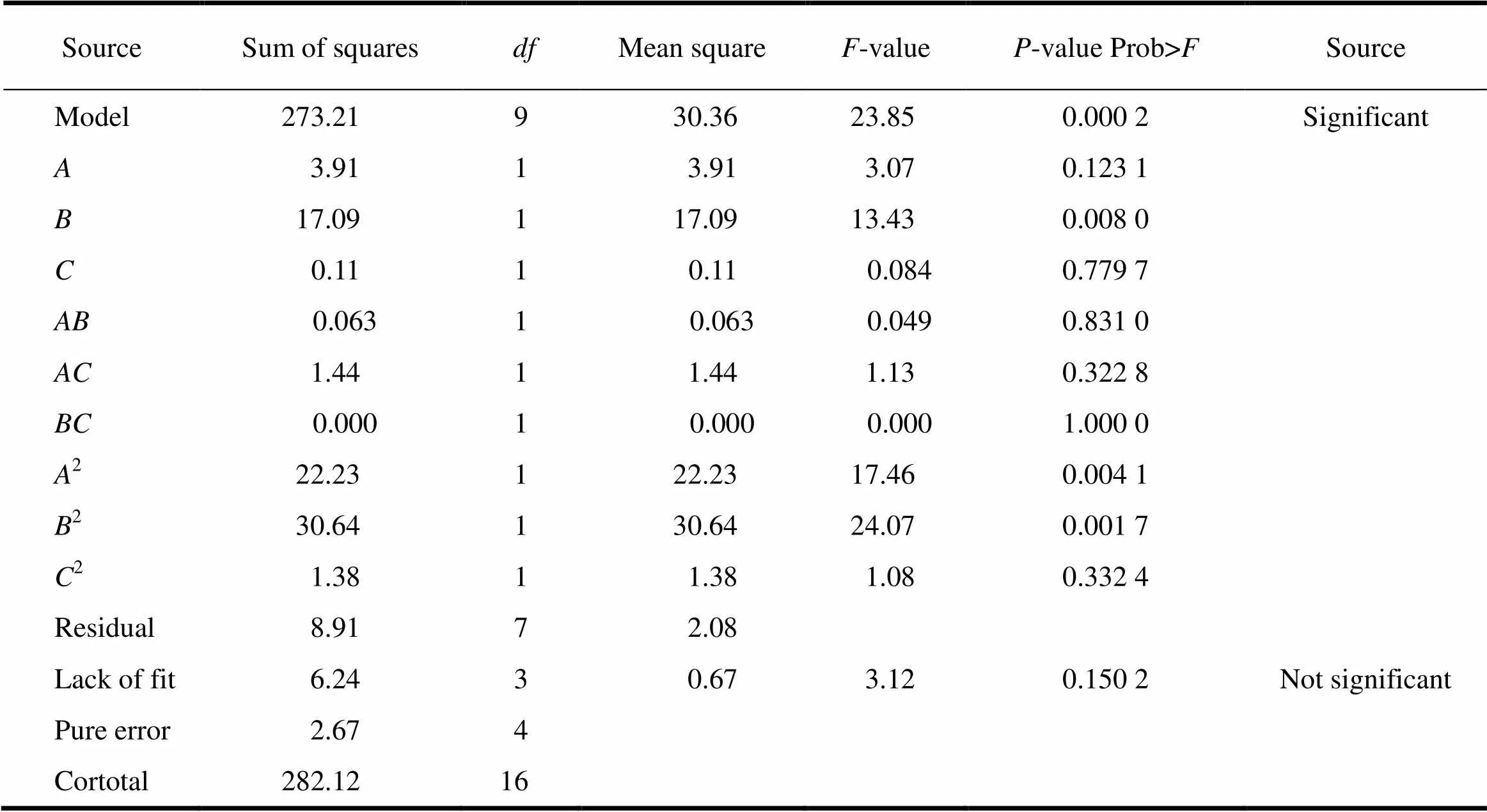
Table 6 The variance analysis of regression model and significance test of regression equation coefficient for gastro-resistance D
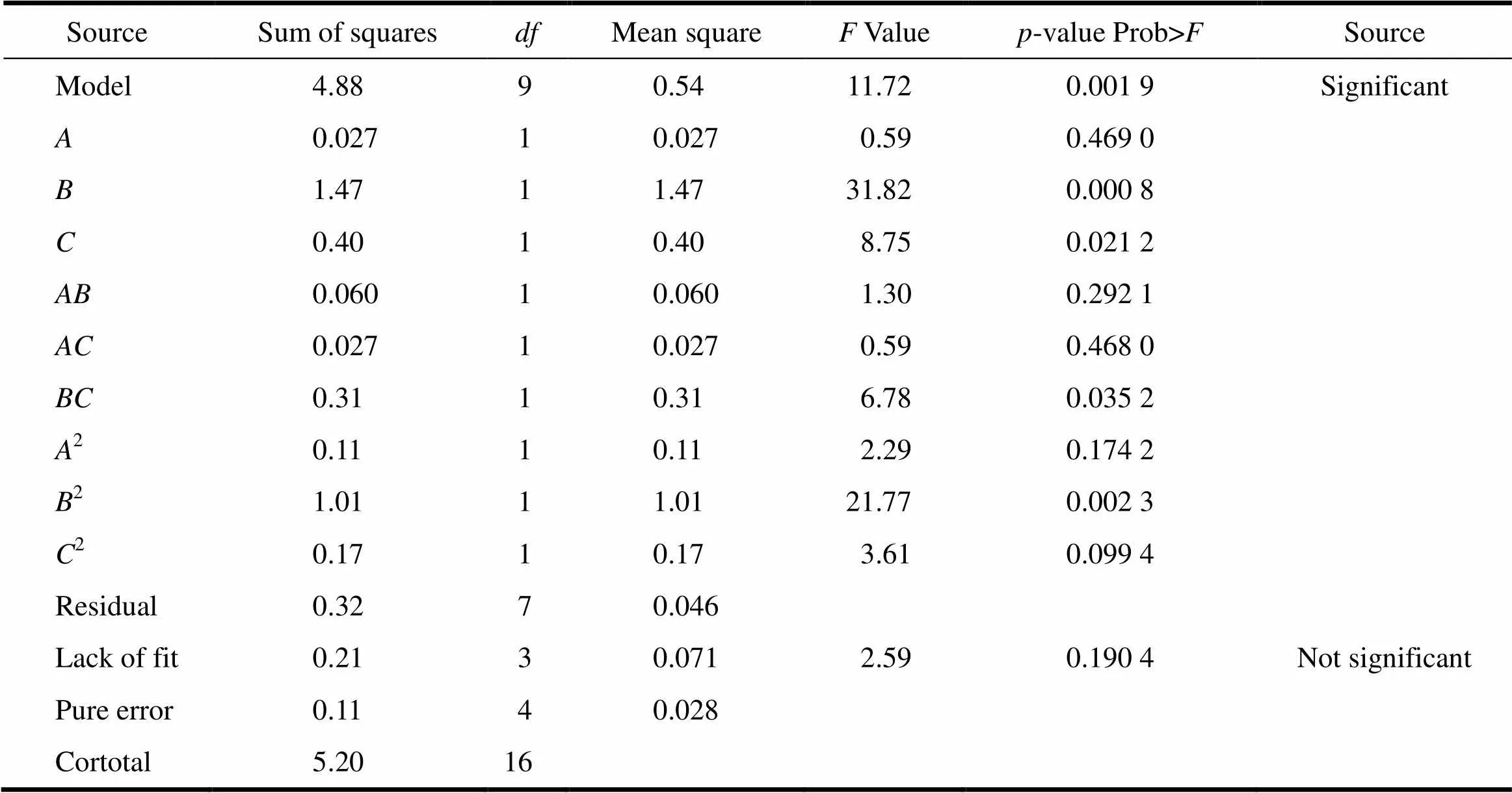
Table 7 The variance analysis of regression model and significance test of regression equation coefficient for friability E
3.2.4 响应曲面分析
由于脆碎度()的反应曲面中,片剂辅料与微丸质量之比()与压片压力()的交互影响显著,因此,可利用方程(2)做出脆碎度()的响应曲面图及其等高线图(图1、2)。从图1、2中可以看出,在肠溶层增塑剂用量一定的情况下,脆碎度()随片剂辅料与微丸质量之比()、压片压力()增加而减小,在片剂辅料与微丸质量之比()大于2、压片压力()大于10 kN的区域,片剂的脆碎度能得到很好的控制,有利于下一步的包衣工艺。
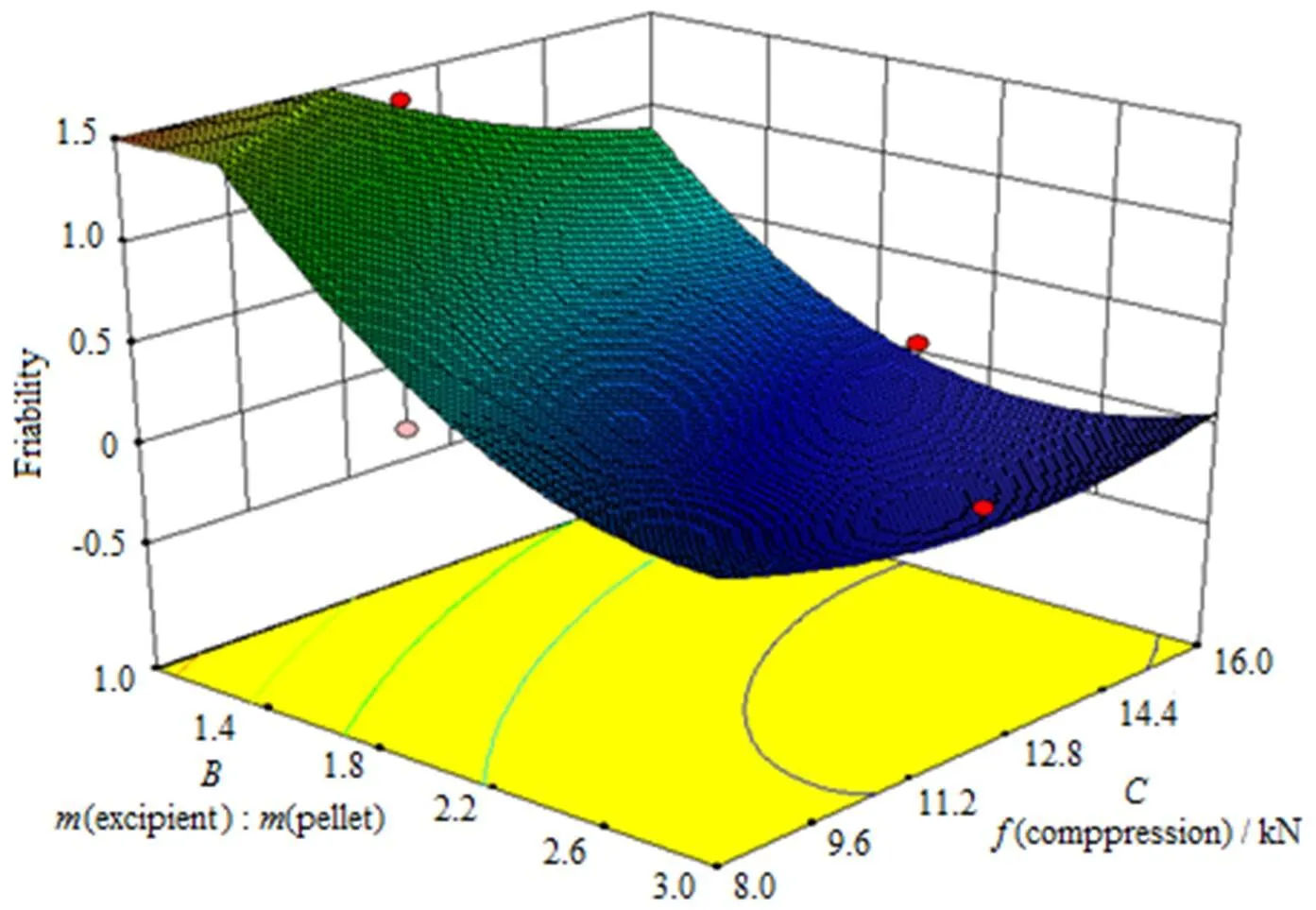
Fig. 1 The response surface of interactive influence on friability about(B) and (C)
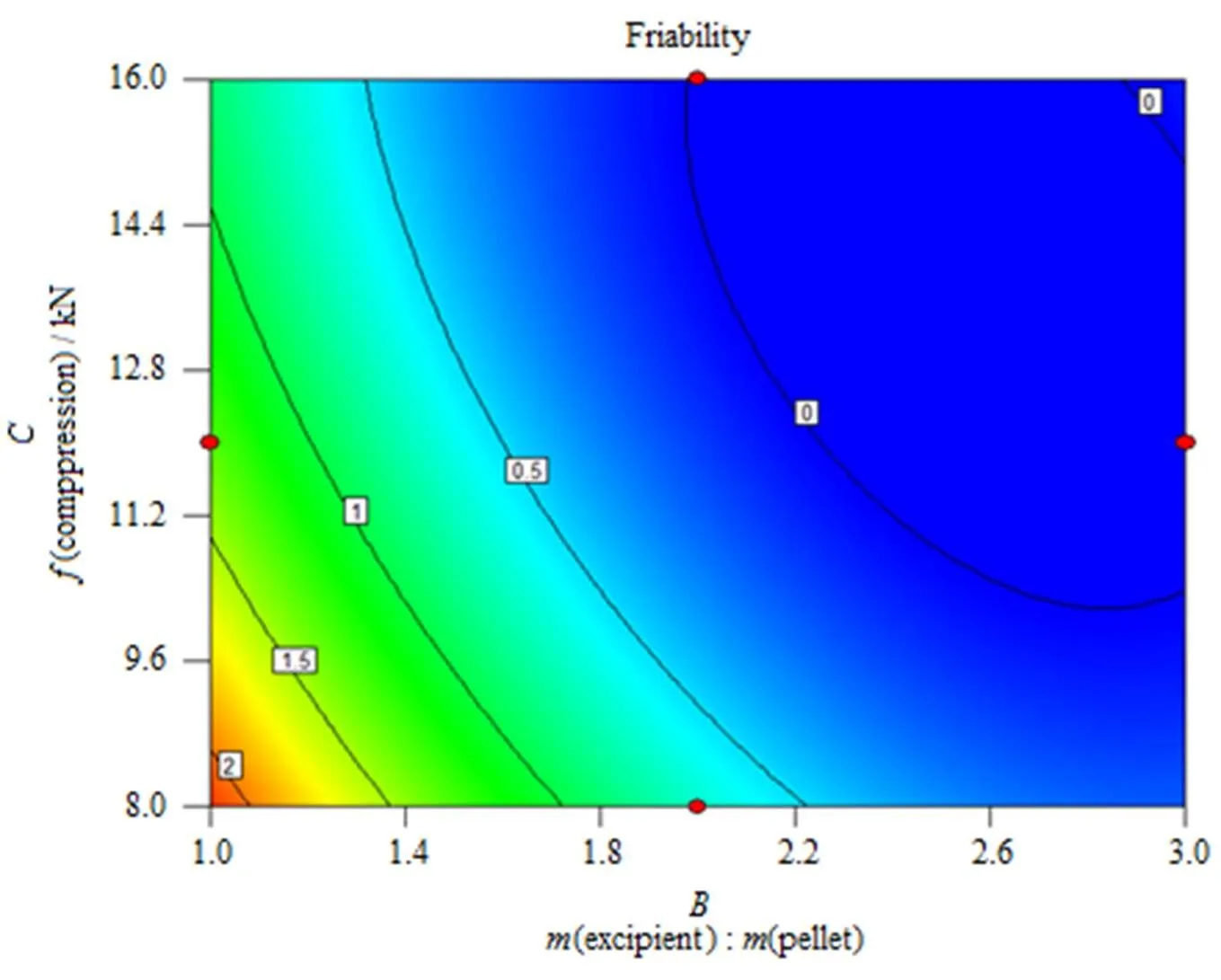
Fig. 2 The contour line of interactive influence on friability about (B) and (C)
3.2.5 考察因素优化及验证
结合回归模型的数学分析,耐酸力()达到最佳(耐酸2 h含量下降小于5%)和脆碎度()达到最小(脆碎度小于0.5%)的最优参数为:肠溶层增塑剂(TEC)含量质量分数()为29.57%(筛选范围为20%~30%)、片剂辅料与微丸质量之比()为2.71(筛选范围为1~3)、压片压力()为10.65 kN(筛选范围为8~16 kN),耐酸2 h含量下降1.5%,脆碎度为0.0%。按肠溶层增塑剂(TEC)含量质量分数()为30%、片剂辅料与微丸质量之比()为2.7、压片压力()为10~12 kN制备3批样品,素片耐酸2 h含量平均下降2.1%,脆碎度平均值为0.09%,表明优化的参数合理可行。素片采用胃溶型白色薄膜包衣预混剂进行包衣,测定包衣片与1批耐信®(英文商品名:Nexium®)艾司奥美拉唑镁肠溶片的溶出曲线,考察工艺的重现性,结果见图3。3批片剂样品的体外释放曲线重合度高,溶出速率与耐信®参比片剂相似。
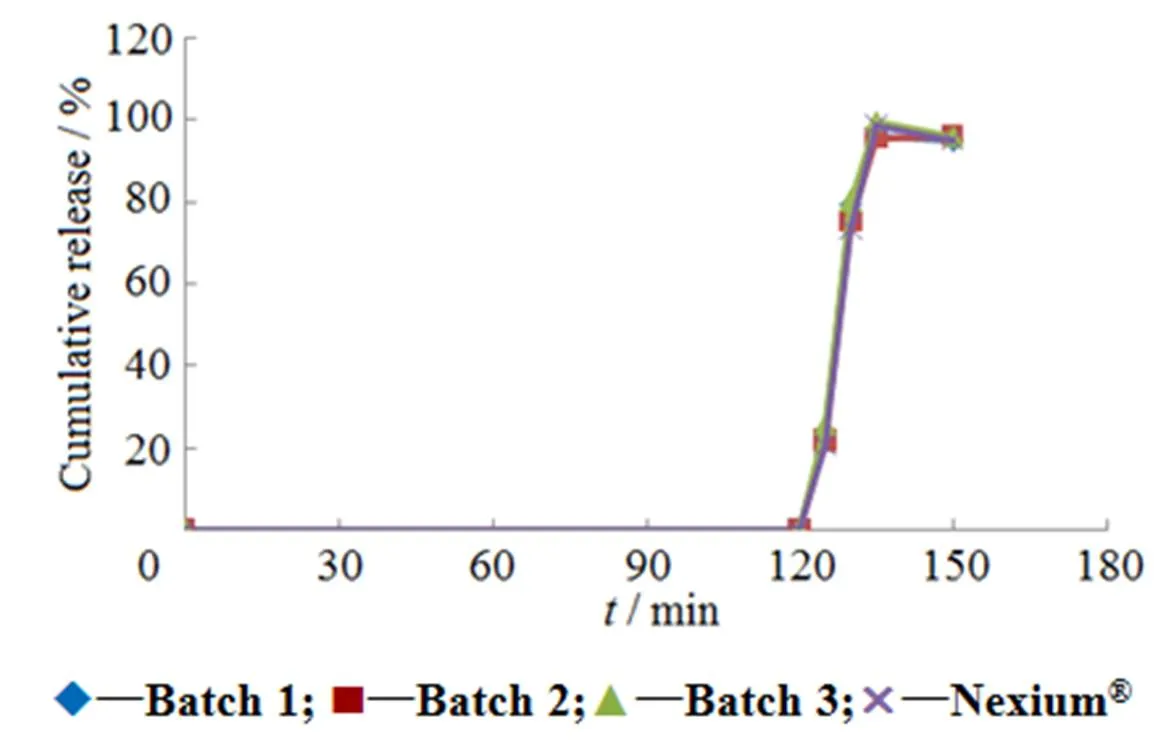
Fig.3 Dissolution profiles of esomeprazole magnesium enteric-coated tablets
4 结论
采用响应曲面法可全面考察单个因素及因素之间的交互作用,试验次数少,灵活高效,在数值模拟的结果分析中运用可显著提高分析效率。采用响应曲面法优化影响艾司奥美拉唑镁肠溶片压片成型的三个关键因素:肠溶层增塑剂含量质量分数为30%,片剂辅料与肠溶微丸质量之比为2.7,压片压力为10~12 kN,制备的肠溶片耐酸2 h含量下降小于3%,素片脆碎度小于0.2%,包衣效果良好,回归分析和验证试验表明响应曲面法的合理性和可行性。该肠溶片的体外释放满足溶出要求,批间释放均一性良好,溶出曲线与参比片剂相似,表明制备工艺重现性良好。
[1] 陈眉眉, 王成润, 金一. 泮托拉唑钠肠溶微丸型片剂的制备[J]. 药学学报, 2011, 46(1): 96-101.
[2] 安岳, 邹梅娟, 程刚. 兰索拉唑肠溶微丸片的制备[J]. 中国药剂学杂志, 2014, 12(5): 151-159.
[3] 赵玉娜, 郑春丽, 刘建平, 等. 微丸压片技术的研究进展[J]. 中国新药杂志, 2012, 21(19): 2287-2291.
[4] 刘志华, 方瑜, 吴晓辉, 等. 兰索拉唑肠溶微丸片的研制[J]. 中国医药工业杂志, 2013, 44(11): 1106-1110.
[5] 张媚媚, 韩珂, 吴传斌. 微丸压片工艺研究进展[J]. 国际药学研究杂志, 2008, 35(2): 128-132.
[6] MURAT T, HAKAN V, MINE C. Tableting and stability evaluation of enteric-coated omeprazole pellets [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2004, 57: 279-286.
[7] ANN D, CHRIS V, DEBBY M, et al. Compaction of enteric-coated pellets: influence of formulation andprocess parameters on tablet properties andevaluation[J]. European Journal of Pharmaceutical Sciences, 2004, 22: 305-314.
[8] RUJIVIPAT S, BODMEIER R. Moisture plasticization for enteric Eudragit®L30D-55-coated pellets prior to compression into tablets[J]. Eur J Pharm Biopharm, 2012, 81(1): 223-229.
Preparation of esomeprazole magnesium enteric-coated pellets- type tablets
CHEN Haijian1,2,CHAN Yunxia2,XIAN Lei1,CHAI Jifeng2,DING Pingtian1*
(1.,110016,; 2..,101113,)
To study the preparation of esomeprazole magnesium enteric-coated pellets-type tablets.The esomeprazole magnesium enteric-coated pellets were prepared by fluid bed coating technology. The central composite rotatable design (CCRD) and response surface methodology (RSM) of three factors and three levels were used to study the effect of plasticizer ratio in pellet enteric layer, ratio of excipients/enteric pellets and compression force on the gastro-resistance and friability of the tablets.The content of plasticizer in enteric layer of the pellets was within 20%–30%, the gastro-resistance would improve with the rise of the ratio of excipients/enteric pellets. Besides, the growth in plasticizer content would also improve the gastro-resistance. The increase of the ratio of excipients/enteric pellets and compression force could reduce the friability of tablets. The optimal formulation and process parameters such as plasticizer content, the ratio of excipients/enteric pellets, compression force were 30%, 2.7, 10-12 kN, respectively. Under the optimal conditions, the content of enteric-coated tablets decreased by 2.1% in hydrochloric acid (pH1.0) within 2 h, and the friability of tablets was 0.09%.The release behaviors of esomeprazole magnesium enteric-coated tablets are similar with Nexium®reference tablets, and the formulation and technology explored in this paper can be appliedinindustrial production.
pharmaceutics; pellet compression; response surface methodology; esomeprazole magnesium; gastro-resistance
(本篇责任编辑:赵桂芝)
(2017)05–0101–10
10.14146/j.cnki.cjp.2017.05.001
R94
A
2016-03-10
陈海建( 1978-),男( 汉族),江苏泰州人,执业药师,从事化学药品研发工作,E-mail ch_shangyi@163.com;
*通讯作者:丁平田( 1969-) ,男(汉族),山东临朐人,教授,博士,博士生导师,主要从事药物新剂型和新技术研究,Tel. 024-23986305,E-mail dingpingtian@qq.com。
